| GLIOMAS
A grande
maioria dos tumores primários do sistema nervoso central originam-se
em células da glia e são genericamente conhecidos como gliomas.
Predominam os constituídos por astrócitos, chamados
astrocitomas,
seguindo-se os tumores de oligodendrócitos ou oligodendrogliomas
e os de células ependimárias, ou ependimomas.
Os astrocitomas
dividem-se em dois grupos básicos : os astrocitomas
difusos e os astrocitomas
pilocíticos. Outros tumores mais raros,
como o xantoastrocitoma pleomórfico
e o astrocitoma subependimário de células gigantes da esclerose
tuberosa também estão no grupo.
ASTROCITOMAS
DIFUSOS
Definição.
Astrocitomas
difusos são tumores comuns derivados de astrócitos e predominam
na idade adulta. Podem afetar qualquer área do sistema nervoso,
mas a grande maioria situa-se na substância branca dos hemisférios
cerebrais, com variável envolvimento do córtex. Outras
localizações são os tálamos, o tronco cerebral
(aqui com predomínio em crianças) e a medula espinal.
A notável exceção é o cerebelo, onde astrocitomas
difusos são raríssimos, praticamente restritos a casos de
neurofibromatose
do tipo 1.
Como o nome
indica, astrocitomas difusos são tumores mal delimitados, de bordas
imprecisas, em que as células neoplásicas infiltram os elementos
nervosos pré-existentes, inclusive neurônios, neurópilo
e feixes axonais da substância branca. A falta de limites nítidos
é aparente já nos exames de imagem, e confirma-se na macroscopia.
Mesmo ao exame histopatológico, é geralmente muito difícil,
se não impossível, definir onde realmente o tumor termina,
porque as células tumorais permeiam e se misturam às células
normais. Além disso, células normais e tumorais podem ser
morfologicamente muito semelhantes nos tumores de baixo grau.
A má
delimitação e caráter infiltrativo dos astrocitomas
difusos dificulta ablações curativas, exceto nos raros tumores
pequenos em localizações não eloqüentes.
A tendência destas lesões é, portanto, recidivar, em
um intervalo de tempo influenciado pela quantidade de tecido residual e
pela malignidade do tumor.
Incidência.
Astrocitomas difusos são os tumores intracranianos mais freqüentes
(mais de 60 % dos tumores cerebrais primários, ou 5 a 7 casos novos
por 100.000 habitantes/ano). Quanto menor o grau histológico, mais
precoces as manifestações clínicas. Média de
idade quando da cirurgia: grau II: 39 anos; grau III: 41 anos, grau
IV: 52,5 anos. Relação homens:mulheres: 1,4 a 1,5.
Caráter invasivo.
O mau prognóstico dos astrocitomas difusos é devido ao caráter
infiltrativo, que impede remoção completa. O corpo caloso
é uma importante via de disseminação (ver).
A base biológica da infiltração envolve interações
intercelulares, adesão à matriz extracelular, degradação
proteolítica desta e motilidade das células neoplásicas.
Tumores multicêntricos.
Quase sempre o tumor é único, mas há casos que parecem
mostrar tumores em focos separados, aparentemente independentes.
Isto se deve à infiltração das células tumorais
à distância pelos feixes axonais de projeção,
como o corpo caloso, fórnix e vias de associação interlobar
(fronto-temporal, fronto-occipital). Células que se propagaram
longe do tumor de origem podem sofrer novas mutações e desenvolver
clones mais agressivos, que sobrepujam os já existentes e crescem
mais rápido, aparecendo como novos tumores. Para exemplos de propagação
à distância deste tipo, clique (1)
(2).
A progressão a
graus mais altos de malignidade
é uma propriedade intrínseca dos astrocitomas difusos, mas
imprevisível pela clínica ou histopatologia. Alguns astrocitomas
passam muitos anos sem alteração no padrão histológico,
outros sofrem progressão à anaplasia em 1-2 anos. A anaplasia
pode ser difusa ou ocorrer em áreas circunscritas, que representariam
clones de células que sofreram novas mutações genéticas.
As áreas mais anaplásicas é que devem ser usadas para
definir-se o grau. Para exemplos de focos anaplásicos em exames
de imagem e em anatomia patológica,
clique.
Exames de
imagem.
TC (tomografia
computadorizada). Os astrocitomas difusos de baixo grau apresentam-se
como massa localizada ou difusa, hipodensa na tomografia sem contraste,
e que não sofre impregnação com contraste. Captação
focal de contraste sugere transformação anaplásica
e corresponde a perda da barreira hemoencefálica por proliferação
de pequenos vasos tumorais.
..
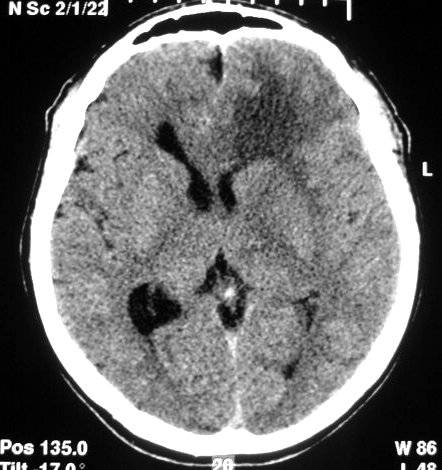
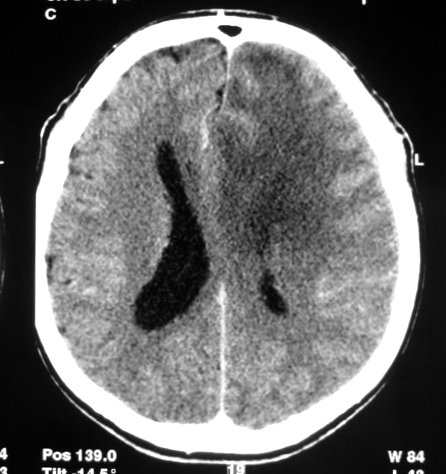
| Sem
contraste |
Com
contraste |
 |
 |
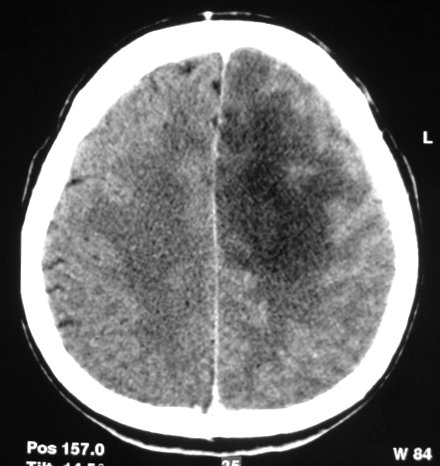 |
| M.
44 a. Astrocitoma difuso frontal E. TC. Área hipodensa
com limites imprecisos na substância branca do lobo frontal E. Com
contraste, não há impregnação. Efeito de massa,
desvio da linha média. |
..
RM (ressonância
magnética). Os astrocitomas difusos de baixo grau são
geralmente mal delimitados, hipointensos em T1 e hiperintensos
em T2, alterações de sinal estas devidas ao maior grau de
hidratação do tumor em relação ao tecido nervoso
normal. Enquanto de baixo grau, os astrocitomas difusos não
sofrem impregnação pelo contraste paramagnético (gadolínio).
Em geral, apresentam textura sólida, mas pode haver degeneração
cística em graus variáveis. Como na TC, impregnação
por contraste é sinal de anaplasia e evolução para
grau de malignidade mais alto. RM permite análise detalhada da topografia
do tumor, relação com estruturas normais do cérebro,
e presença de hérnias cerebrais.
A localização
mais comum é nos hemisférios cerebrais, com preferência
pela região fronto-temporal. São muito raros no cerebelo,
onde só são vistos no contexto da NF1.
Em crianças, astrocitomas difusos, inclusive os de alto grau (glioblastomas)
têm preferência pelo tronco cerebral, especialmente a ponte,
e pelo tálamo. Abaixo, exemplos. Para quadro completo dos
casos com exames de imagem, clique.
..
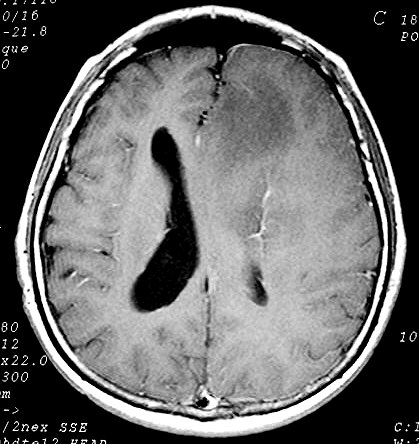
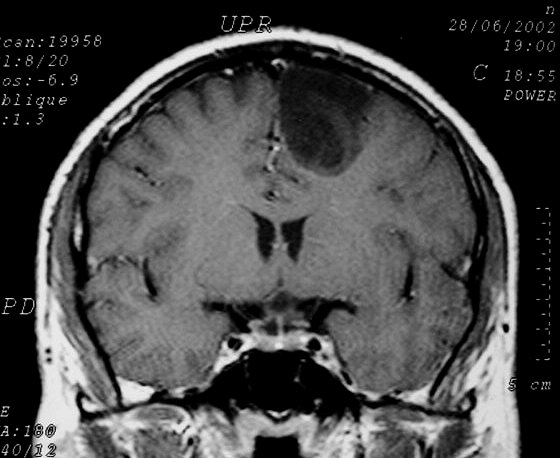
| Astrocitoma
difuso de baixo grau em RM (3
casos). As lesões são hipointensas em T1 porque altamente
hidratadas. A delimitação com o tecido vizinho é variável,
de nítida a borrada. A textura é variável, com áreas
mais e menos sólidas. Com contraste, não se impregnam. |
 |
 |
 |
| M. 44 a.
Astrocitoma difuso frontal. T1 com contraste. Mesmo caso da TC acima. |
M. 33 a.
Astrocitoma difuso de baixo grau frontal mesial E. T1 com contraste. |
M. 36 a.
Astrocitoma difuso de baixo grau frontal basal E. T1 sem contraste. |
....
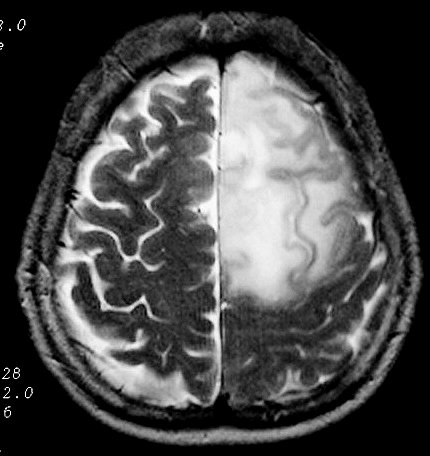
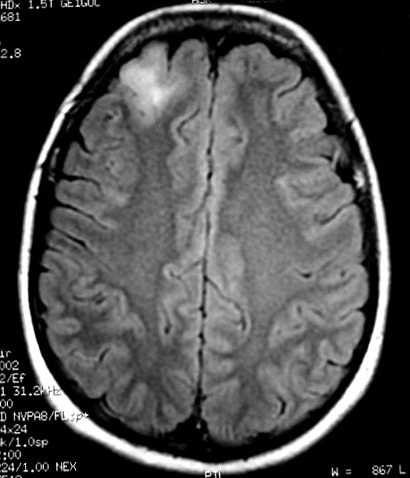
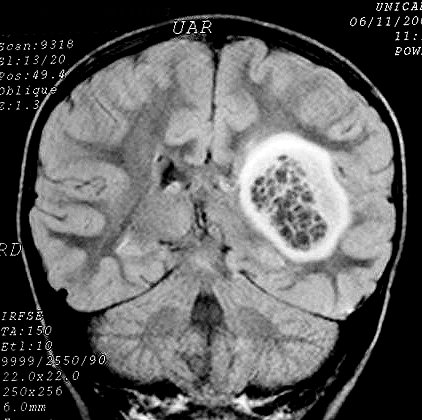
| RM
no TR longo (3 casos).
As seqüências de RM com TR (tempo de repetição)
longo, T2 e FLAIR, são valiosas para identificação
destes astrocitomas, porque as lesões hidratadas brilham e mesmo
pequenos tumores se destacam. |
 |
 |
 |
| M. 44 a.
Astrocitoma difuso frontal E. Grande lesão hiperintensa em T2 afetando
mais a substância branca, com limites imprecisos. T2. Mesmo caso
da TC acima. |
F. 47 a.
Pequeno astrocitoma difuso frontal D (achado de exame, confirmado por biópsia
estereotáxica). FLAIR. Lesão córtico-subcortical
distingue-se do cérebro pela sua hiperintensidade. |
M. 7 a.
Astrocitoma difuso profundo, sólido-cístico, fronto-têmporo-parietal
E. FLAIR. Periferia sólida, interior multicístico. A supressão
do sinal da água livre permite visualizar as diferenças de
textura do tumor. |
....
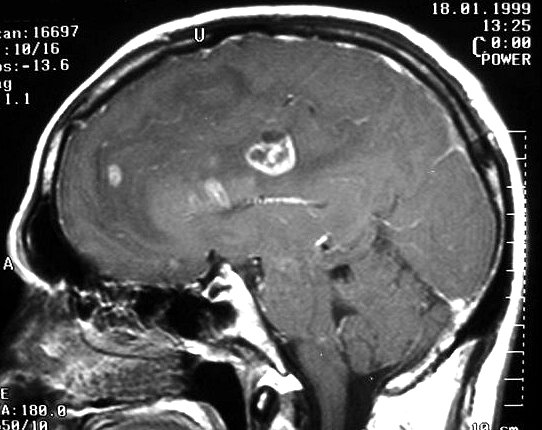
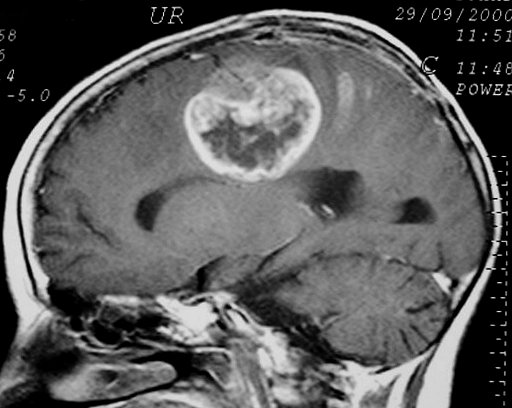
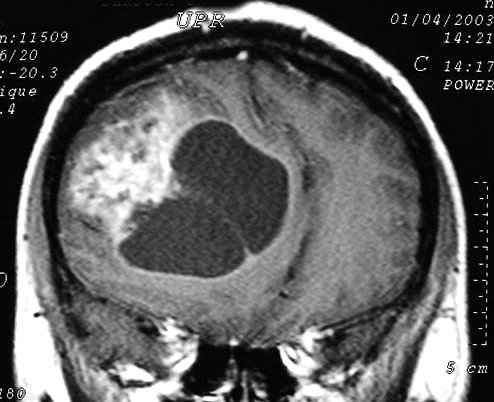
| Astrocitomas
anaplásicos.
O aparecimento de anaplasia em um tumor de baixo grau é assinalado
por focos de impregnação por contraste, que podem ser pequenos
e múltiplos, ou únicos e extensos, atingindo grande parte
da neoplasia. Não raro estes tumores apresentam um componente cístico
que não se impregna, e que pode conter líquido ou material
necrótico. As fotos abaixo são de 3 casos, todas em
T1 com contraste. |
 |
 |
 |
| M. 53 a.
Astrocitoma difuso anaplásico. Extensão contralateral via
corpo caloso. T1 com contraste. |
F. 10 a.
Astrocitoma difuso anaplásico de centro semioval E. T1 com contraste. |
M. 32 a.
Astrocitoma difuso gemistocítico anaplásico frontal D, com
componentes sólido e cístico. T1 com contraste. |
..
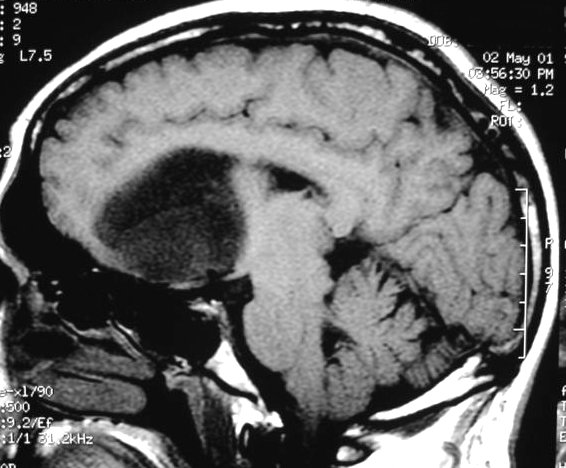
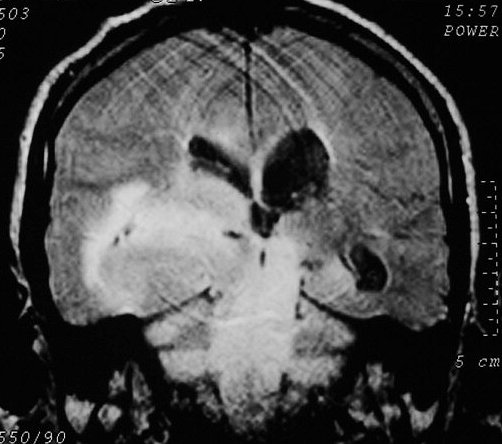
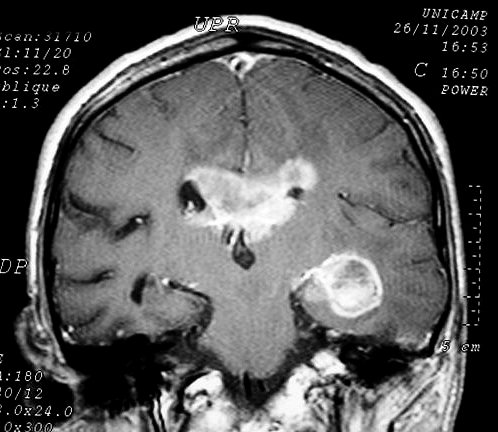
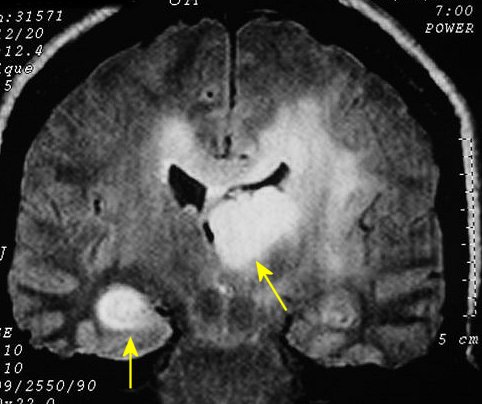
| Extensão
à distância. Uma
feição importante dos astrocitomas difusos, independente
do grau, é a invasão de estruturas vizinhas e disseminação
ao longo de tratos axonais de longa distância, como o fórnix.
Abaixo, três casos mostrando: à E., extensão ao tronco
cerebral; e centro e D., extensão ao hipocampo via fórnix
de tumores situados respectivamente no corpo caloso e tálamo. Neste
último a extensão foi ao hipocampo contralateral, mostrando
que o tumor atravessou a comissura do fórnix. |
 |
 |
 |
| M. 52 a.
Astrocitoma difuso temporal, com extensão ao tronco cerebral e cerebelo.
FLAIR. |
M. 68 a.
Astrocitoma anaplásico de corpo caloso infiltrando do hipocampo
E à região hipotalâmica via fórnix. T1 com contraste. |
F. 51 a.
Astrocitoma difuso talâmico E, extensão ao hipocampo D (via
comissura do fórnix), ao centro semioval e corpo caloso. FLAIR. |
..
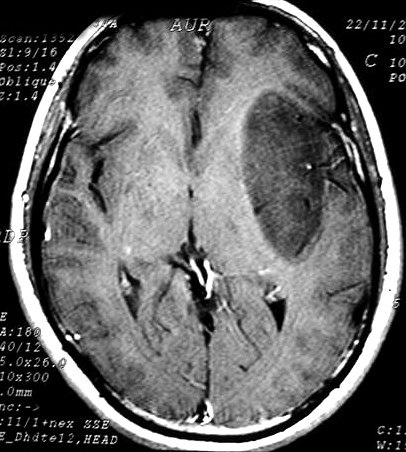
| Astrocitomas
de região insular. Astrocitomas
em certas localizações constituem verdadeiras entidades
anátomo-clínicas. Os astrocitomas insulares tendem
a ser tumores bem delimitados, pouco invasivos, e manter-se de baixo grau
em sua longa evolução. |
 |
 |
 |
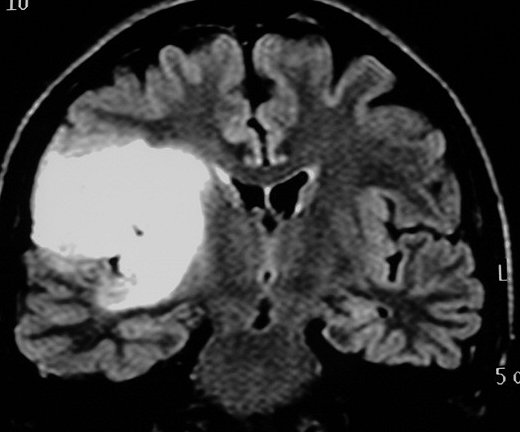
| M. 34 a.
Astrocitoma difuso de região insular. T1 com contraste. |
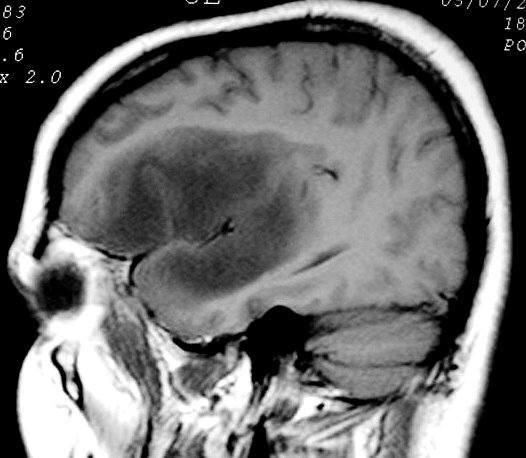
M. 38 a.
Lesão semelhante, em outro paciente. Tumor bem delimitado
no lobo da ínsula, que desloca os núcleos da base e tálamo.
FLAIR. |
F. 40 a.
Astrocitoma difuso de ínsula e regiões limítrofes
dos lobos frontal e temporal D. T1 sem contraste. |
..
| Astrocitomas
de tálamo. Tendem
a ser mais infiltrativos e progredir para graus de malignidade mais altos,
apresentando focos de anaplasia que se impregnam com contraste. Podem
estender-se ao hipocampo via fórnix e ao tálamo contralateral. |
 |
 |
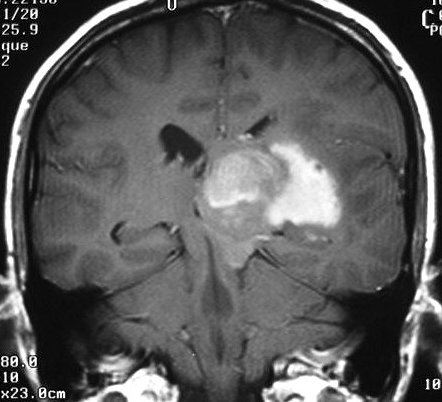 |
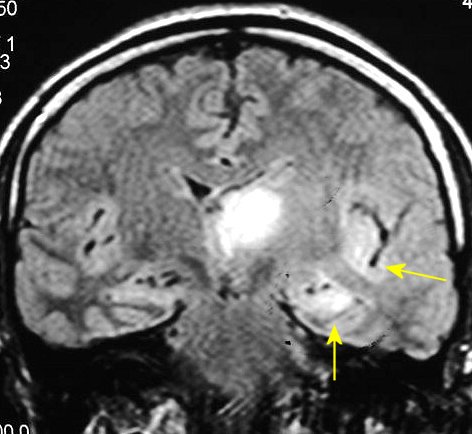
| M. 52 a.
Astrocitoma difuso de tálamo E, com extensão ao hipocampo
e ínsula ipsilaterais. FLAIR. |
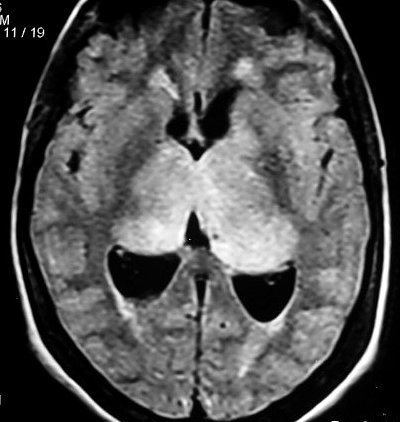
F. 43 a.
Astrocitoma difuso talâmico bilateral. FLAIR. |
M. 37 a.
Astrocitoma difuso talâmico anaplásico com hérnia transtentorial
descendente. T1 com contraste. |
..
| Astrocitomas
de tronco cerebral. Tendem
a ocorrer mais em crianças, sendo a localização mais
comum a ponte. Podem ser lentamente infiltrativos, ou evoluir logo para
gliomas de alto grau. |
 |
 |
 |
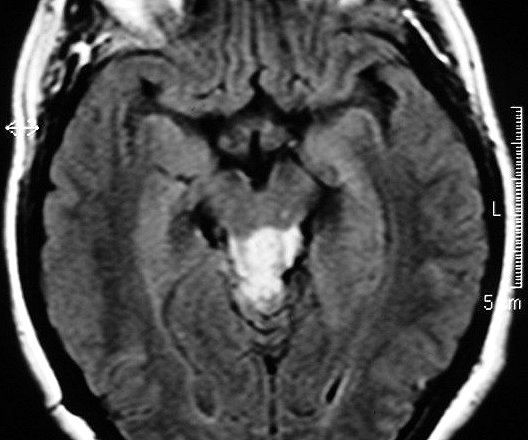
| F. 46 a.
Astrocitoma difuso mesencefálico, periaquedutal. FLAIR. |
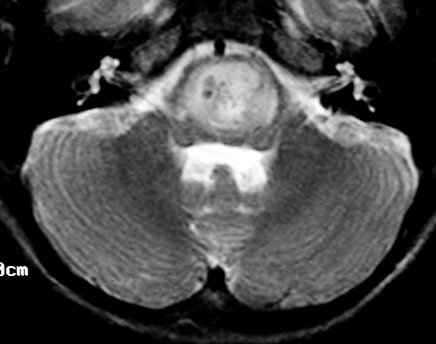
M. 8 a.
Astrocitoma difuso da base da ponte. T2. |
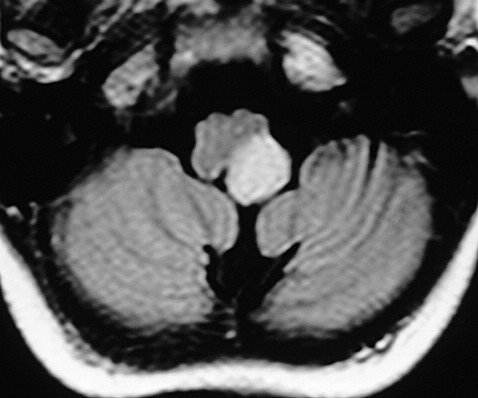
F. 11 a.
Astrocitoma difuso do bulbo. FLAIR. |
..
Anatomia
Patológica em material de autópsia.
..
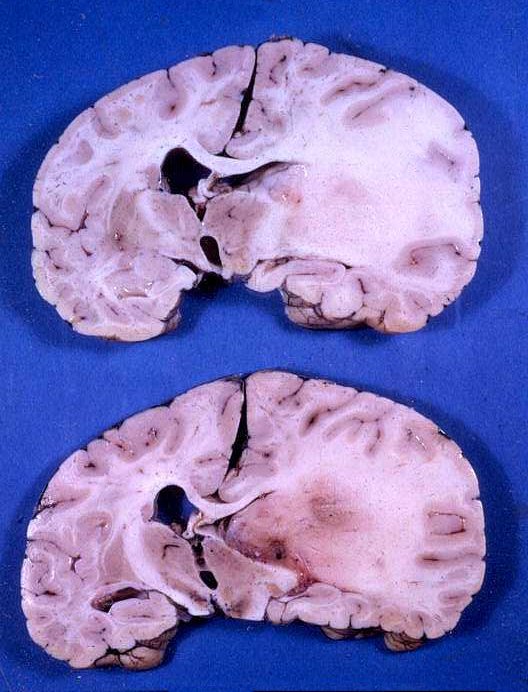
| Astrocitomas
de hemisférios cerebrais. |
 |
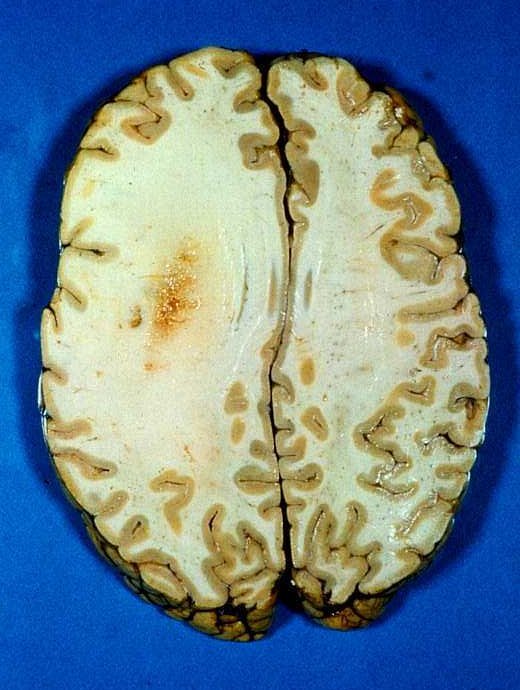 |
| Astrocitomas
difusos de hemisfério cerebral têm cor branca e limites imprecisos,
não sendo possível saber onde termina o tumor. Regiões
mais acinzentadas podem representar áreas protoplasmáticas
mais celulares, ou áreas mais vascularizadas com transformação
anaplásica. Para mais sobre astrocitomas no curso de graduação,
clique. |
..
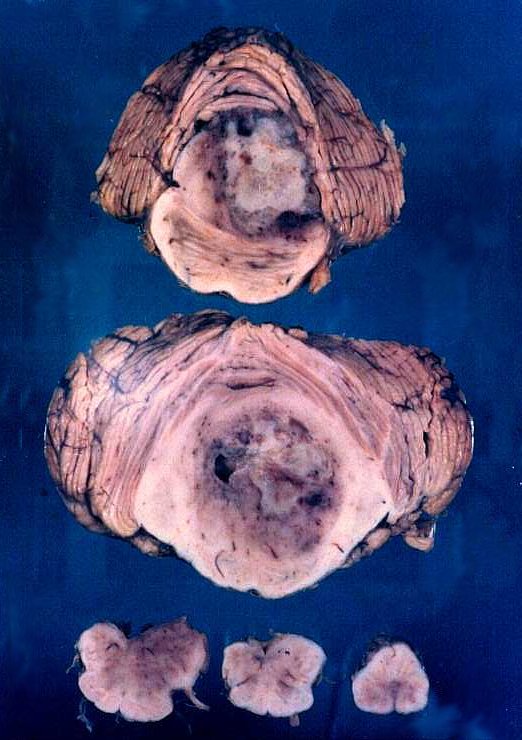
| Astrocitomas
do tronco cerebral. |
 |
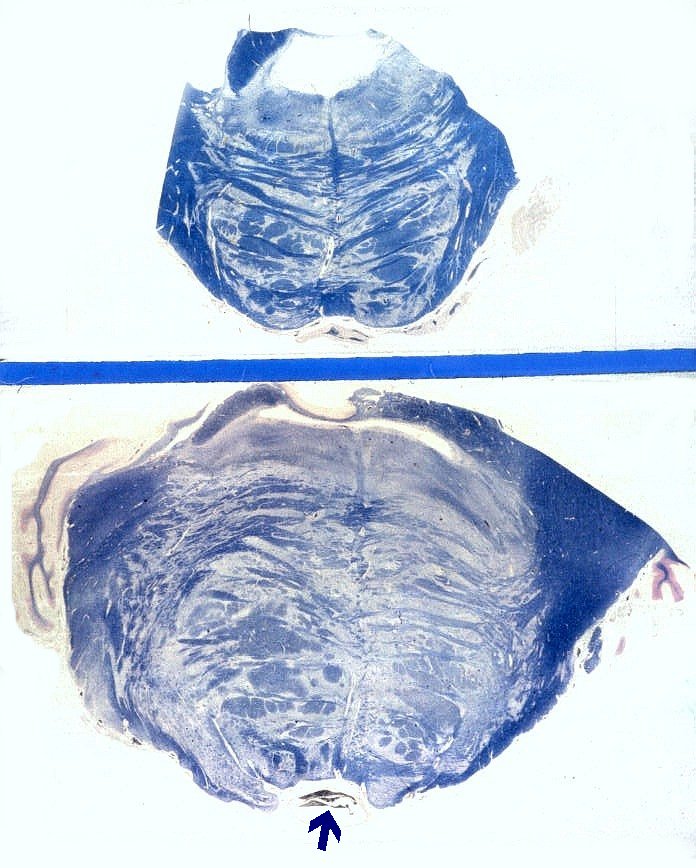 |
| Astrocitomas
do tronco cerebral são mais comuns em crianças e podem apresentar
áreas anaplásicas, como ocorre nos hemisférios cerebrais.
Na fig. da E, um grande tumor de centro necrótico no tegmento da
ponte, com extensão ao bulbo.
Na fig.
da D., dois cortes de ponte corados para mielina e reproduzidos no mesmo
aumento. O de cima é normal. O de baixo apresenta um astrocitoma
de baixo grau, mas difusamente infiltrativo, da ponte. À primeira
vista, nem se nota o tumor, estando os fascículos mielínicos
bem preservados. Há, porém, grande aumento de volume da ponte
(quase o dobro do normal), deformação do IVº ventrículo
e lingüetas de tecido 'tentando abraçar' a artéria basilar
(seta). |
..
Anatomia
Patológica em peças cirúrgicas.
..
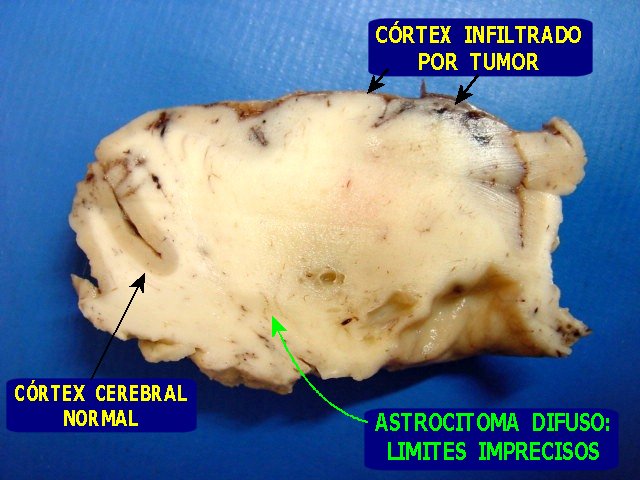
Macroscopia.
Os astrocitomas difusos em peças cirúrgicas apresentam-se
como massas de cor branco-amarelada. A consistência pode variar
de firme em áreas ricas em astrócitos fibrilares a amolecida
quando predominam astrócitos protoplasmáticos. Ao corte,
o aspecto é homogêneo, esbranquiçado a acinzentado,
podendo conter cistos de tamanho e quantidade variáveis.
..
 |
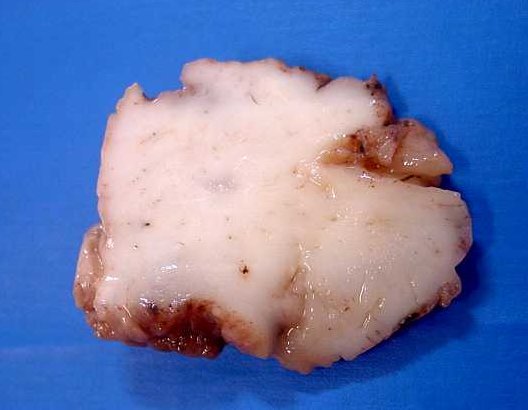 |
| F.
30 a. Astrocitoma difuso frontal, espécime cirúrgico, superfícies
externa (E) e de corte. Delimitação relativamente boa do
tumor permitiu ressecção em bloco. Ao corte, aspecto branco
e homogêneo. Para imagens de RM
desta paciente, aspecto histológico,
e imunohistoquímica, clique. |
..
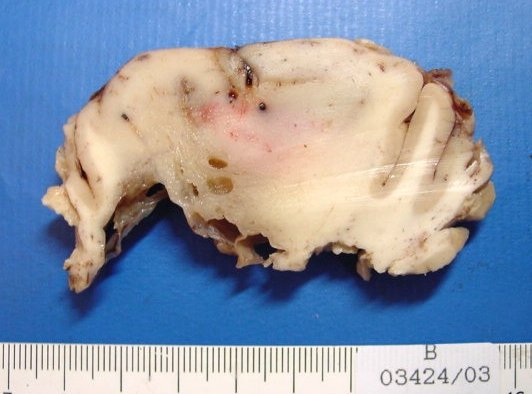
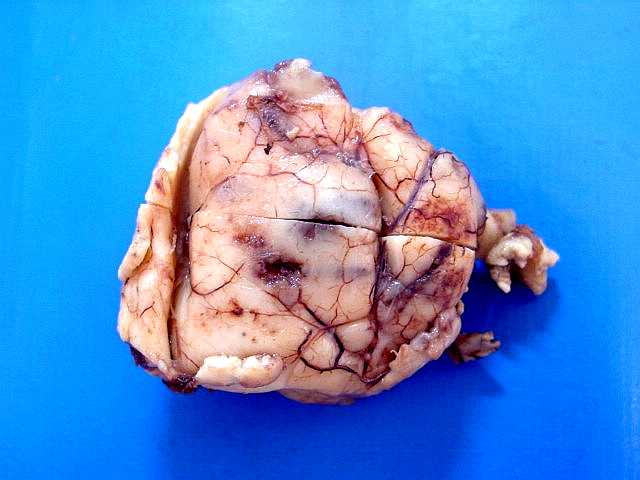 |
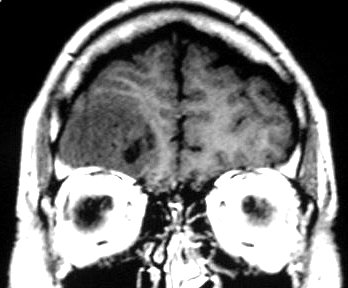 |
| M.
38 a. Oligoastrocitoma difuso de baixo grau. Os aspectos de imagem e macroscópicos
dos oligoastrocitomas são superponíveis aos dos astrocitomas
difusos 'puros'. À E, espécime cirúrgico visto
pela face meníngea, mostrando alargamento dos giros cerebrais
na área tumoral. À D, RM do mesmo paciente, corte coronal
em T1 sem contraste, mostrando lesão fronto-basal D hipointensa,
com aspecto sólido, homogêneo e áreas císticas. |
..
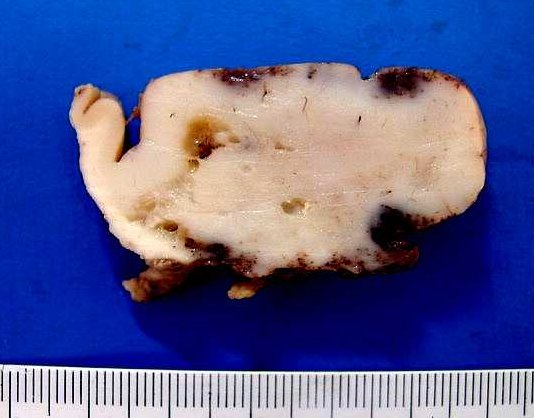 |
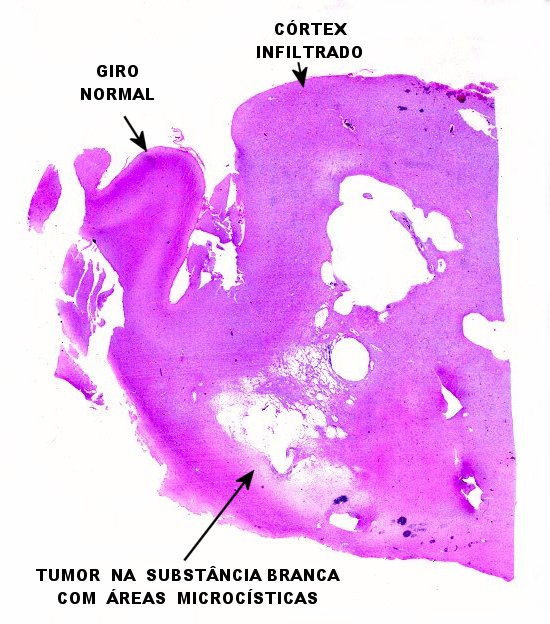 |
| Mesmo
caso, superfície de corte de um giro alargado, infiltrado extensamente
pelo tumor. Na maior parte, o aspecto é branco e homogêneo,
notando-se à E áreas císticas. Os focos hemorrágicos
na superfície meníngea devem-se a trauma cirúrgico.
O giro no extremo E da foto parece livre de neoplasia. Na foto à
D, lâmina corada por HE, escaneada para mostrar detalhes das mesmas
áreas. Para mais da histologia
e imunohistoquímica deste caso,
clique. |
..
 |
 |
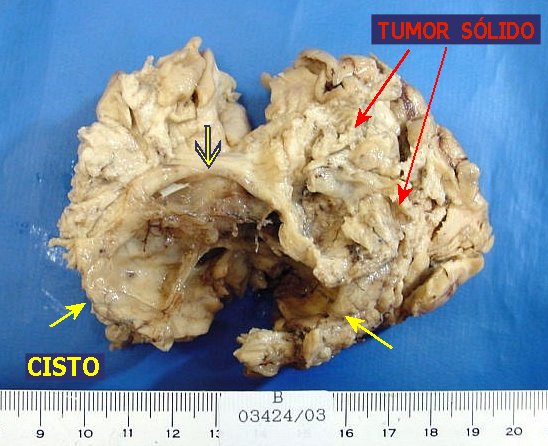 |
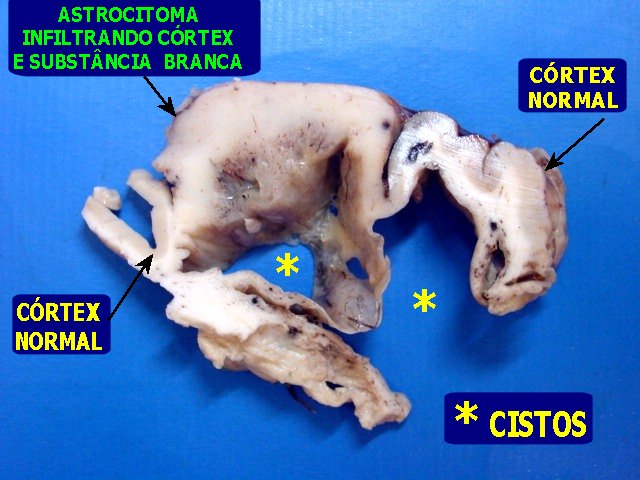 |
| M.
32 a. Astrocitoma difuso anaplásico. Nas fotos em cima, área
mais sólida do tumor, mostrando caráter infiltrativo com
limites imprecisos, borrando a transição córtico-subcortical.
Giros nos extremos do espécime macroscopicamente normais. Nas fotos
embaixo, à E, espécime inteiro visto pela superfície
cruenta, com cisto volumoso, que aparece em corte na fig. à D.
Para exames de imagem, aspecto
histológico, imunohistoquímica
e microscopia eletrônica deste
caso, clique. |
..
| Esfregaços.
São
um meio prático e corrente de estudo de espécimes cirúrgicos.
Um fragmento a fresco de cerca de 1 mm³ é esmagado entre duas
lâminas, sendo a lâmina de cima deslizada sobre a de baixo
com moderada pressão. O preparado é fixado rapidamente em
álcool absoluto e corado por HE, permitindo exame em cerca de 3
minutos. Em tecidos moles como os de astrocitomas, o método fornece
uma fina camada de células, permitindo boa visualização
de núcleos e citoplasma. Os vasos são esticados e podem ser
observados por longas distâncias. O procedimento é especialmente
útil para amostras muito escassas, que dificilmente produziriam
bons resultados em cortes de congelação. |
 |
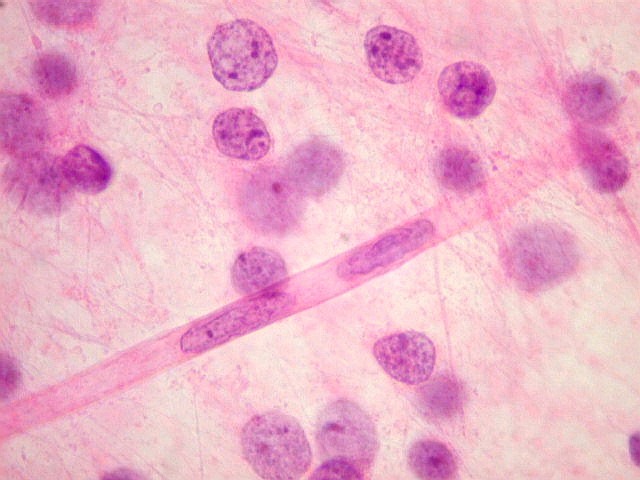 |
| M.
33 a. Astrocitoma difuso de baixo grau frontal E. Esfregaço corado
por HE mostra núcleos com leve variação de diâmetro
e cromatina bem distribuída (atipias discretas). Entre eles, finos
prolongamentos celulares formam uma trama fibrilar de fundo, característica
dos gliomas. Capilares semelhantes aos do tecido normal são
facilmente observáveis. Notar núcleos das células
endoteliais ovalados e distribuídos espaçadamente ao longo
do capilar. |
..
Microscopia em
cortes histológicos corados por HE.
Os astrocitomas difusos têm morfologia relativamente regular, por
vezes monótona, em extensas áreas. São
constituídos por astrócitos que lembram as formas fibrilares
e protoplasmáticas normais do tecido nervoso. Por vezes têm
citoplasma mais abundante e contorno arredondado do corpo celular, recordando
os astrócitos gemistocíticos, formas reativas e inespecíficas
encontradas em resposta a vários tipos de lesão.
Os vários padrões histológicos podem estar mesclados
no mesmo espécime, com predomínio de um deles.
Nos astrocitomas
difusos de baixo grau (OMS grau II) observam-se atipias nucleares que podem
ir de leves a intensas (variação de diâmetro e cromatismo
nuclear), mas os núcleos são geralmente arredondados, com
cromatina bem distribuída. Não se observam figuras
de mitose, proliferação das células endoteliais dos
capilares, nem áreas de necrose, que são critérios
de anaplasia na classificação da OMS.
..
| Padrão fibrilar.
Os
astrócitos neoplásicos têm abundantes prolongamentos
finos que se distribuem em todas as direções, formando um
fundo ricamente fibrilar. |
 |
..
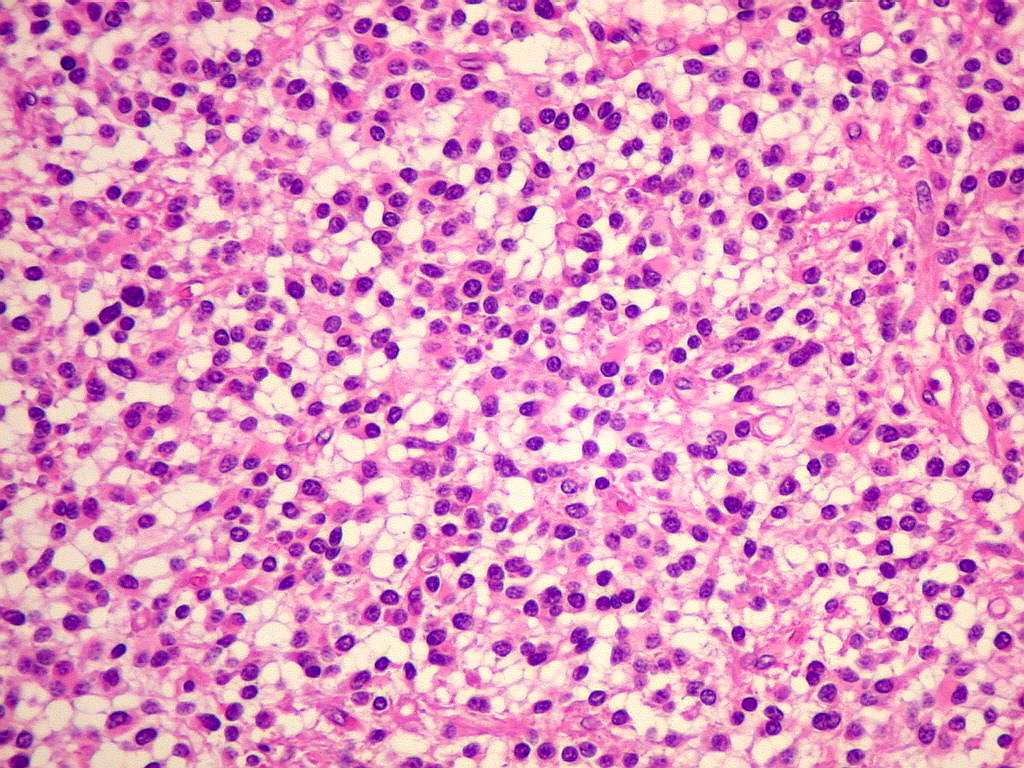
| Padrão
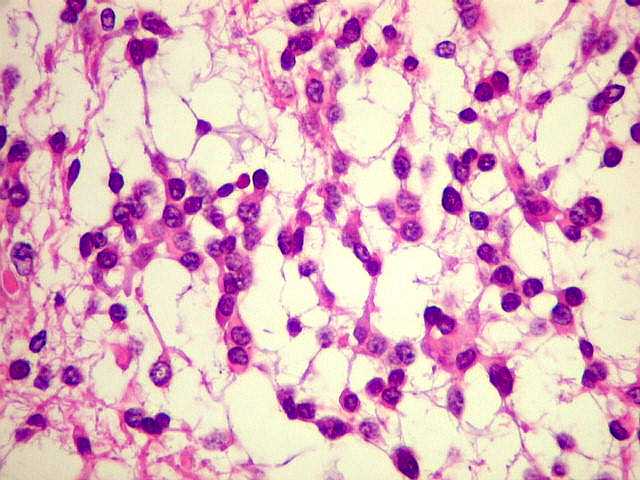
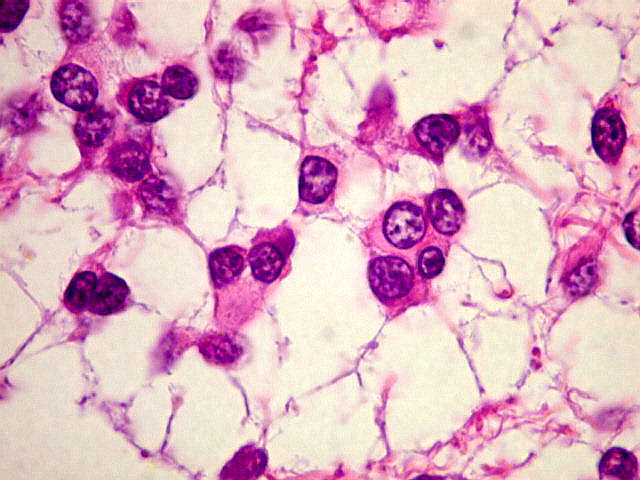
protoplasmático. A
celularidade é maior (mais células por unidade de área),
mas os prolongamentos celulares são curtos e escassos. |
 |
..
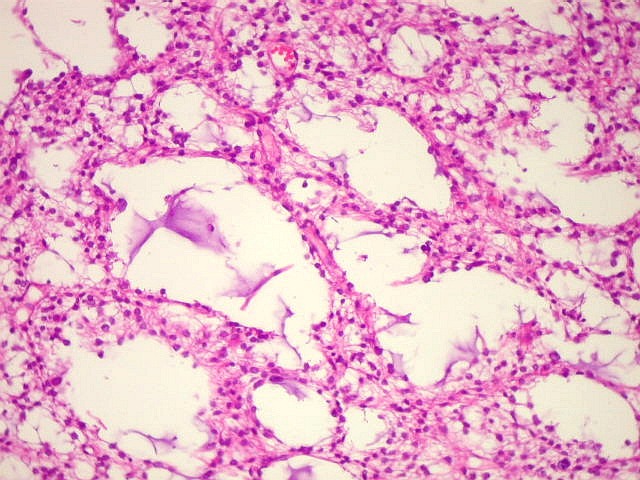
| Padrão
microcístico. Uma
variedade do padrão protoplasmático, em que pequenos lagos
de material amorfo, hidratado e de aspecto mucóide são encontrados
entre os astrócitos. Os cistos podem confluir e tornar-se
macroscopicamente visíveis. |
 |
..
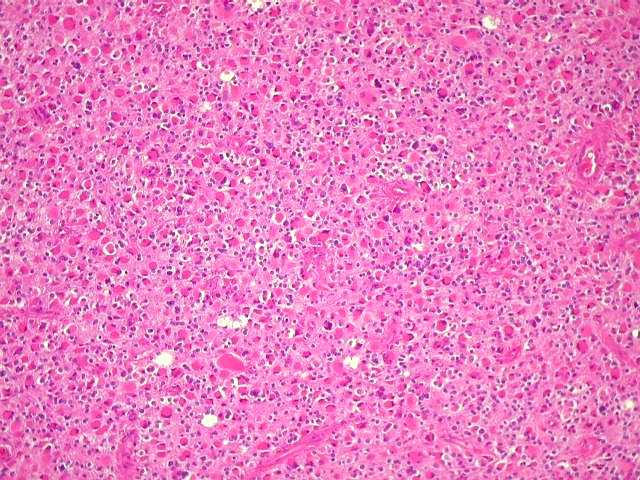
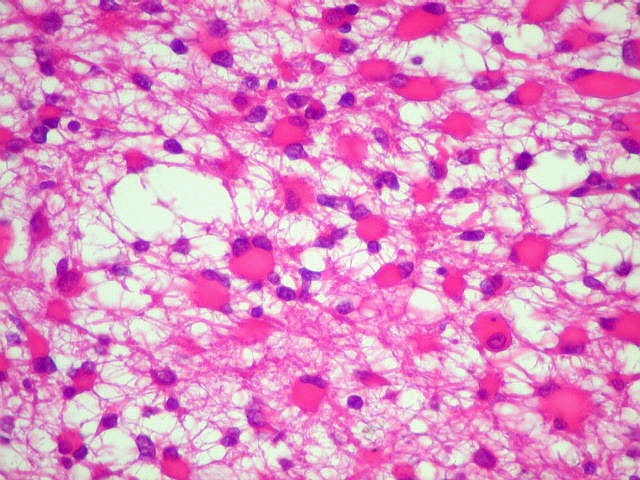
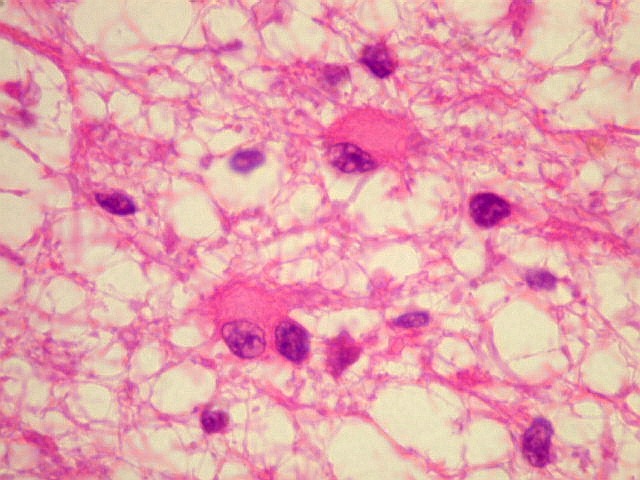
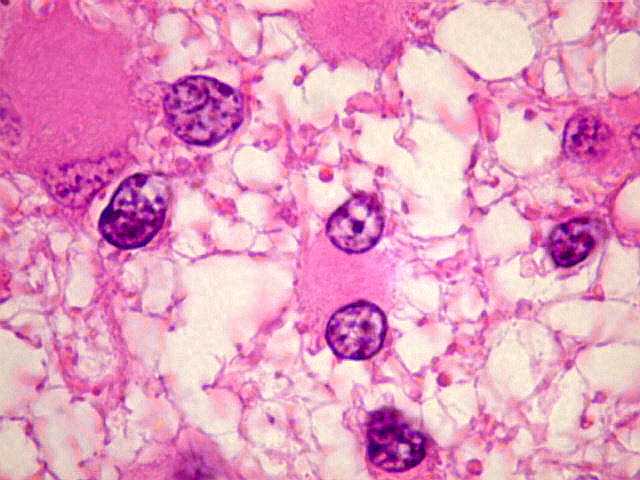
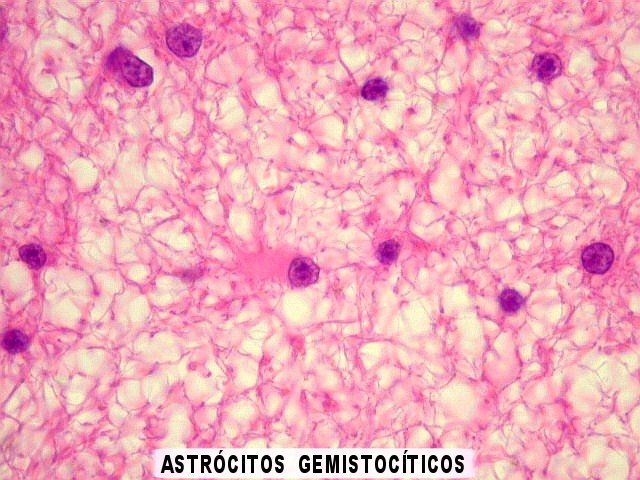
| Padrão
gemistocítico. Uma
alta proporção das células tumorais assume o aspecto
gemistocítico, com citoplasma róseo e abundante e núcleo
excêntrico. Uma quantidade expressiva de astrócitos gemistocíticos
no tumor está associada a pior prognóstico, mas o grau histológico
segundo a OMS não se altera (ver abaixo). |
 |
..
Mais exemplos.
..
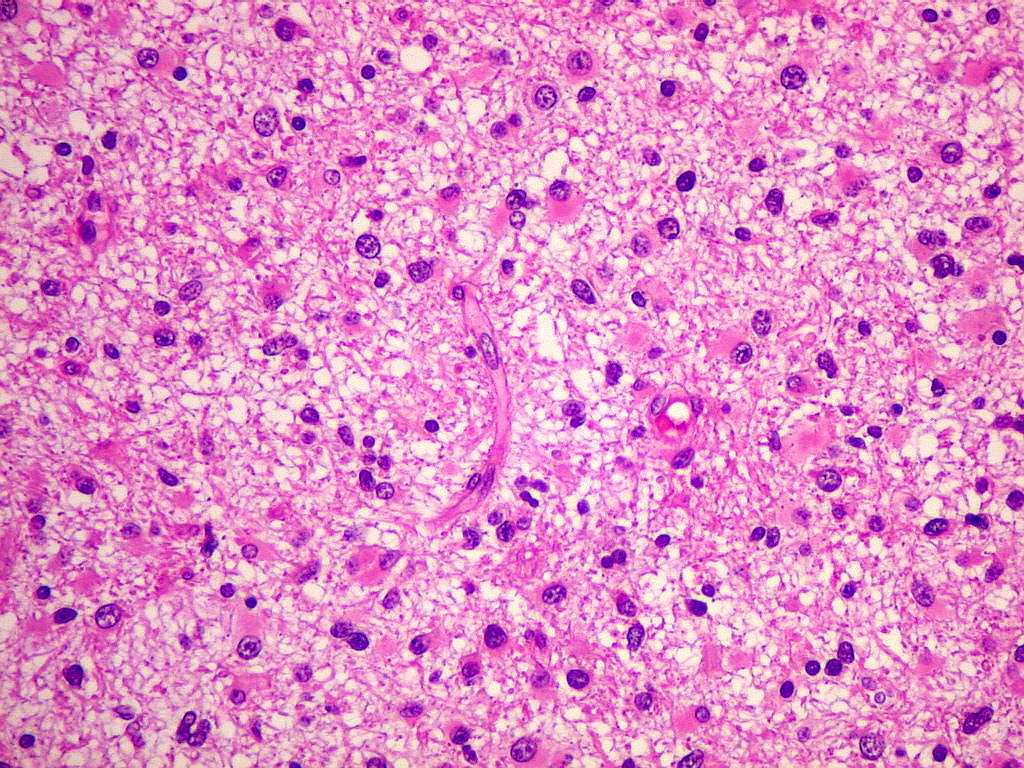
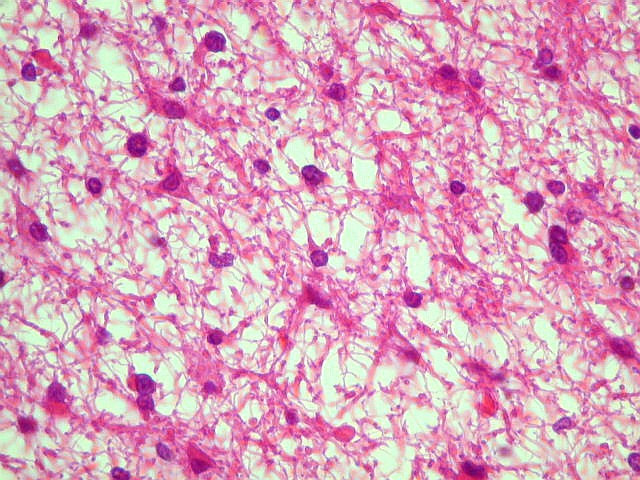
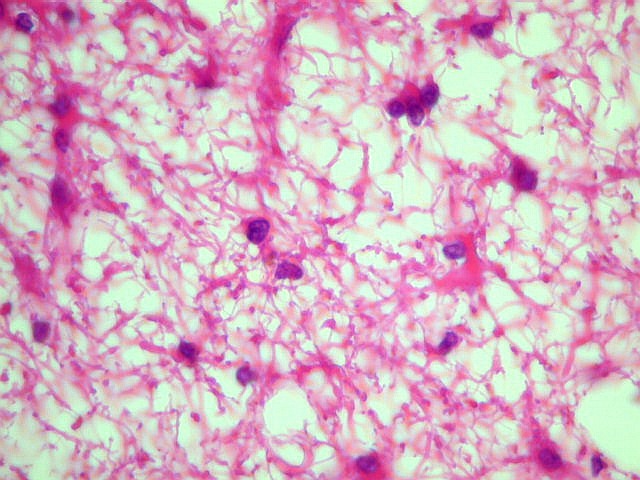
| Astrocitoma
difuso, padrão histológico fibrilar |
 |
 |
 |
 |
..
| Astrocitoma
difuso, padrão histológico protoplasmático |
 |
 |
..
| Astrocitoma
difuso, padrão histológico protoplasmático, áreas
microcísticas |
 |
 |
..
| Astrocitoma
difuso, padrão histológico gemistocítico, ou áreas
com astrócitos gemistocíticos. |
 |
 |
 |
 |
..
Graduação.
Os astrocitomas difusos na classificação
da OMS atualmente em uso são subdivididos em astrocitoma difuso
de baixo grau (grau II), astrocitoma anaplásico ou maligno (grau
III) e glioblastoma multiforme (grau IV).
A classificação
baseia-se no encontro de quatro características histológicas,
ou critérios: atipias nucleares, mitoses, proliferação
vascular e necrose. Estes dois últimos valem como um só,
pois é a proliferação vascular que leva à necrose.
Na prática, não se reconhecem astrocitomas difusos grau I,
em que nenhum destes critérios estaria presente.
Os astrocitomas
difusos de grau mais baixo (II) apresentam apenas um critério, que
é atipias nucleares (praticamente sempre). São conhecidos
como astrocitomas difusos de baixo grau.
Os tumores
grau III apresentam dois dos quatro critérios: atipias nucleares
(presentes em todos os astrocitomas difusos) + mitoses; ou atipias
nucleares + proliferação vascular e/ou necrose. São
referidos como astrocitomas anaplásicos.
Nos tumores
grau IV, também denominados glioblastoma multiforme, são
encontrados três ou quatro critérios, sendo indispensável
haver mitoses. Pode haver só proliferação vascular
ou só necrose ou ambas.
Este sistema
de graduação é reprodutível e ajuda predizer
em linhas gerais a sobrevida: astrocitomas difusos de baixo grau OMS II:
> 5 anos; astrocitomas anaplásicos OMS III: 2 a 5 anos; glioblastomas,
OMS IV: < 1 ano. Mas é importante salientar que estes dados
têm valor apenas estatístico ou probabilístico, e variam
de paciente para paciente. Outros fatores como quantidade de tumor residual
e terapias adjuvantes (radio- e quimioterapia) certamente também
influem na sobrevida.
..
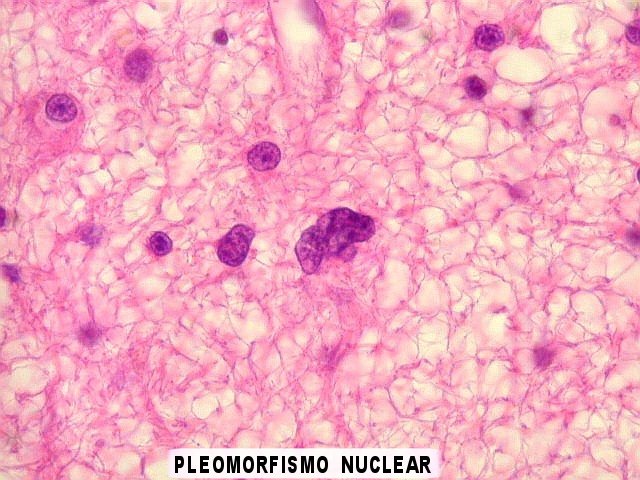
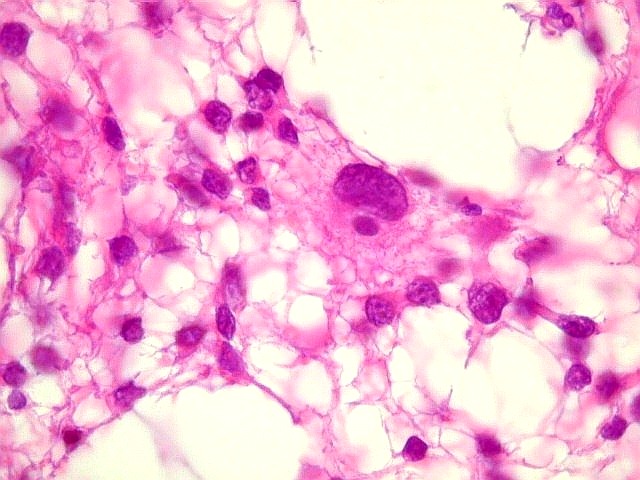
| Atipias nucleares
ou discariose - variação
da forma tamanho e cromatismo nucleares. Considera-se que, na prática,
todos astrocitomas difusos apresentam esta feição, que pode
variar de leve a intensa. Abaixo, exemplos tirados de dois casos.
Links nas figuras. |
 |
 |
 |
 |
..
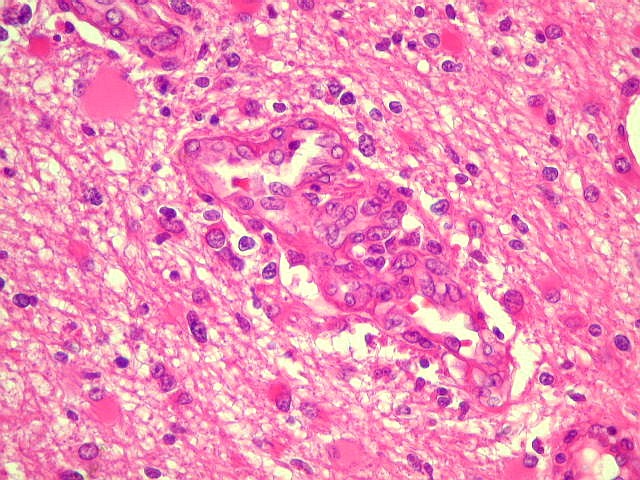
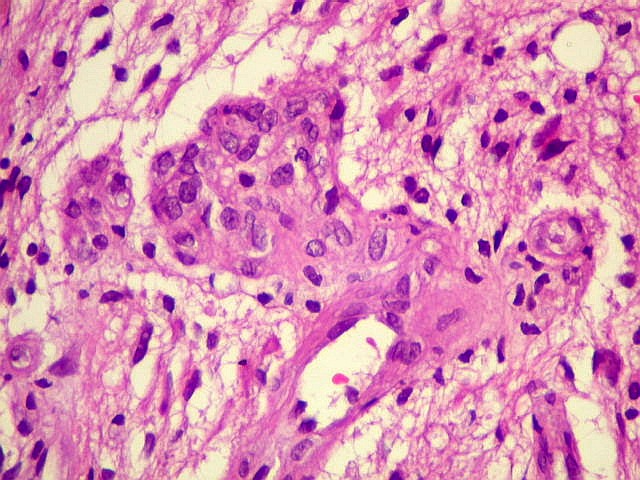
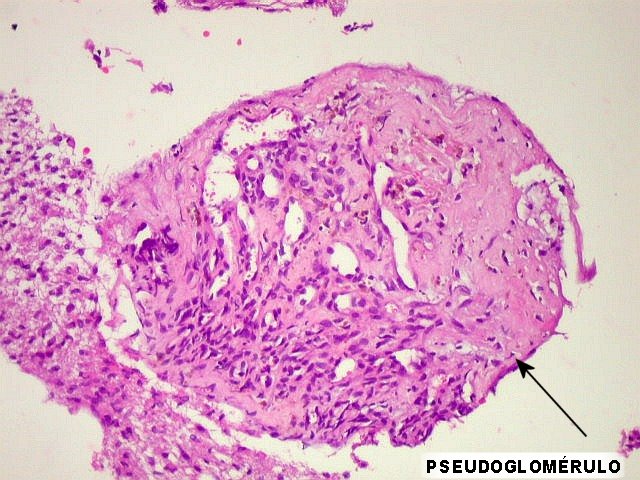
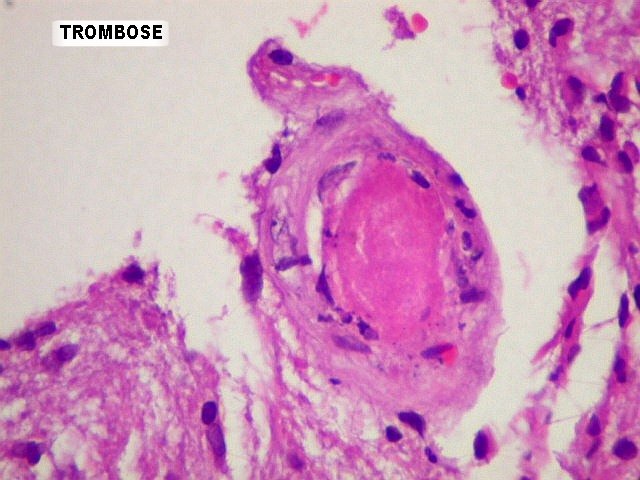
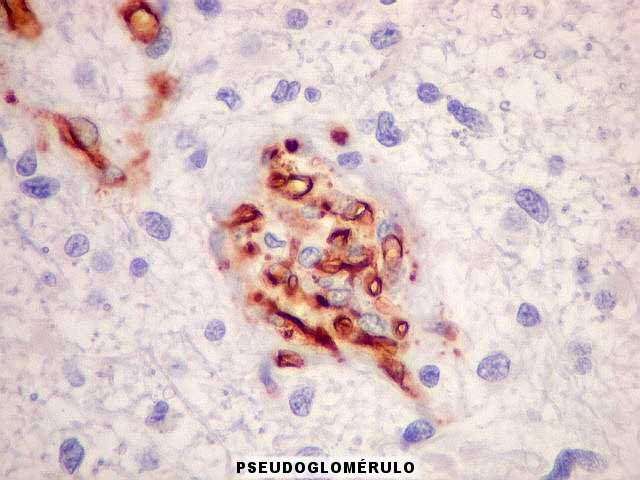
| Proliferação
endotelial, pseudoglomérulos, trombose.
A hiperplasia das células endoteliais dos capilares resulta da secreção
de fator de crescimento do endotélio vascular (VEGF ou vascular
endothelial growth factor) pelas células neoplásicas.
Os núcleos ficam tumefeitos, o citoplasma mais espesso, e há
tendência a empilhamento das células endoteliais. Há
redução da luz do capilar. A proliferação leva
a enovelamento dos capilares, lembrando glomérulos renais (pseudoglomérulos).
Estes capilares anômalos favorecem a trombose, que pode ser também
precedida de necrose das próprias células endoteliais. |
 |
 |
 |
 |
 |
 |
Provável
seqüência de eventos:
1. Astrocitomas
anaplásicos contêm células em rápida proliferação
com alta demanda metabólica.
2. Áreas
de necrose podem aparecer onde a demanda de oxigênio exceda o suprimento
(portanto, anóxia).
3. A hipóxia
aumenta a expressão de fatores angiogênicos, particularmente
VEGF, pelas células neoplásicas, e de receptores para estes
nas células endoteliais dos capilares, criando uma alça parácrina
de estimulação.
4. Os vasos
proliferados sofrem facilmente trombose, dando mais hipóxia, e estabelecendo
o ciclo vicioso. |
..
| A
impregnação por contraste deve-se
à perda da função de barreira hemoencefálica
dos capilares, que é uma propriedade das células endoteliais
normais. Esta propriedade é induzida pelos prolongamentos dos astrócitos.
Nos astrocitomas
difusos de baixo grau, esta função é mantida porque
os astrócitos são bem diferenciados e capazes de formar a
barreira. |
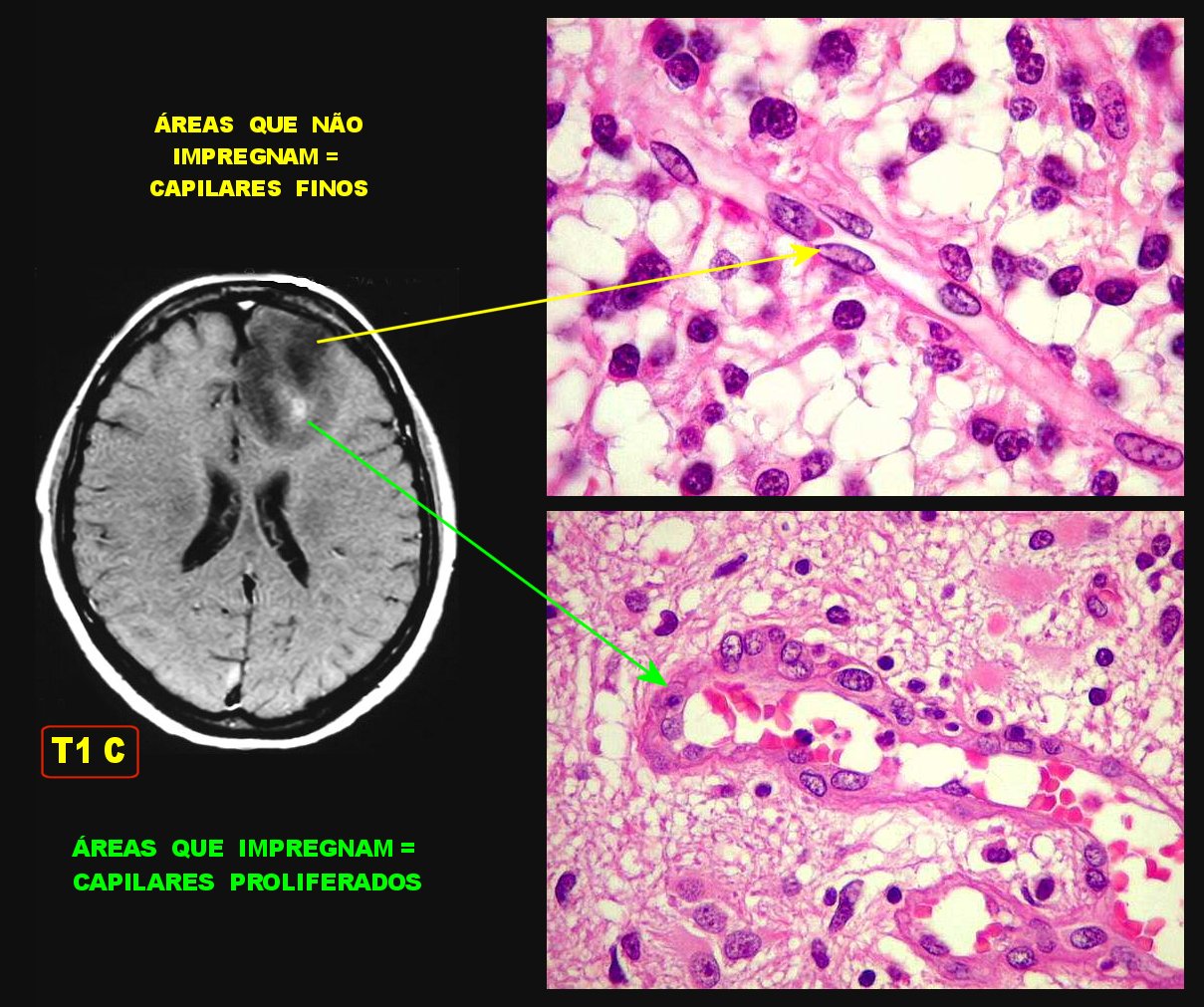 |
| Nos
astrocitomas
difusos de alto grau, os astrócitos neoplásicos secretam
fatores proteicos que induzem a proliferação das células
endoteliais. Estas se tornam numerosas, anômalas, e perdem a função
de barreira. Moléculas grandes, como o contraste paramagnético
(gadolínio), passam para o interstício do tumor naquele local
e aparecem como aumento de sinal (áreas brilhantes) em T1, o que
sinaliza anaplasia. |
..
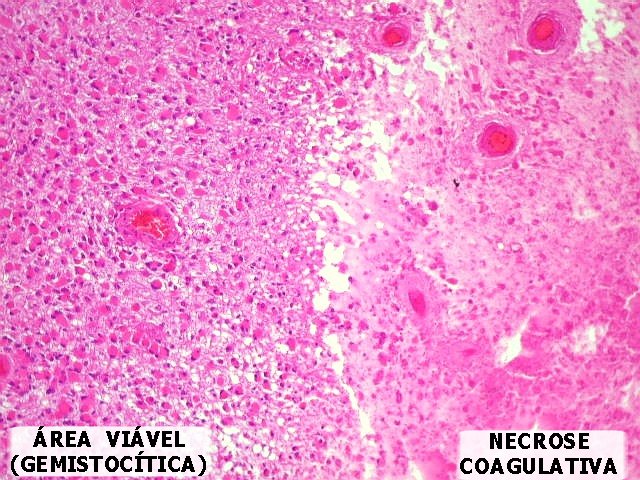
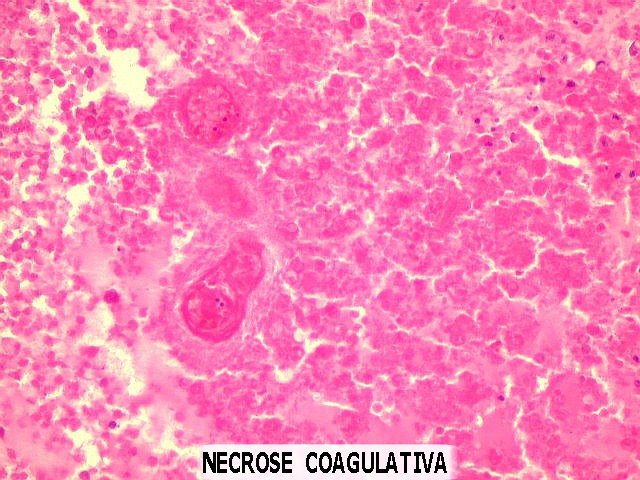
| Necrose coagulativa.
É conseqüência das alterações vasculares
vistas acima. Com a obstrução dos capilares pela proliferação
endotelial e pela trombose, há isquemia do tecido, resultando em
necrose. Ao contrário dos infartos anêmicos (1)
(2), onde a necrose é geralmente liqüefativa,
nos astrocitomas anaplásicos e glioblastomas a necrose é
coagulativa, porque a obstrução da circulação
é completa, impedindo a chegada das células fagocitárias. |
 |
 |
..
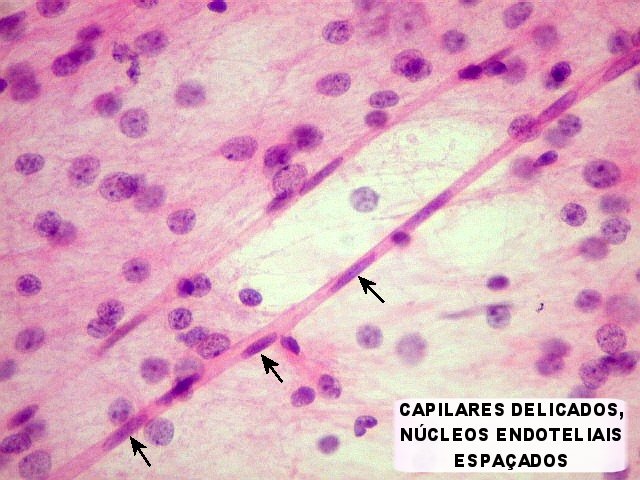
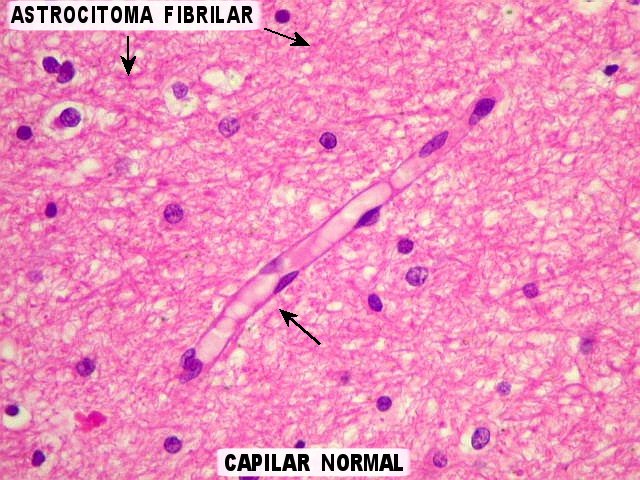
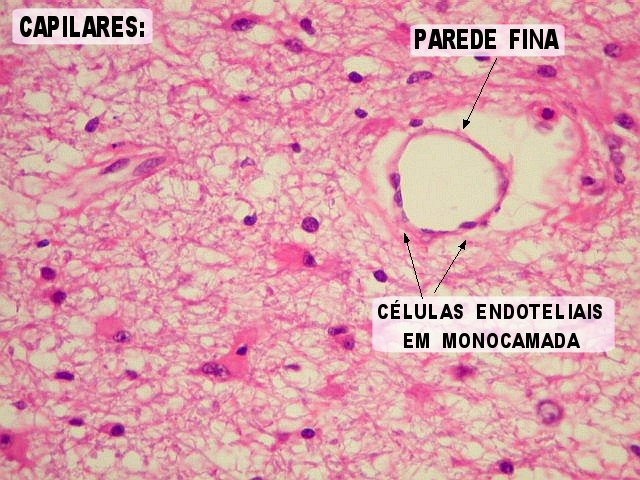
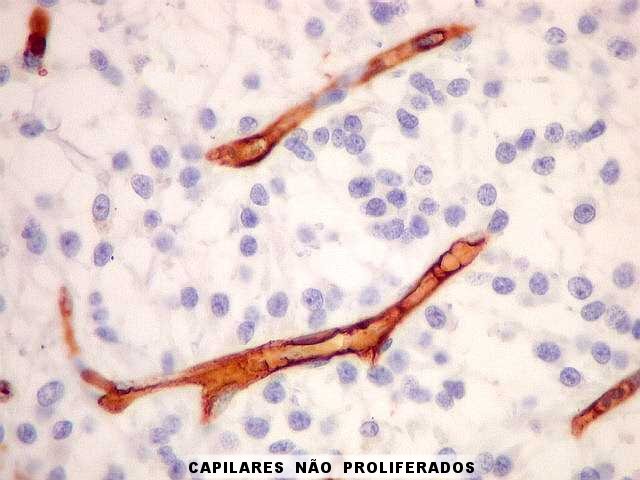
| Capilares
sem proliferação endotelial,
para comparar. Nos astrocitomas difusos de baixo grau, capilares
habitualmente assemelham-se aos do tecido nervoso normal. Têm
células endoteliais em monocamada, com citoplasma fino e núcleos
espaçados ao longo do maior eixo do vaso. |
 |
 |
 |
 |
..
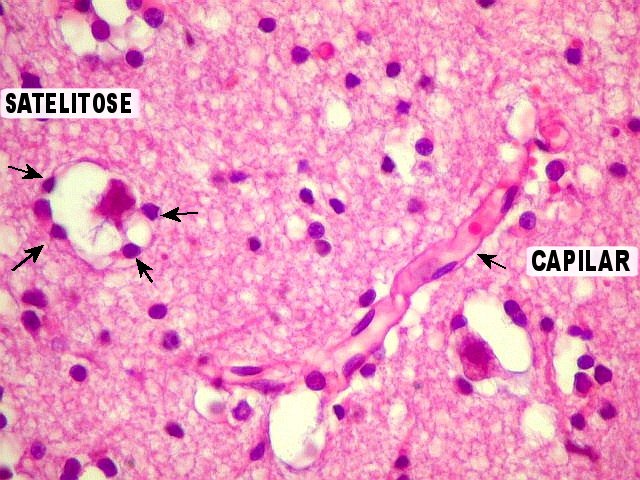
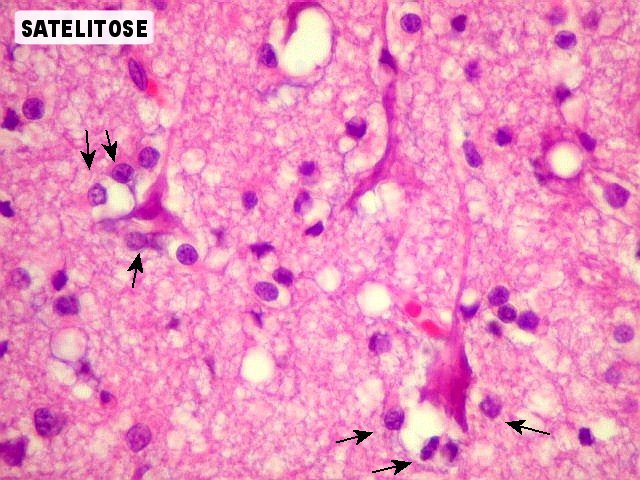
| Caráter
infiltrativo, infiltração do córtex cerebral, satelitose.
Os astrocitomas difusos têm forte tendência a infiltrar o tecido
nervoso normal. Na substância cinzenta, como no córtex cerebral,
as células neoplásicas agrupam-se ao redor dos corpos celulares
dos neurônios (portanto, na interface entre neurônios e neurópilo),
um fenômeno conhecido como satelitose, que pode auxiliar no
diagnóstico de glioma em espécimes pequenos. |
 |
 |
..
IMUNOHISTOQUÍMICA.
Os astrocitomas difusos são habitualmente positivos para GFAP (proteína
glial ácida fibrilar), um filamento intermediário característico
de astrócitos, e também para vimentina (VIM). VIM é
um filamento intermediário ubiquitário, presente em células
de várias linhagens, e portanto inespecífico para astrócitos.
Mas sempre utilizamos VIM porque dá excelentes preparados para estudar
a morfologia das células. Tanto GFAP como VIM estão
positivos no citoplasma.
..
..
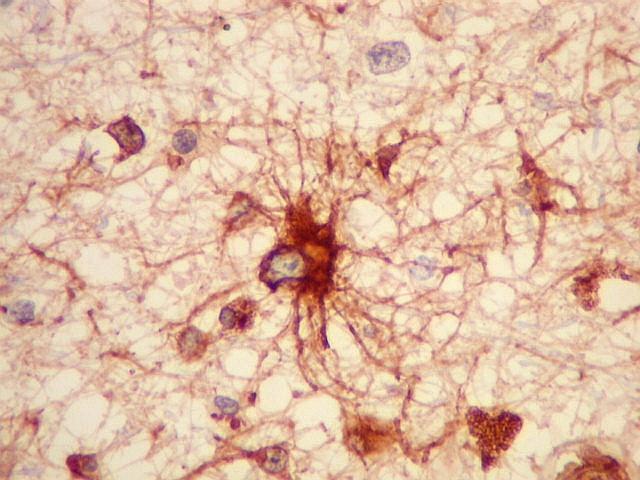
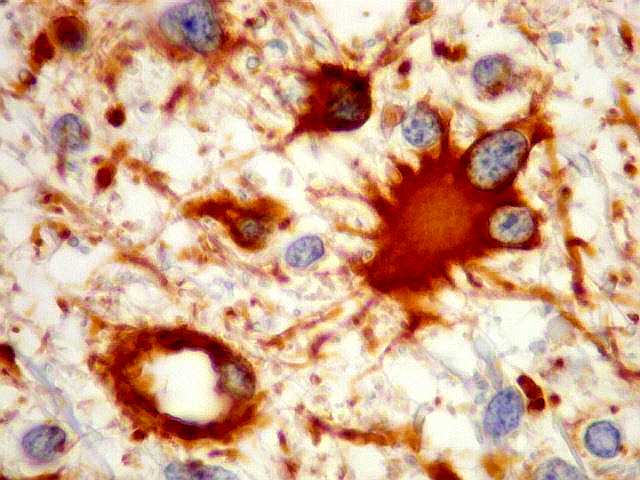
| VIM.
Marcação citoplasmática dos astrócitos e seus
prolongamentos, análoga à com GFAP. Marcação
também de vasos. |
 |
 |
..
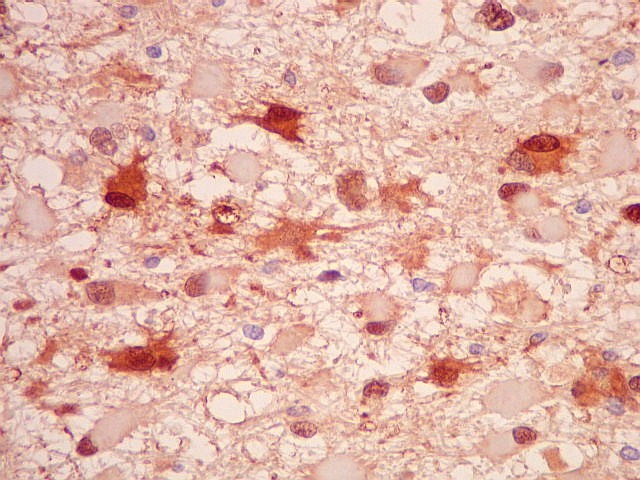
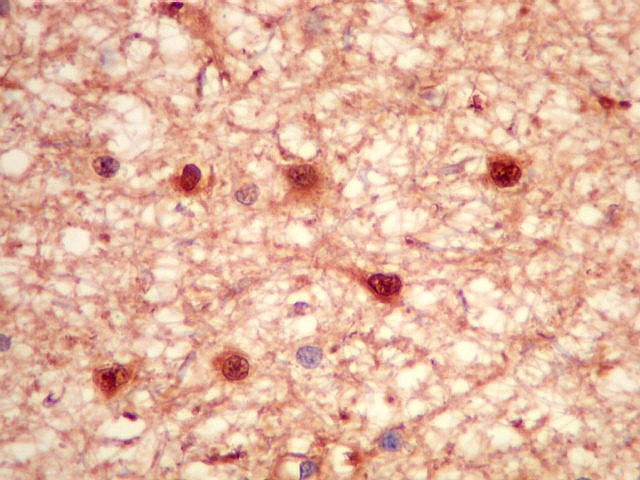
| S-100.
Proteína S-100, presente em células de linhagem neuroectodérmica,
marca também os astrócitos neoplásicos, podendo a
marcação ser citoplasmática e/ou nuclear. |
 |
 |
..
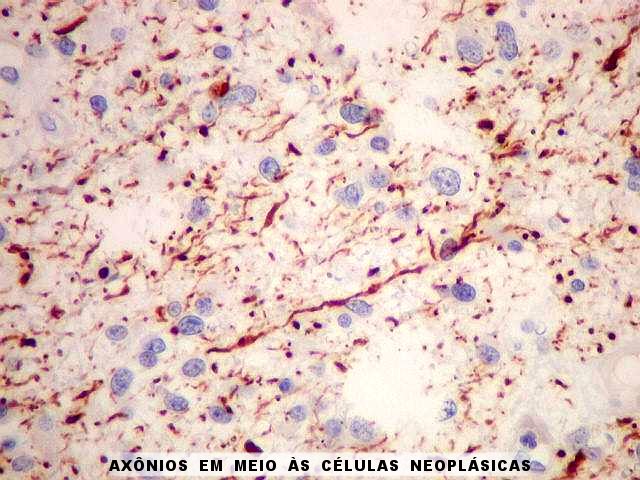
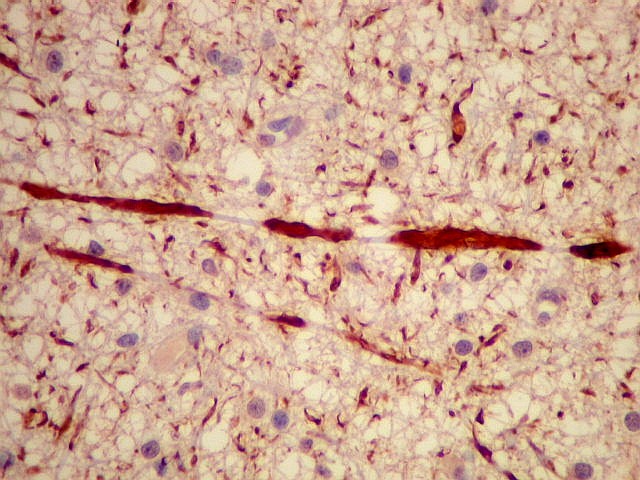
| NF. Proteína
de neurofilamento demonstra axônios no tumor. O tumor infiltra
difusamente a substância branca, divulsionando as fibras nervosas.
Como os astrocitomas difusos são mal delimitados e permeantes, sua
excisão curativa é difícil. |
 |
 |
..
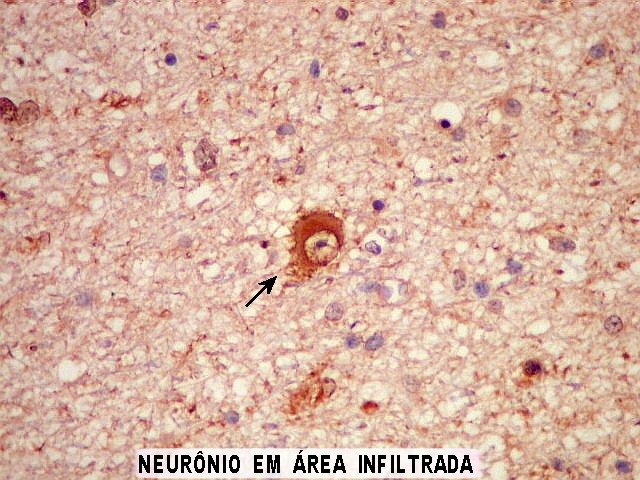
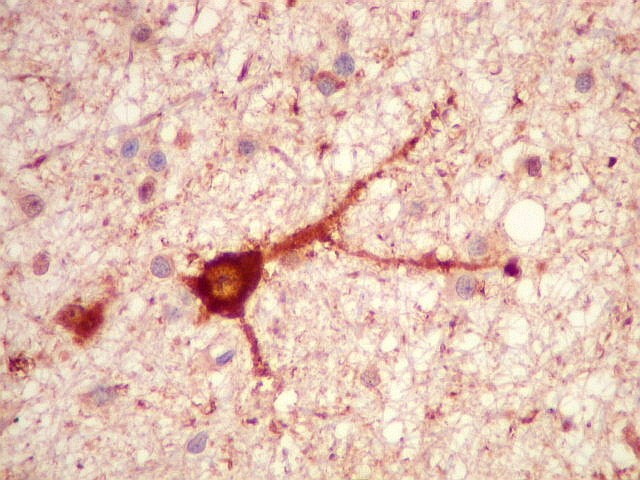
| NSE.
Enolase neurônio-específica é útil para demonstrar
neurônios do tecido nervoso infiltrado, em meio aos astrócitos
neoplásicos, que são negativos. |
 |
 |
..
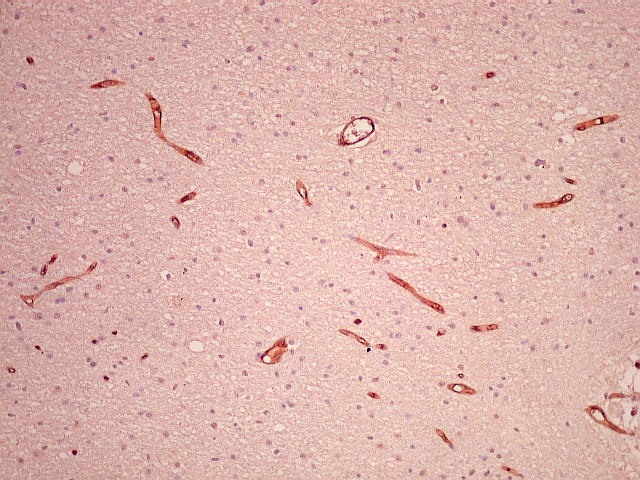
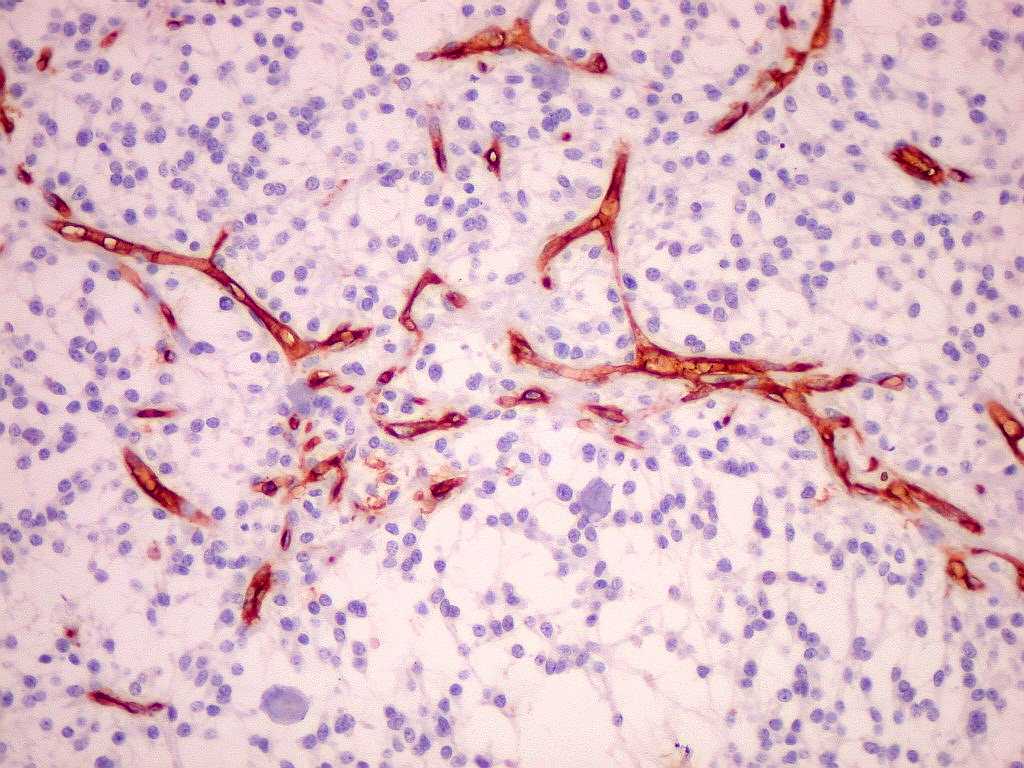
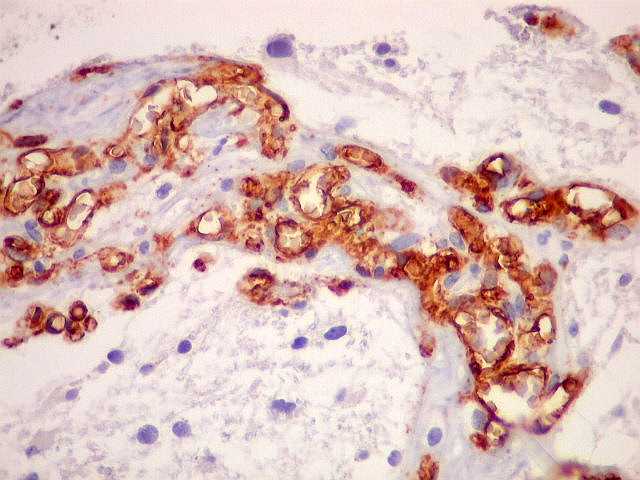
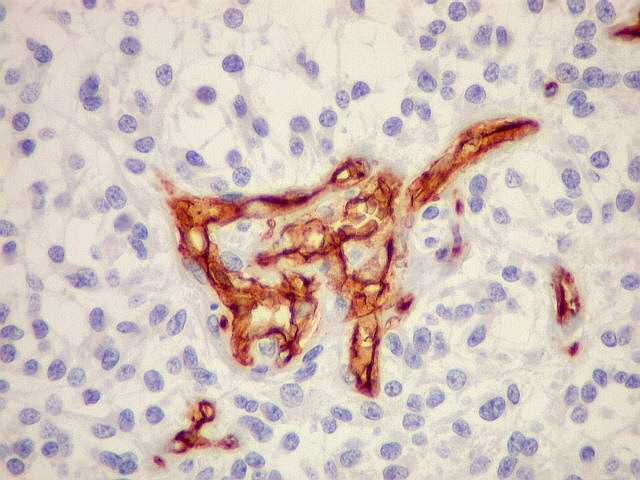
| CD34.
Positivo em células endoteliais, é útil para ressaltar
a rede vascular do tumor. Os vasos são finos, delicados e regularmente
espaçados. |
 |
 |
 |
 |
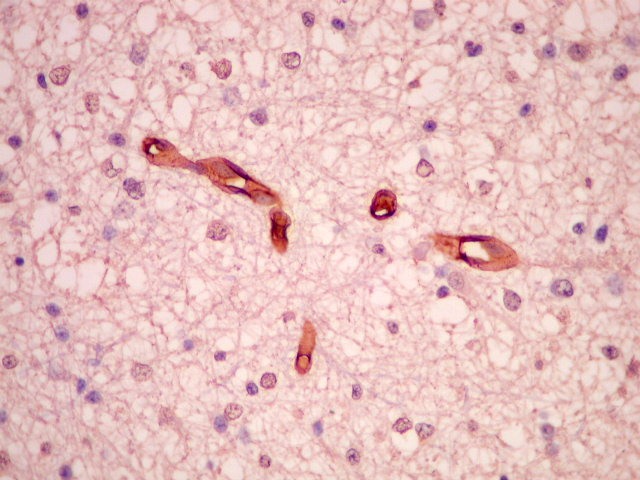
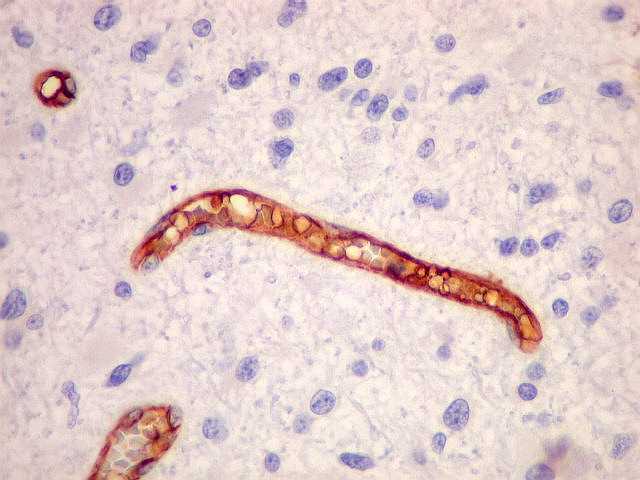
| Proliferação
endotelial, uma feição própria de anaplasia
e um dos critérios de malignidade da classificação
da OMS, é bem demonstrada por CD34. |
 |
 |
 |
 |
..
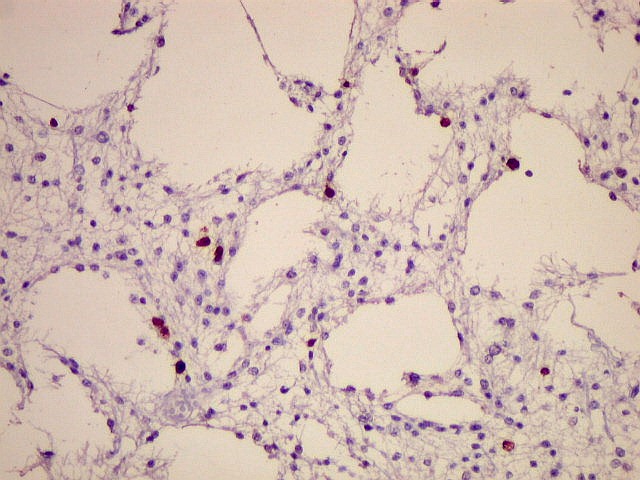
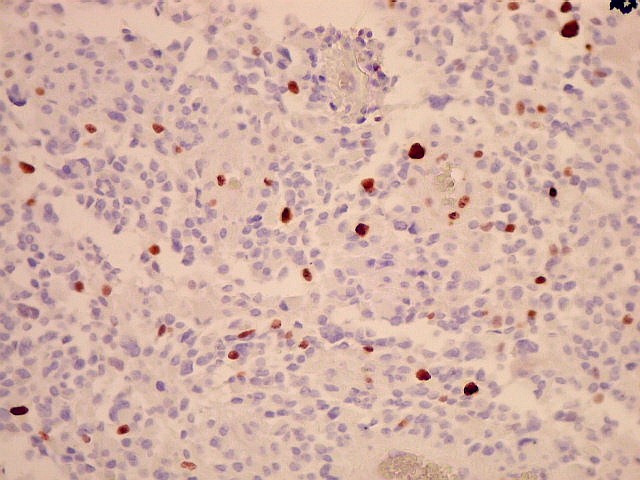
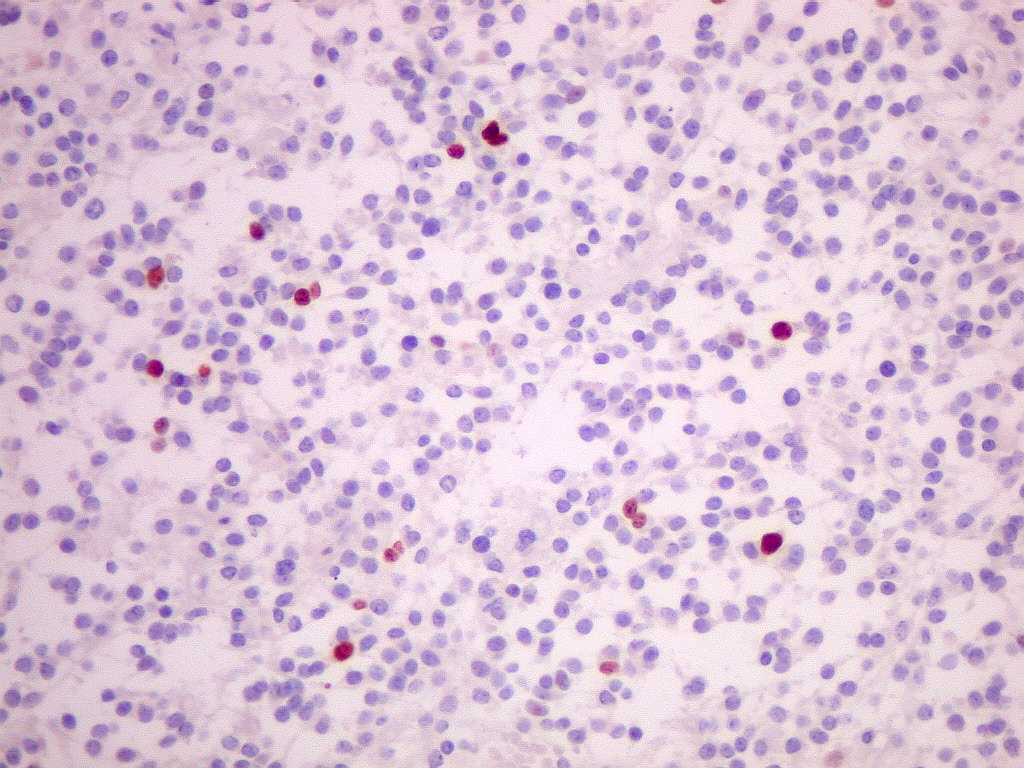
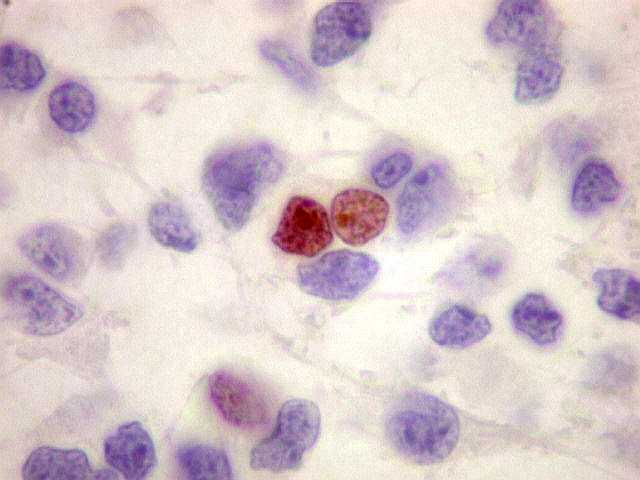
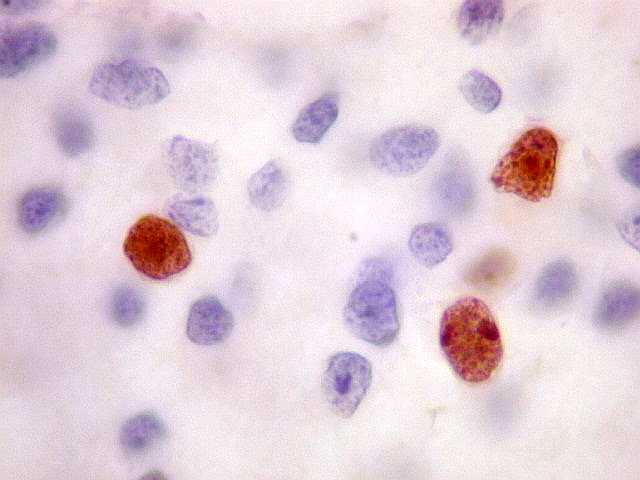
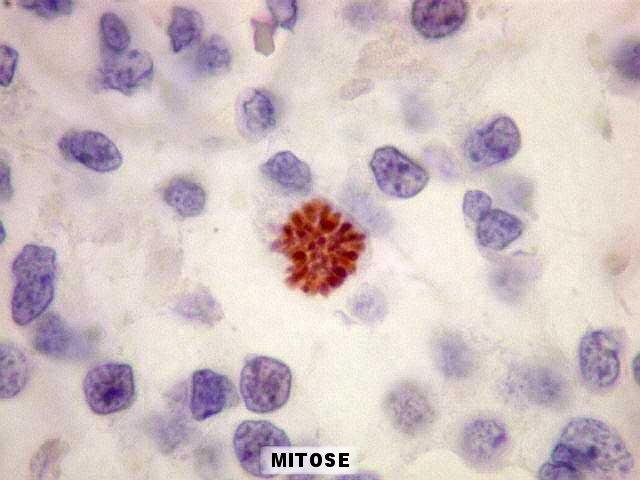
| Ki-67. O
marcador de proliferação celular Ki-67 é usado para
dar uma idéia da rapidez de proliferação das células
neoplásicas. Ki-67 marca os núcleos de células
que se encontram no ciclo celular, isto é, que vão dividir-se
no futuro próximo. A proporção de núcleos
marcados varia de forma inversamente proporcional ao grau de diferenciação
do tumor. Em tumores de baixo grau (grau II) há poucos núcleos
marcados (da ordem de 1%). Em tumores anaplásicos (grau III)
esta proporção é maior, sendo máxima no glioblastoma
multiforme (grau IV). |
 |
 |
 |
 |
 |
 |
..
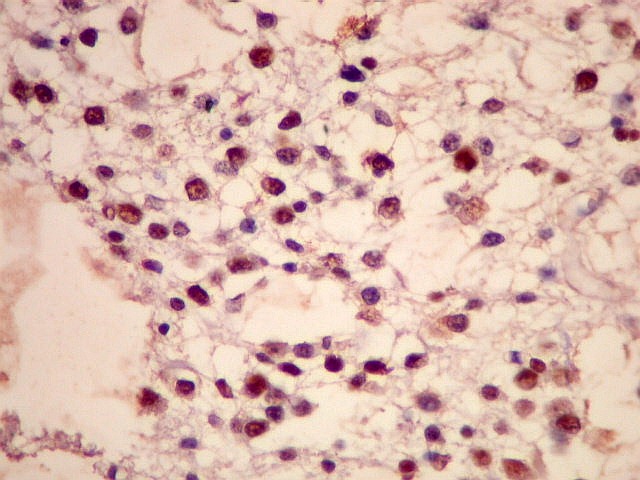
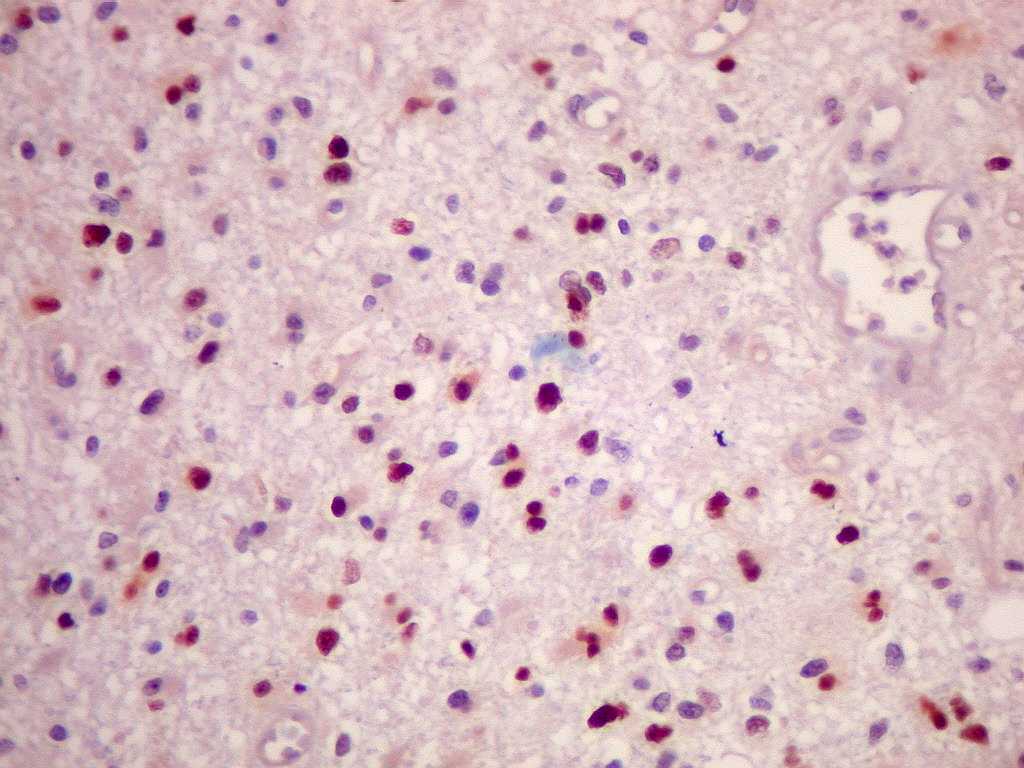
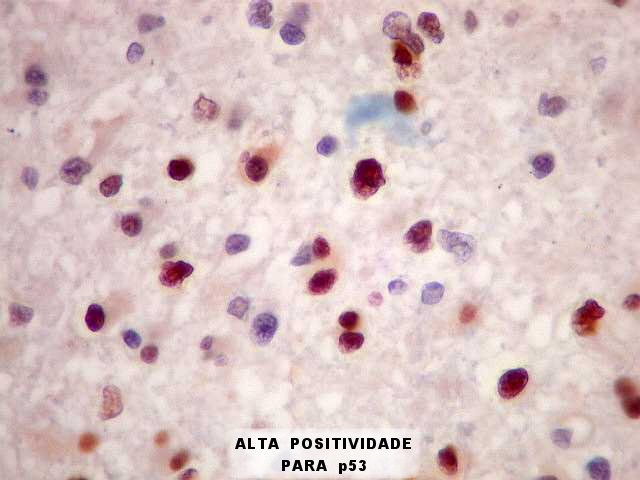
| p53.
A positividade de alta proporção dos núcleos tumorais
(atingindo 50% ou mais) sugere importante papel da mutação
do gene p53 (o 'guardião do genoma') na gênese dos astrocitomas
difusos. Segundo a literatura, astrocitomas difusos de baixo
grau progridem à anaplasia mediante mutações neste
gene. O p53, em sua forma normal, inibe a divisão celular
caso haja anormalidades genômicas que favoreçam proliferação
celular desordenada. |
 |
 |
 |
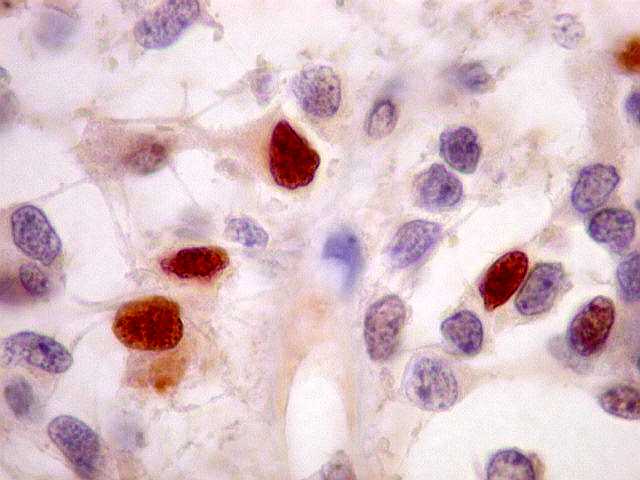 |
| A
proteína p53 normal é continuamente sintetizada e degradada.
No caso de haver mutações, a proteína mutante não
é degradada e acumula-se no núcleo, sendo então demonstrada
na reação imunohistoquímica. |
Microscopia eletrônica.
Os
astrócitos neoplásicos demonstram na ultraestrutura feições
já observadas na microscopia óptica.
O núcleo
tem cromatina frouxa e bem distribuída, com adensamento abaixo da
membrana nuclear. Um ou dois pequenos nucléolos podem estar presentes.
Podem-se observar dobras da membrana nuclear.
A quantidade
de citoplasma é variável, máxima nos astrócitos
gemistocíticos, e contém abundantes filamentos intermediários
participantes do citoesqueleto, que a imunohistoquímica mostra serem
constituídos principalmente por GFAP e vimentina. Organelas
como mitocôndrias, ribossomos livres ou organizados no retículo
endoplasmático rugoso, e cisternas do retículo endoplasmático
liso são também demonstráveis.
No interstício
encontram-se prolongamentos das células neoplásicas, ricos
em filamentos intermediários, e números variáveis
de axônios mielínicos e/ou de corpos celulares de neurônios,
já que o tumor infiltra entre elementos normais pré-existentes.
Principais fontes:
-
Burger PC,
Scheithauer BW, Vogel FS. Surgical Pathology of the Nervous System
and Its Coverings. 4th Ed. Churchill Livingstone, New York, 2002.
pp. 161-180.
-
Cavenee WK
et al. Diffusely infiltrating astrocytomas. in Kleihues P
& Cavenee WK (eds). Tumours of the Nervous System. Pathology and Genetics.
WHO Classification of Tumours. IARC Press, Lyon, 2000. p. 10-21.
-
Kleihues P
et al. Diffuse astrocytoma. in Kleihues P & Cavenee
WK (eds). Tumours of the Nervous System. Pathology and Genetics. WHO Classification
of Tumours. IARC Press, Lyon, 2000. p. 22-26.
-
Kleihues P
et al. Anaplastic astrocytoma. in Kleihues P & Cavenee
WK (eds). Tumours of the Nervous System. Pathology and Genetics. WHO Classification
of Tumours. IARC Press, Lyon, 2000. p. 27-28.
|