| Os tumores
do parênquima da pineal
formam um contínuo desde os pineocitomas considerados benignos ou
grau I da OMS, até os pineoblastomas que são altamente agressivos
(grau IV). Entre eles estão os tumores de diferenciação
intermediária (graus II ou III).
Historicamente,
o termo ‘pinealoma’ foi cunhado por Krabbe em 1923 e abrangia vários
tipos de tumores na topografia da pineal, incluindo os germinomas. Em 1947,
Dorothy Russell e Nathan Friedman separaram os germinomas dos tumores do
parênquima da pineal propriamente dito.
Incidência.
Tumores da região pineal são coletivamente raros (< 1%
dos tumores do sistema nervoso central nos países ocidentais).
A distribuição por tipos é cerca de 35% para tumores
germinativos, 28% para tumores do parênquima pineal, e 28% para
gliomas, incluindo ependimomas. Na Ásia, a incidência
dos tumores da região pineal é maior, chegando a cerca de
3,2% no Japão. Naquela parte do mundo, tumores germinativos
respondem por 80% do total, sendo a metade constituída por germinomas.
Os tumores do parênquima pineal correspondem a 12% e gliomas a 6,5%.
Idade.
Adultos tendem a apresentar tumores benignos (pineocitomas, idades entre
36 e 47 anos). Crianças são afetadas pelas variedades mais
agressivas. Pineoblastomas têm idades médias entre 12 e 18
anos.
Clínica.
O quadro inicial mais comum é síndrome de hipertensão
intracraniana por obstrução do aqueduto. Embaçamento
visual pode decorrer do edema de papila. Compressão dos colículos
superiores pode manifestar-se como paralisia do olhar conjugado para cima
(síndrome de Parinaud). Pode haver ptose palpebral ou diplopia,
por lesão do núcleo do oculomotor, e nistagmo por compressão
do fascículo longitudinal medial. Para esquema da neuroanatomia,
clique.
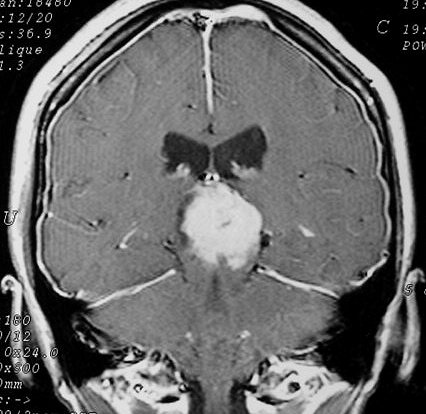
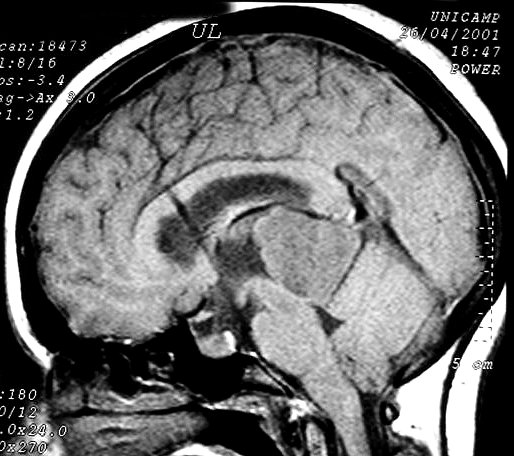
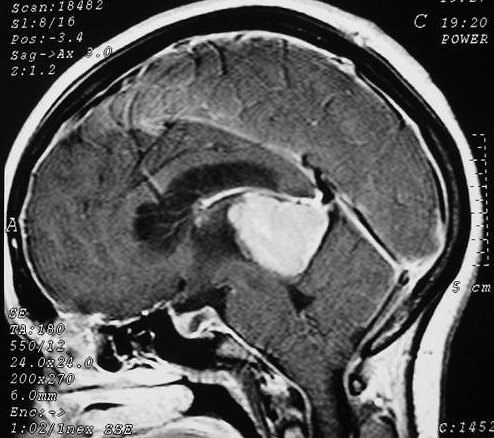
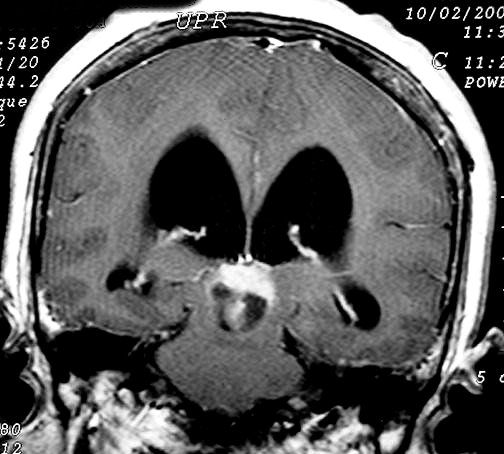
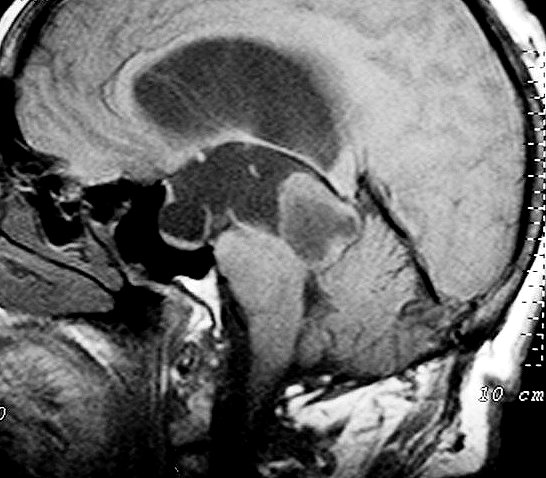
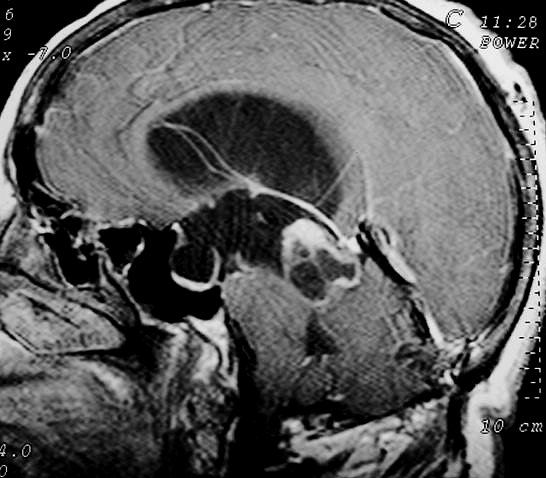
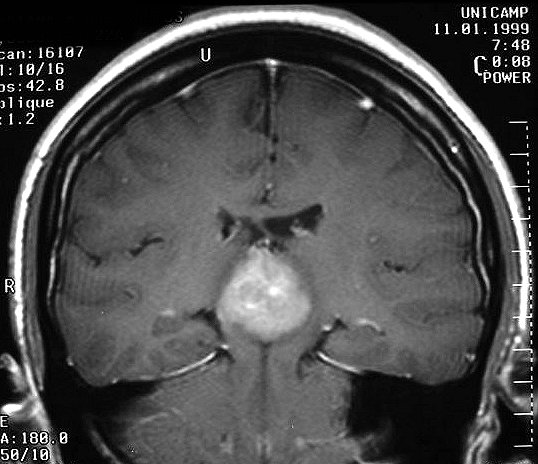
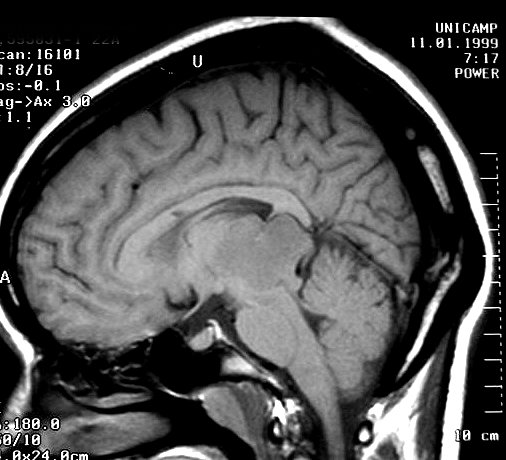
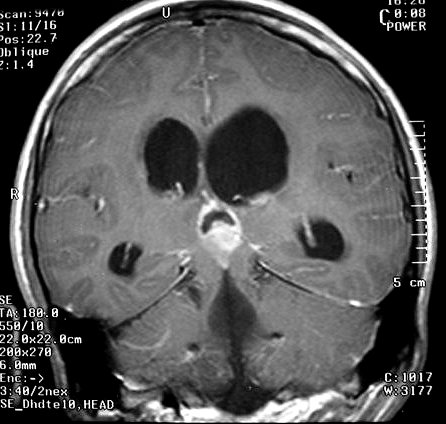
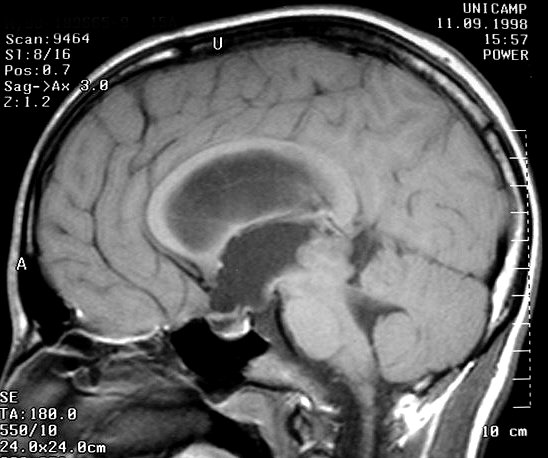
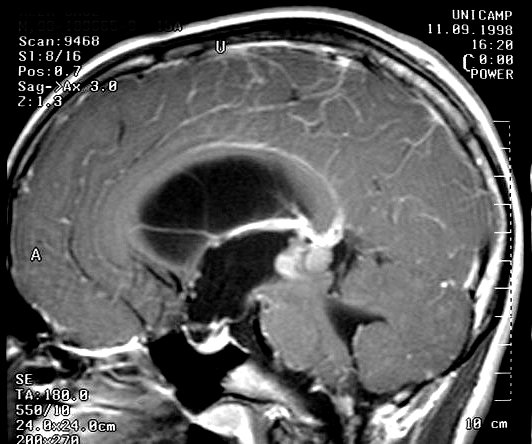
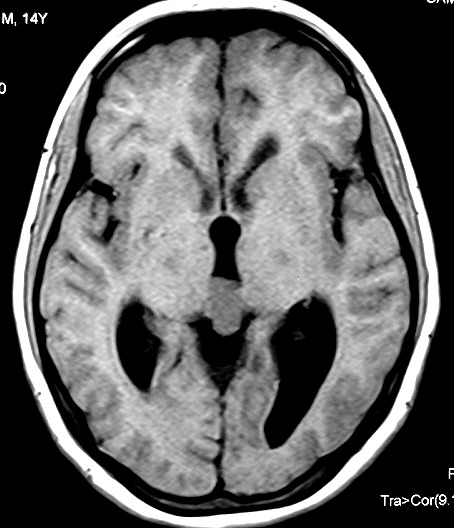
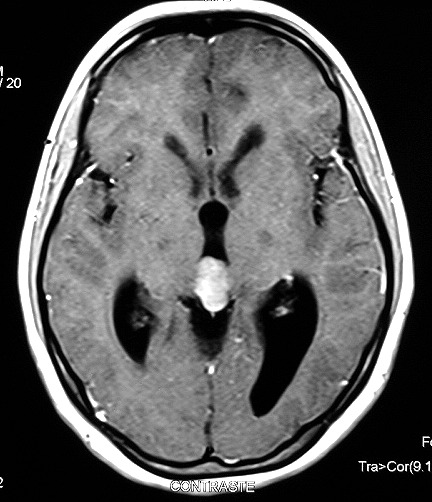
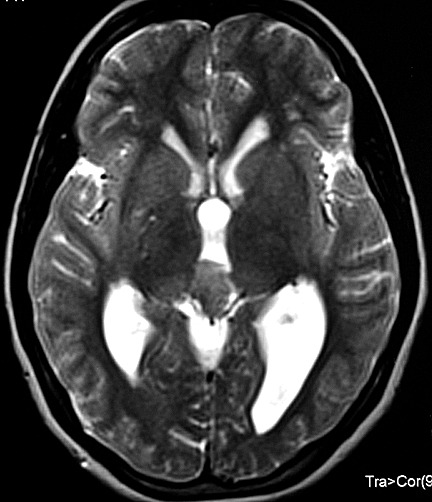
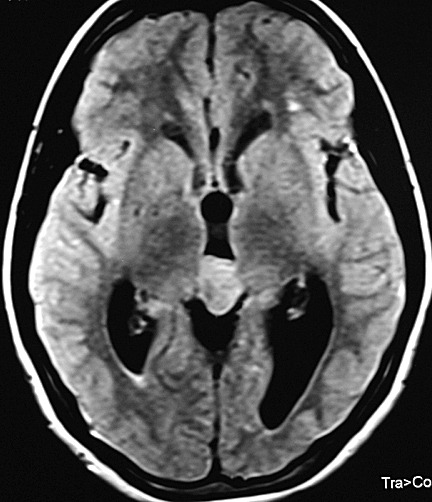
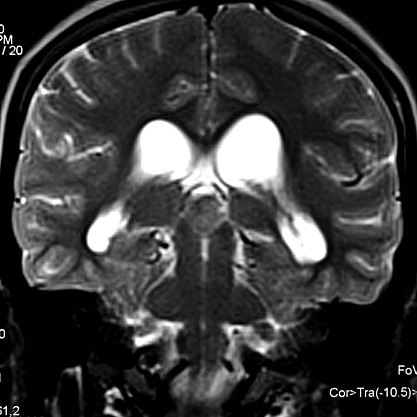
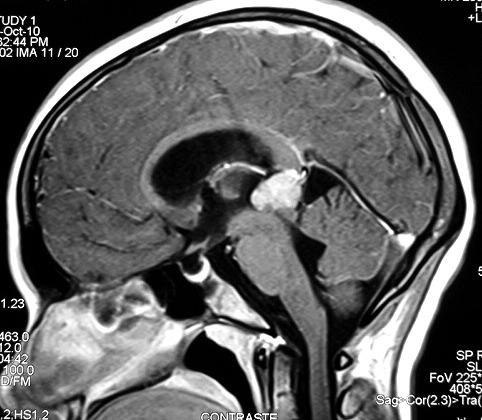
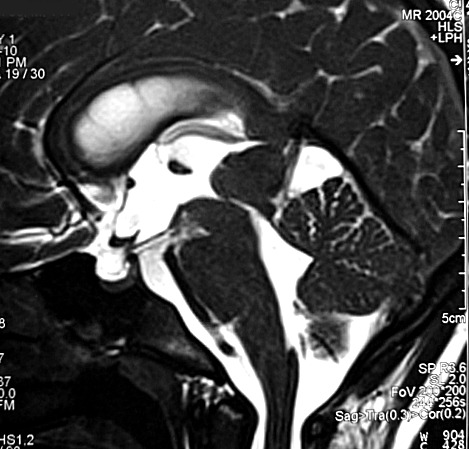
Imagem.
Os métodos atuais não permitem distinção segura
entre os tumores do parênquima pineal entre si ou de outros, como
os tumores germinativos. O diagnóstico diferencial entre eles é
histopatológico. Os pineocitomas
caracteristicamente são arredondados, bem demarcados, mais compressivos
que infiltrativos. Os pineoblastomas
tendem a ser mais infiltrativos, e podem mostrar disseminação
meníngea. (Contudo, há considerável superposição).
Pode haver calcificações na TC. Na RM as lesões dão
isossinal à substância cinzenta em todas as seqüências
e se impregnam por contraste.
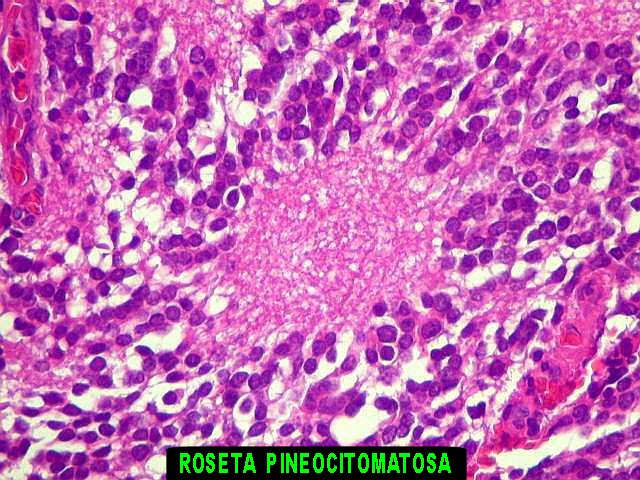
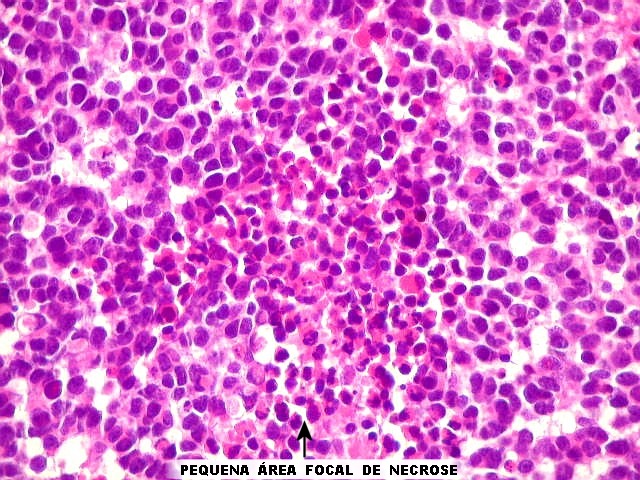
Histopatologia.
Pineocitomas
são bem diferenciados, moderadamente celulares, compostos de células
lembrando pineocitos. As células
neoplásicas são uniformes, com núcleos ovalados, arranjadas
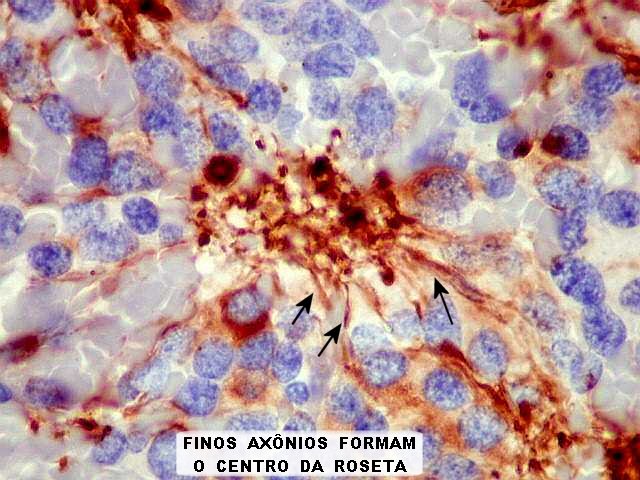
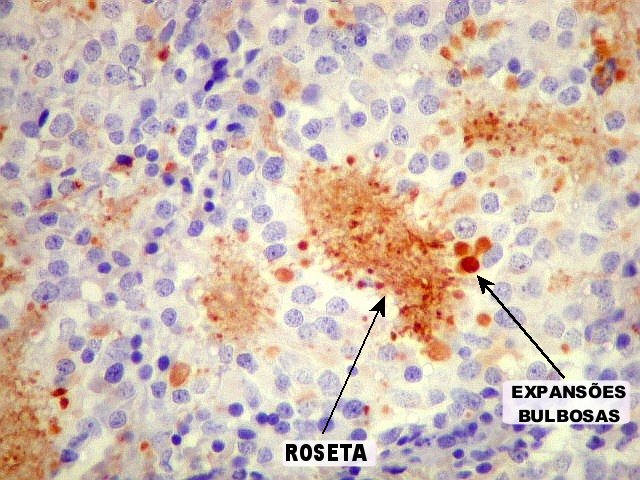
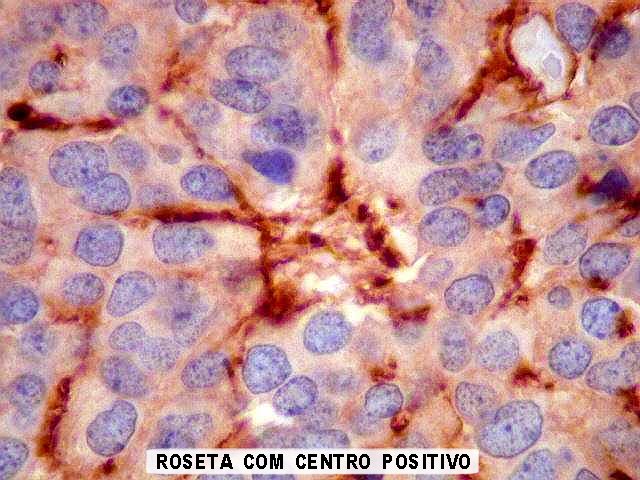
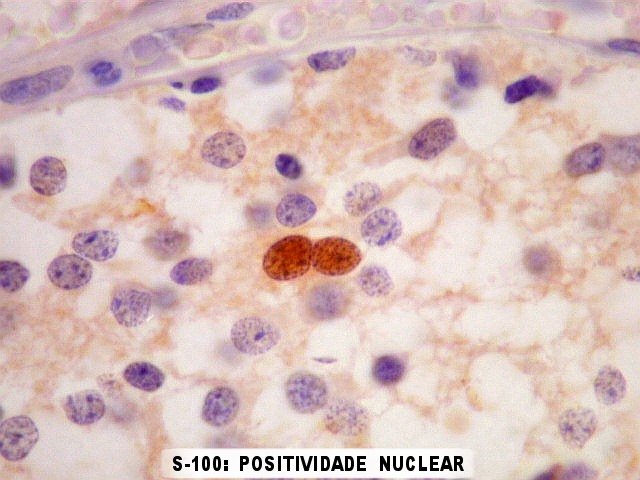
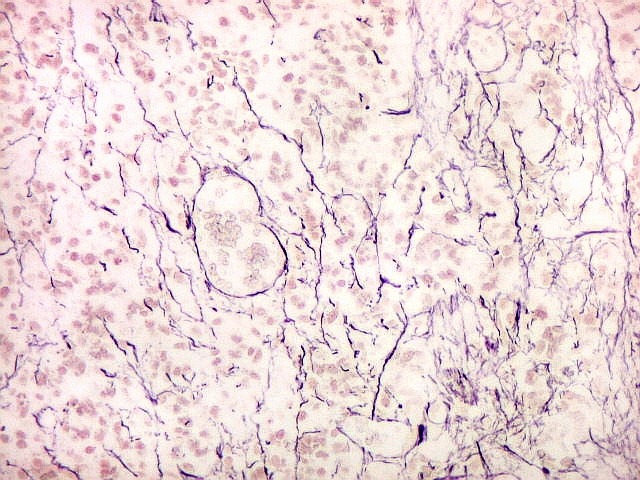
difusamente ou em padrão lobular. As rosetas
pineocitomatosas são uma feição característica,
e consistem de grandes áreas fibrilares arredondadas circundadas
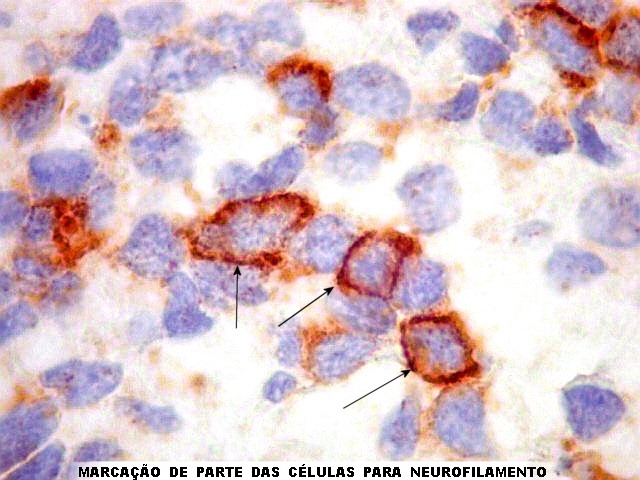
por células neoplásicas. Com técnicas argênticas,
ou imunohistoquímica para
neurofilamento,
as células podem mostrar prolongamentos orientados para o centro
da roseta e terminados em bulbos. Vasos são delicados, sem proliferação
endotelial, e não há necrose. Mitoses são muito raras
ou ausentes.
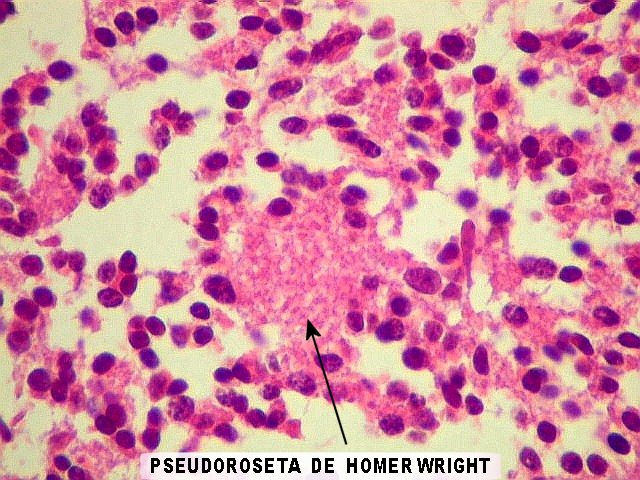
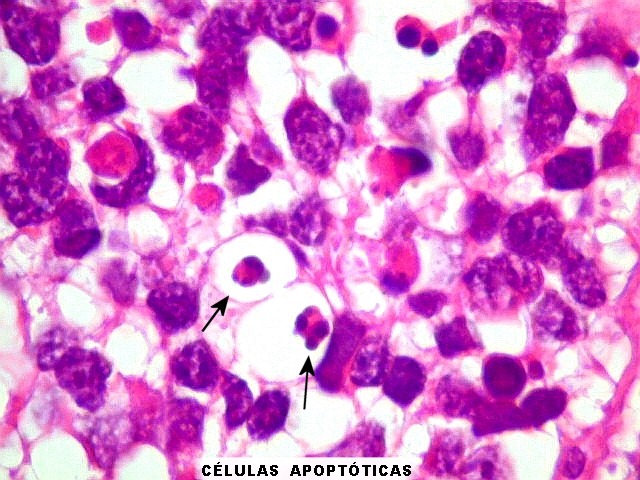
Pineoblastomas
são tumores pouco diferenciados de células pequenas, redondas,
com núcleos densos e escuros, e citoplasma escasso de limites imprecisos
(entram na categoria de tumores de pequenas células azuis ou small
blue cell tumors). A relação núcleo-citoplasma
é alta, como para outros tumores malignos. São, portanto,
indistinguíveis
morfologicamente dos meduloblastomas
e outros tumores neuroectodérmicos primitivos (PNETs)
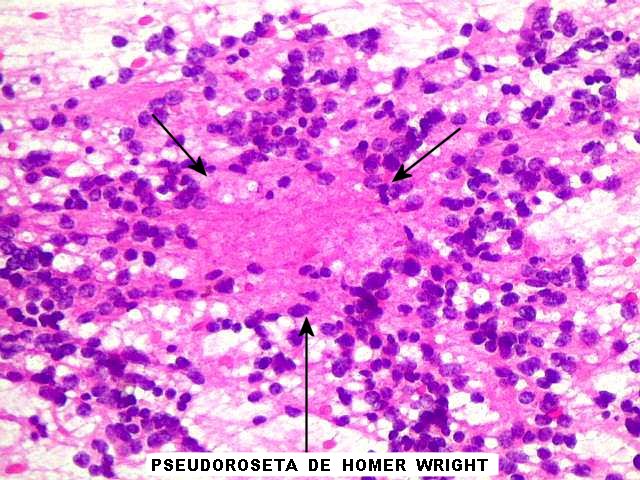
do sistema nervoso central. Podem ocorrer pseudorrosetas
de Homer Wright, menores que as rosetas pineocitomatosas. Há
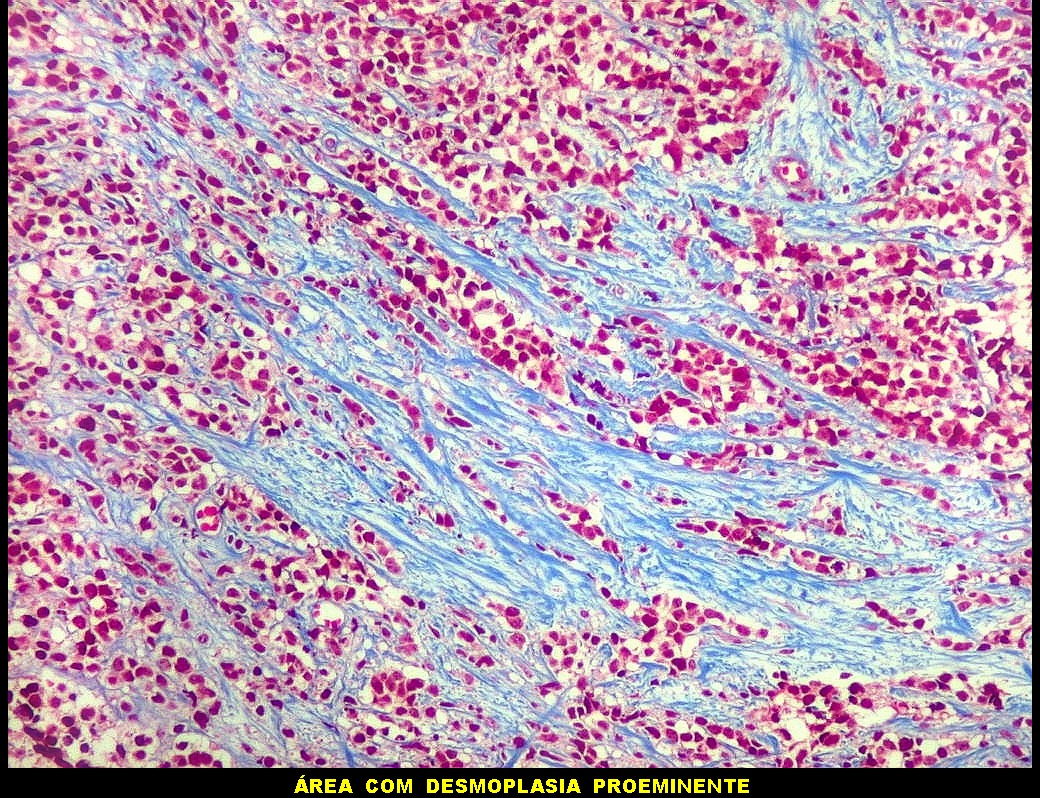
variável atividade mitótica e áreas de necrose. Os
vasos são geralmente de paredes finas, mas pode haver proliferação
endotelial. Comumente, há invasão da glândula
pineal e das meninges. Pode haver diferenciação para fotorreceptores,
na forma de rosetas verdadeiras ou de Flexner-Wintersteiner (com lúmen).
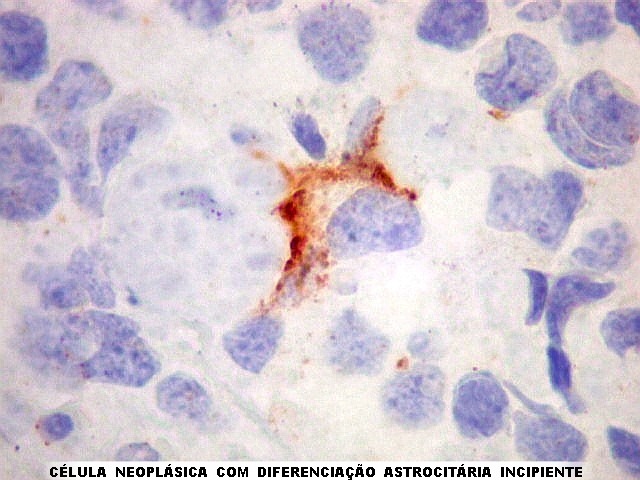
Tumores de diferenciação
intermediária ainda não têm critérios
bem definidos para designação como grau II ou III. As feições
que parecem correlacionar-se com o comportamento biológico dos tumores
do parênquima pineal são a taxa de proliferação
(avaliada pela contagem de mitoses ou positividade para Ki-67), e o grau
de diferenciação neuronal, demonstrada por estudos ultraestruturais
ou imunohistoquímicos. O pineocitoma e pineoblastoma representam
os extremos deste espectro.
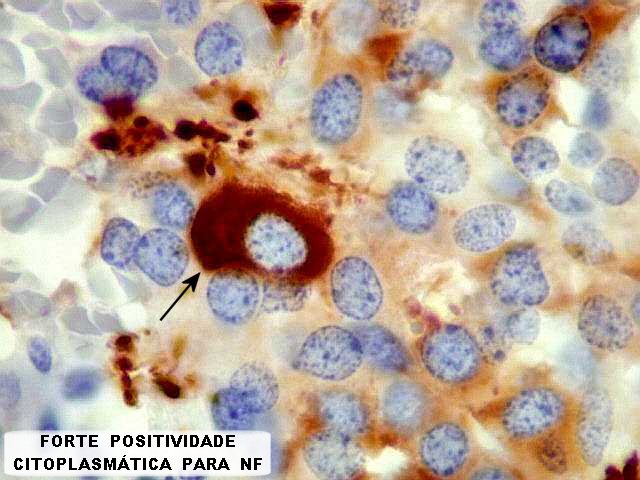
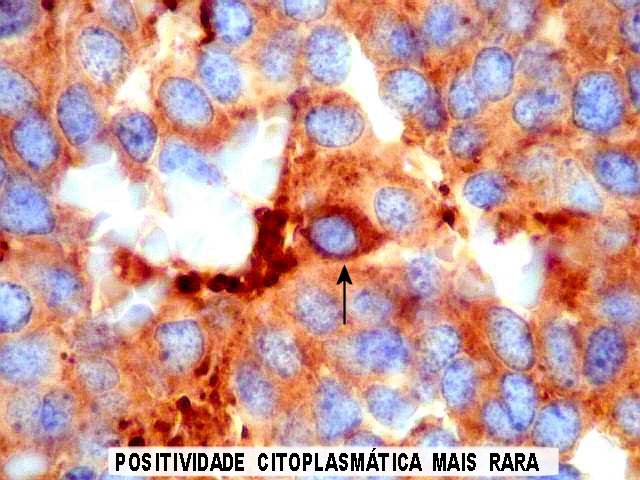
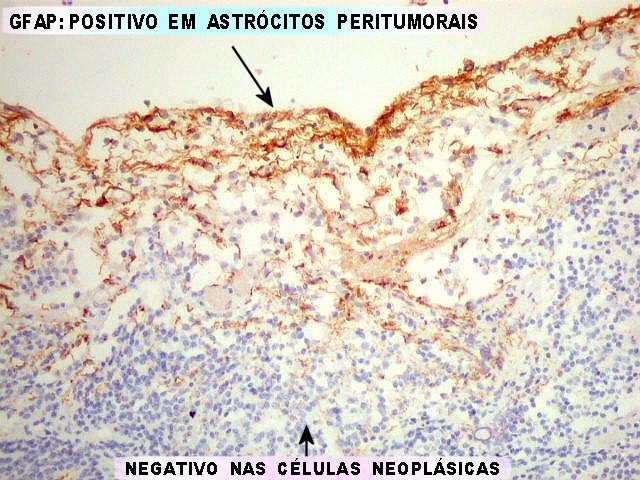
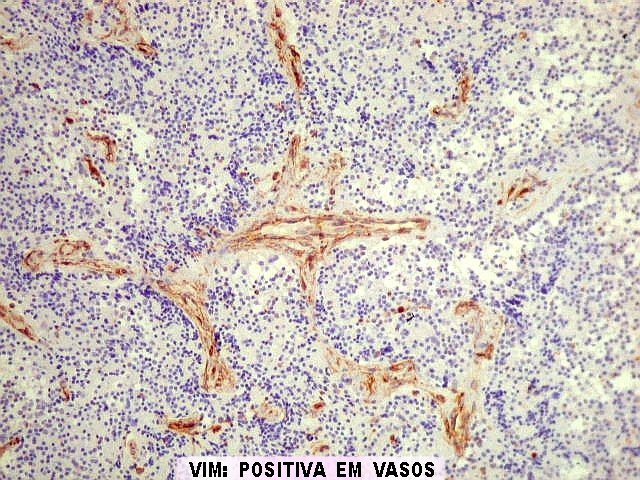
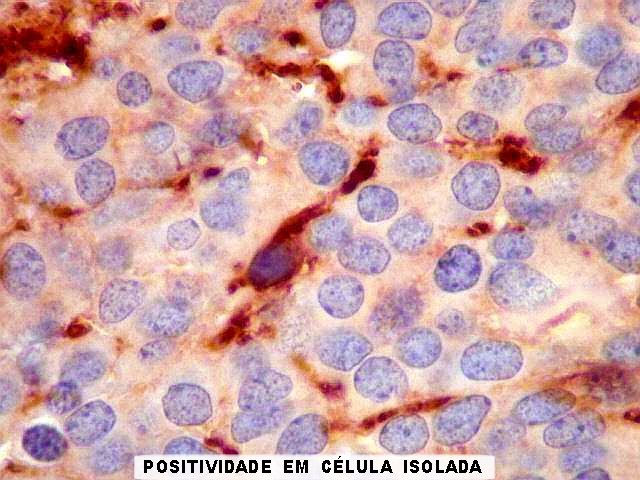
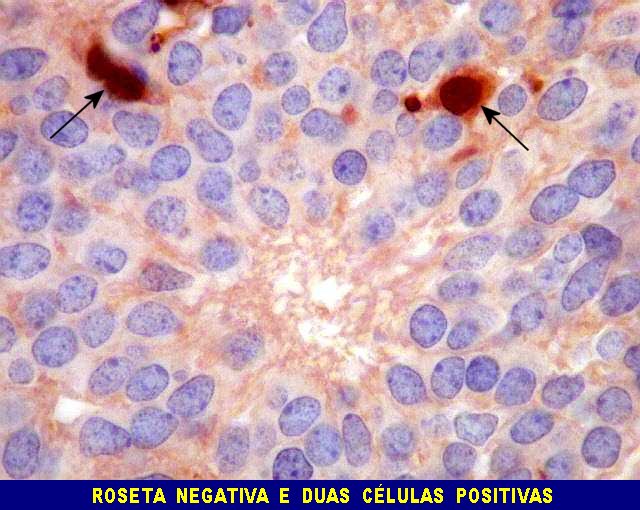
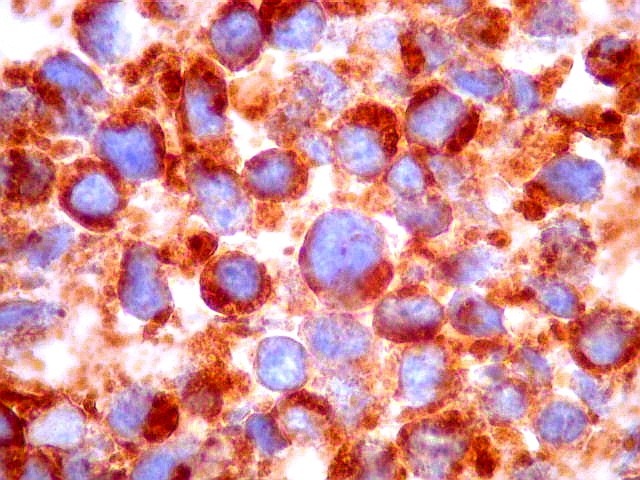
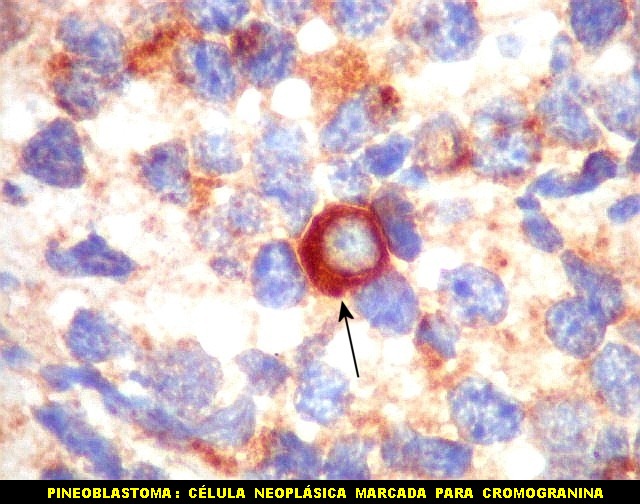
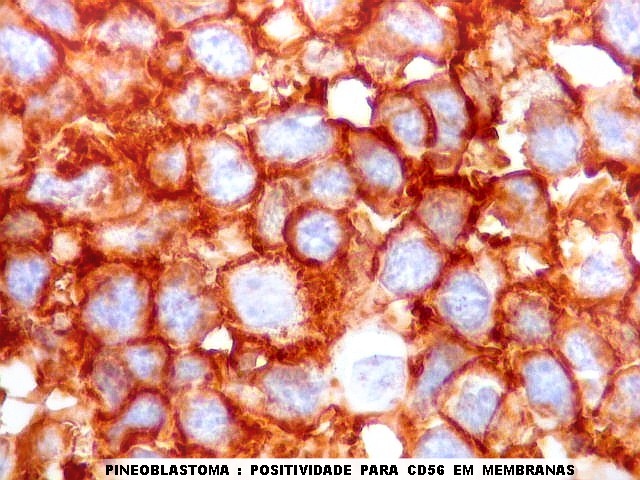
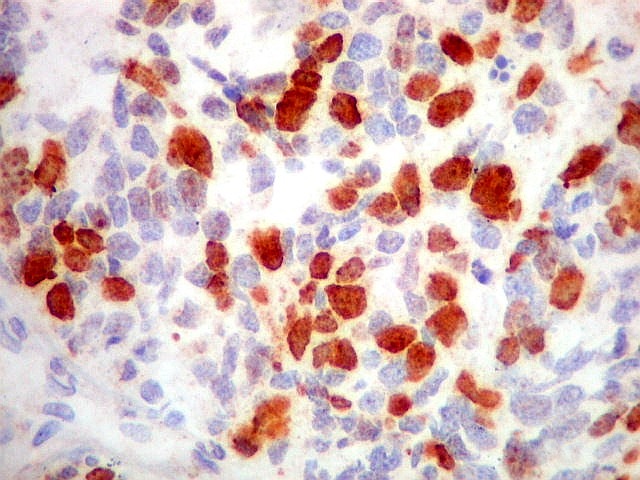
Imunohistoquímica.
Diferenciação neuronal nos tumores do parênquima pineal
é avaliada por sinaptofisina (SNF), enolase neurônio-específica
(NSE), e proteína de neurofilamento (NF). O marcador neuroendócrino
cromogranina A também pode ser usado. A positividade é
forte e citoplasmática nos pineocitomas.
Nos pineoblastomas a marcação
é variável, menos intensa e pode ser negativa para alguns
marcadores.
Tratamento.
Em pineocitomas, o principal objetivo é a ressecção
completa do tumor por via infratentorial supracerebelar ou occipital transtentorial.
Para pineoblastomas, a abordagem baseia-se em cirurgia, radioterapia e
quimioterapia.
A ressecção
completa ainda é o melhor indicativo de bom prognóstico,
com trabalhos mostrando sobrevida de 10 anos de 15% se restou tumor significativo,
contra 100% para ausência de tumor residual. Irradiação
cranioespinal (visando controlar disseminação por via liquórica)
reduz o risco de recidivas locais e distantes. Radioterapia em crianças
pequenas deve ser retardada para minorar déficits neurocognitivos.
Quimioterapia deve ser usada como adjuvante, pois não é de
alta eficiência isoladamente.
Tumores
de grau intermediário devem ser ressecados tão completamente
quanto possível, pois tumor residual pode evoluir para grau mais
alto.
O prognóstico
depende do tipo histológico, estadiamento quando do diagnóstico
e resposta ao tratamento inicial. Pineocitomas têm prognóstico
favorável com sobrevida de 5 anos entre 86 e 91%. Para tumores de
grau intermediário isto varia entre 49 a 62%. Para pineoblastomas,
em que é comum disseminação liquórica, fica
em 10%, portanto pior que para meduloblastomas (atualmente na casa dos
60%).
Fonte:
Vasiljevic A, Fèvre-Montange M, Jouvet A. Pineal Parenchymal
Tumors. In Perry A, Brat DJ (eds). Practical Surgical Neuropathology.
Churchill Livingstone Elsevier, 2010. pp 151-63.
|