|
|
rosetas em multicamadas. 5. Microscopia eletrônica. |
|
|
|
rosetas em multicamadas. 5. Microscopia eletrônica. |
|
| Fem. 2a 2m. Clique para TC, RM, macro, HE, destaques da IH, GFAP, VIM, NF, SNF, MAP2, NeuN, EMA, Ki67, microscopia eletrônica, texto. Obs. página acrescentada em 20/1/2017. |
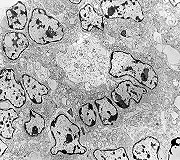
| Destaques da microscopia eletrônica. | ||
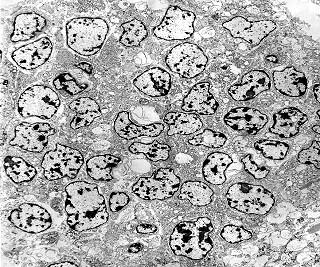
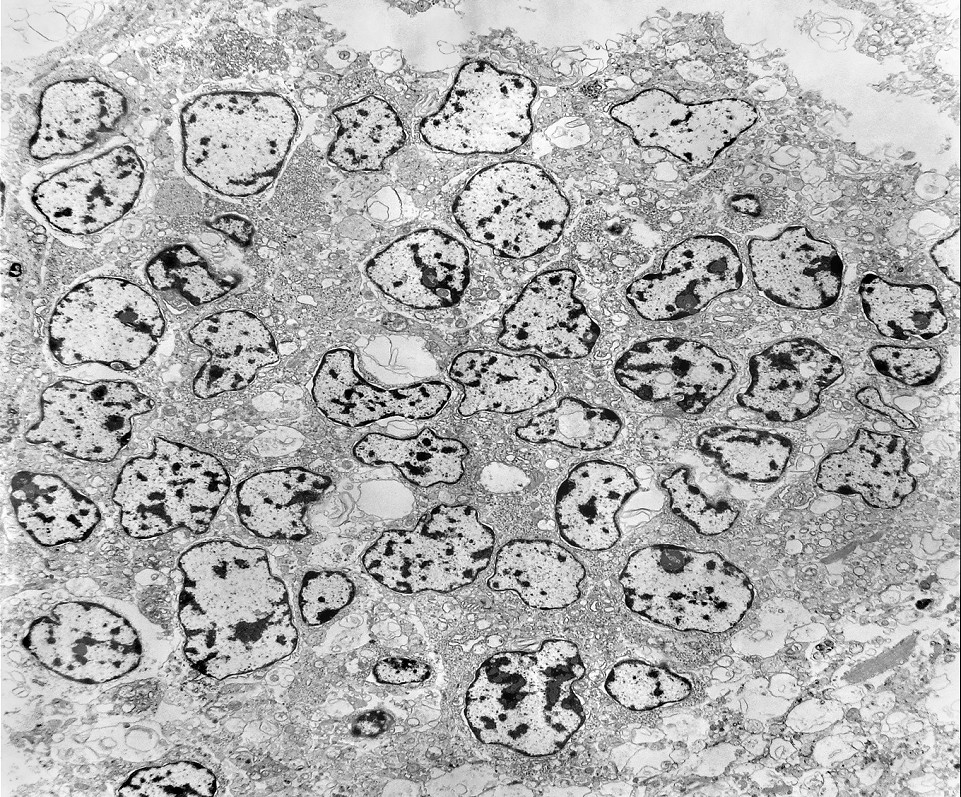
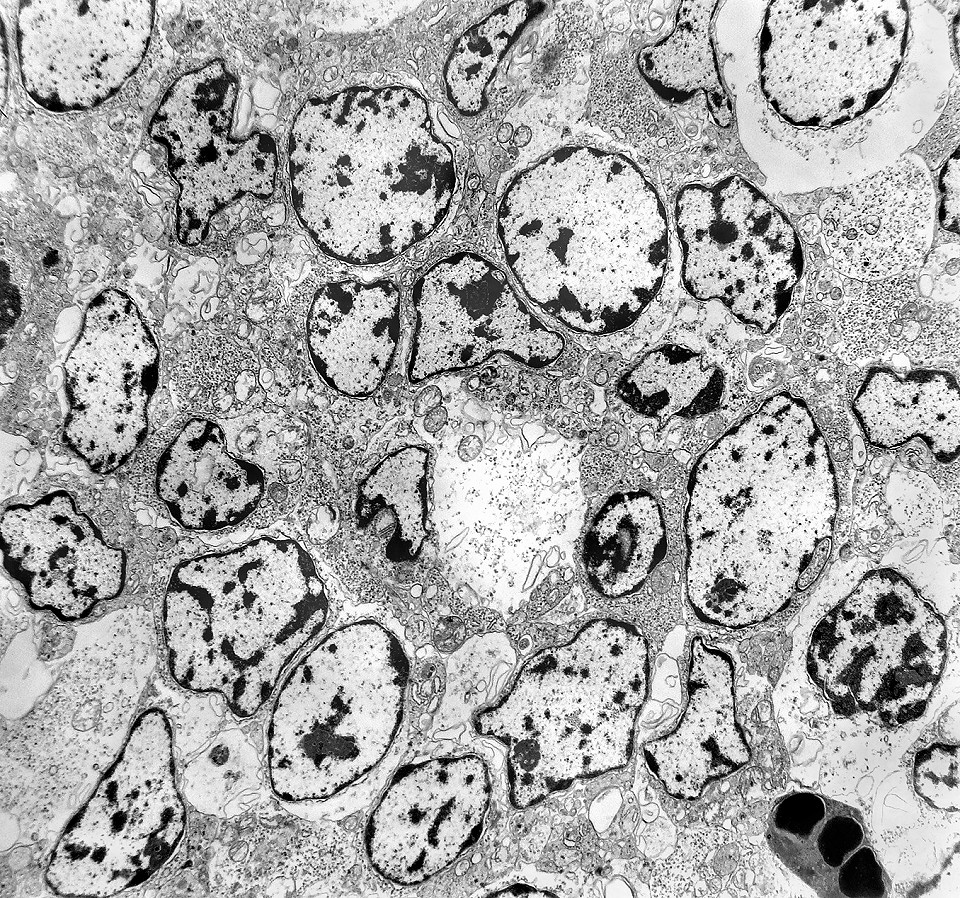
| Caráter 'primitivo', sólido, densamente celular, células poligonais intimamente apostas. Citoplasma | Roseta de centro preenchido. Rosetas com apoptose. Rosetas com junções no ápices celulares | Roseta de centro vazio |
 |
 |
 |
| Mitose | Apoptose | Junções adherens entre membranas apicais de células participantes de rosetas |
 |
 |
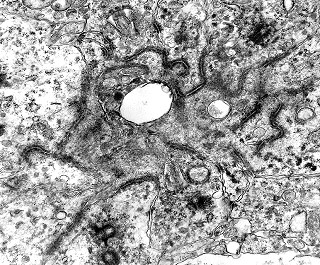 |
| Centríolos | Neurópilo | Capilares |
 |
 |
 |
| Destaques da HE, imunohistoquímica | ||
|
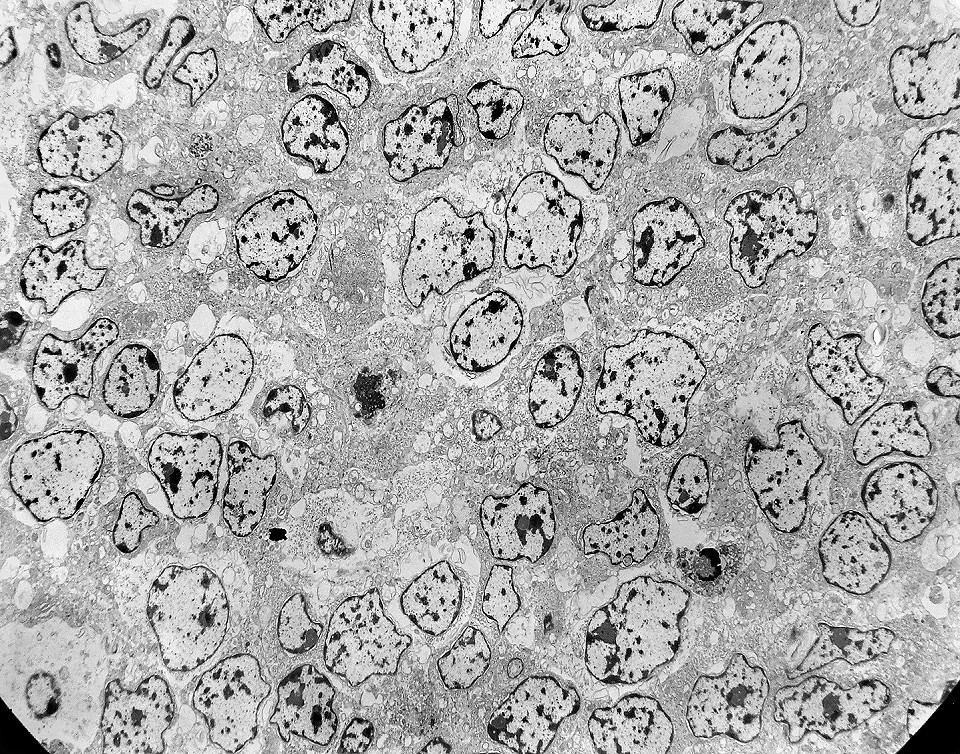
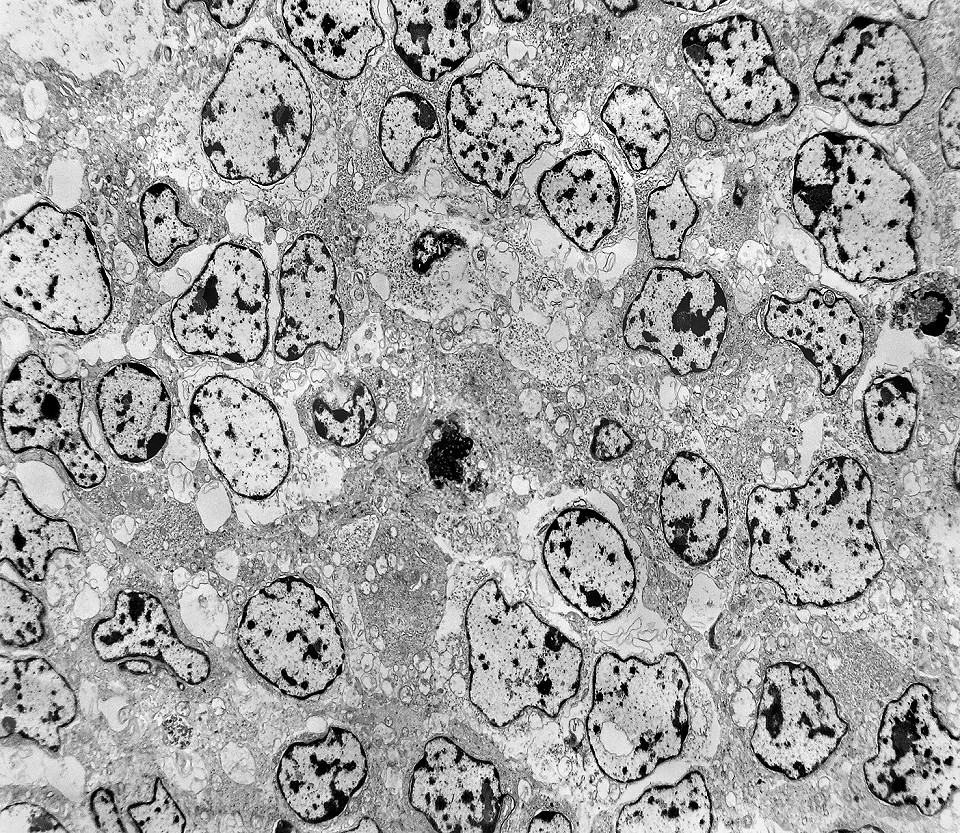
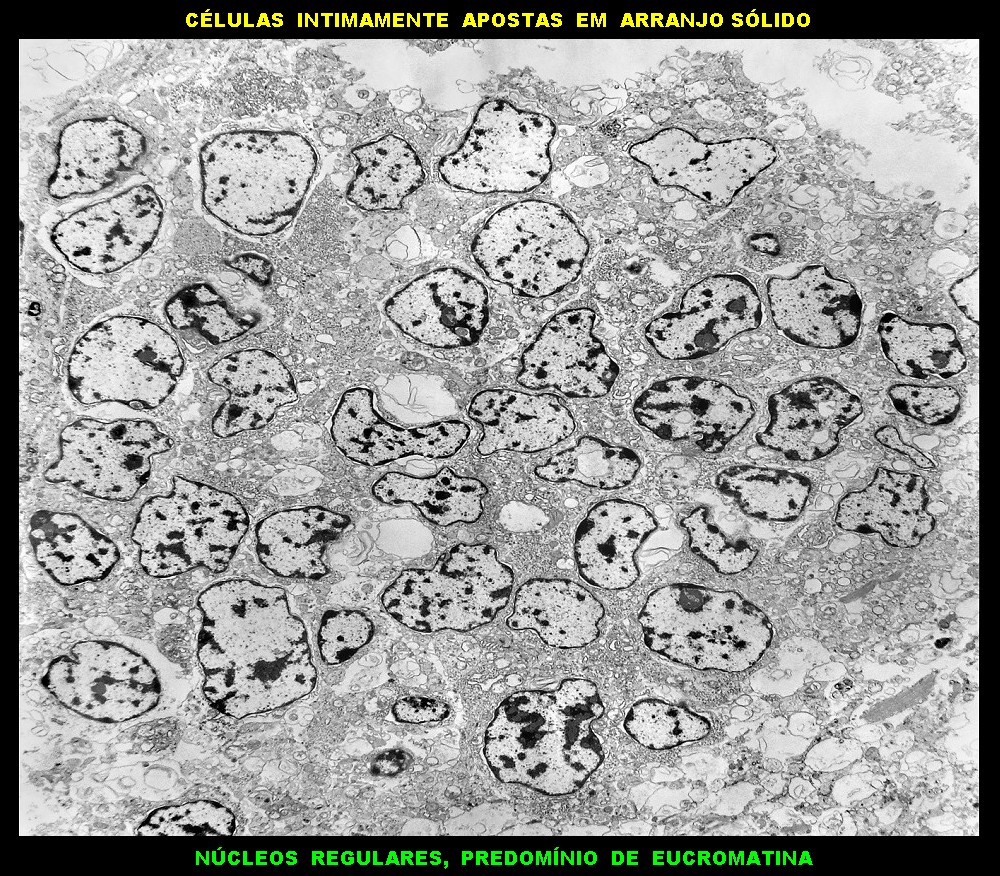
| Áreas sólidas. Em grande parte do tumor, as células neoplásicas dispõem-se lado a lado à maneira de epitélio, com aposição íntima das membranas plasmáticas, mas sem junções intercelulares (estas vistas praticamente só próximas às luzes das rosetas) e sem material intersticial. Os núcleos são regulares, com escassa variação de forma e tamanho, cromatina frouxa, exceto alguns pontos de heterocromatina (mais densa). O caráter frouxo da cromatina (eucromatina) sugere intensa atividade de transcrição gênica, compatível com o rápido crescimento do tumor. |
 |
 |
 |
 |
 |
 |
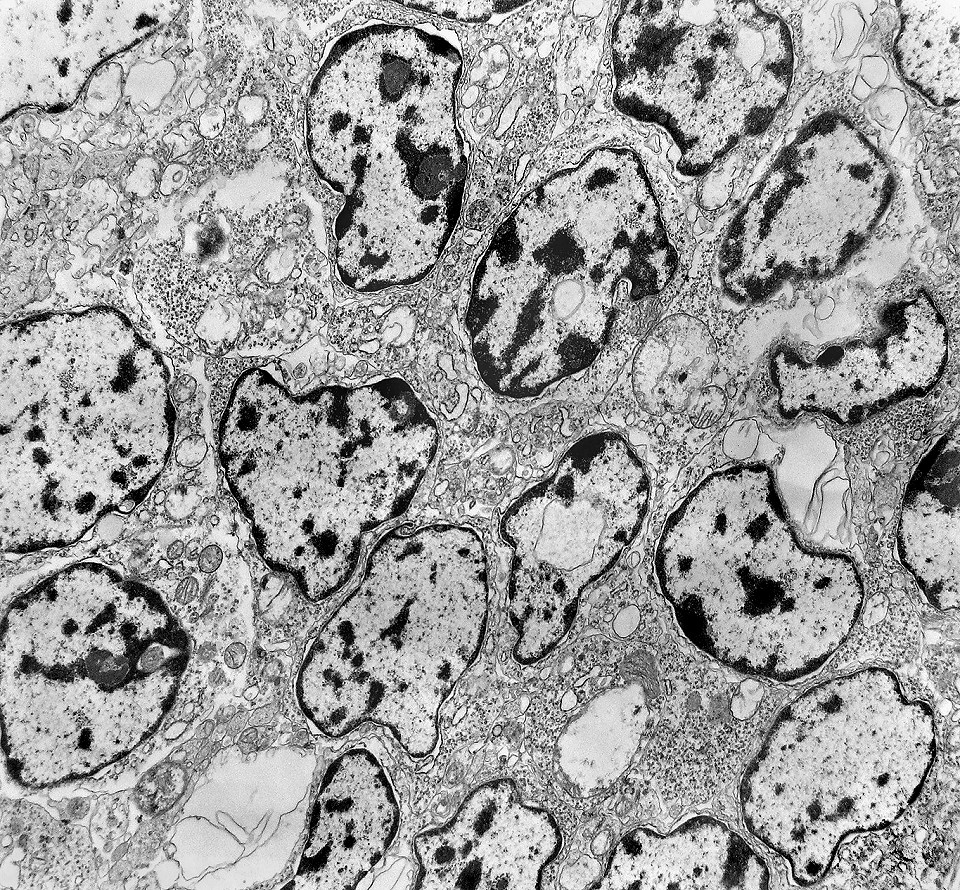 |
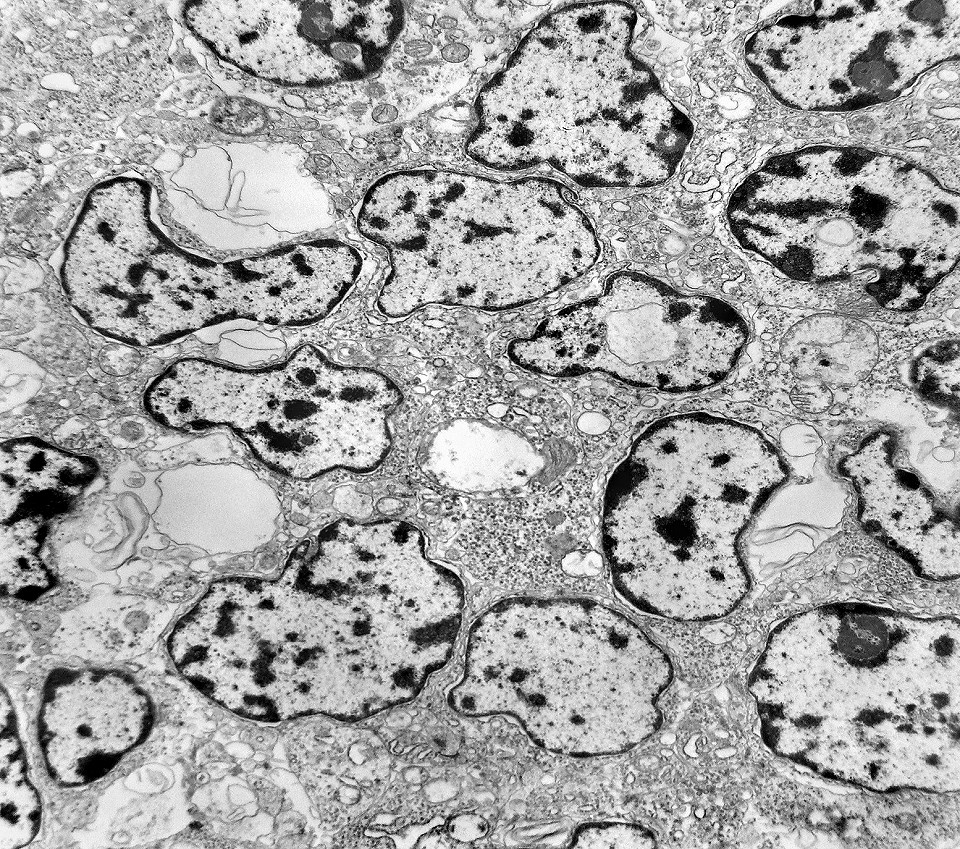
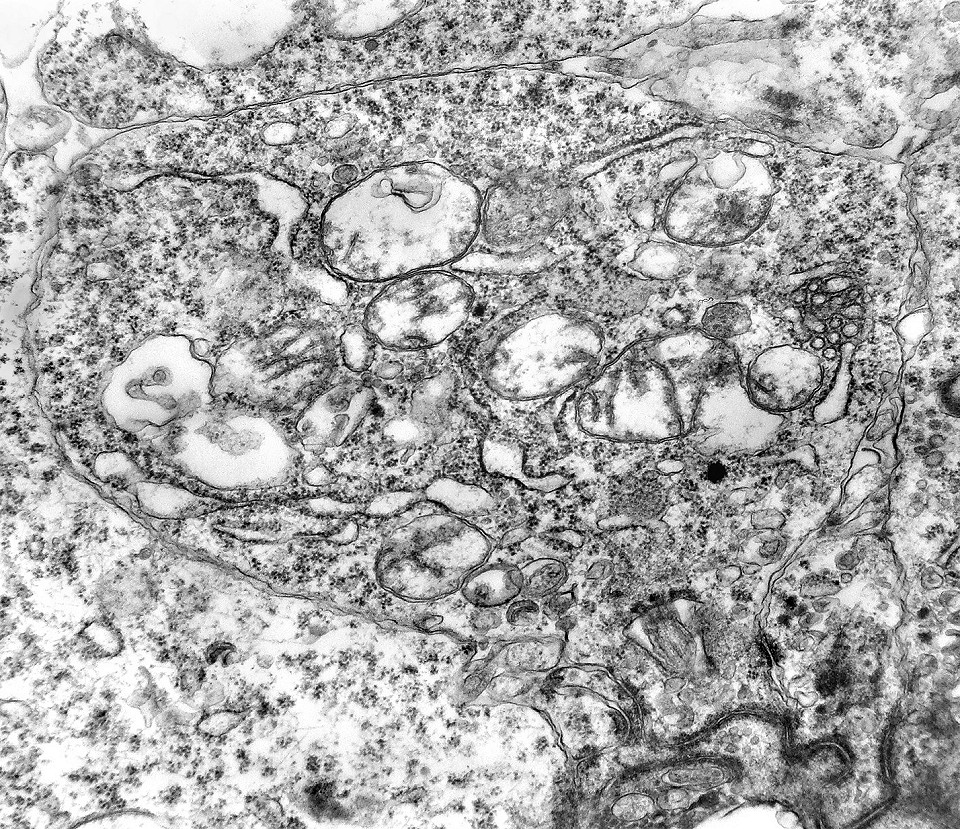
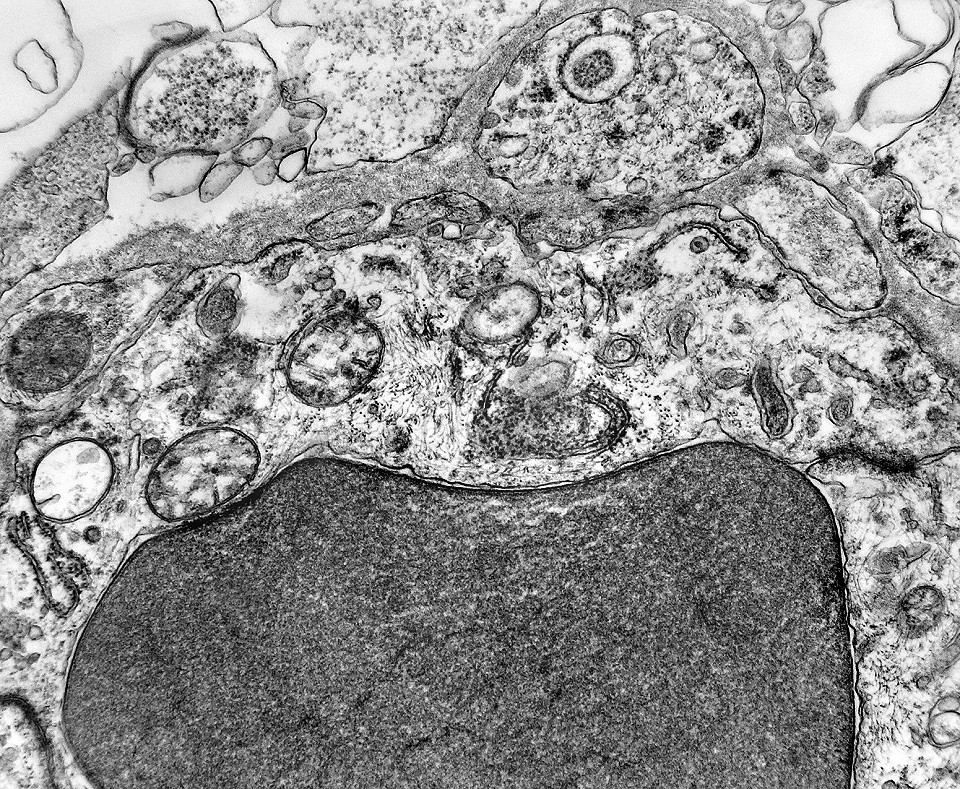
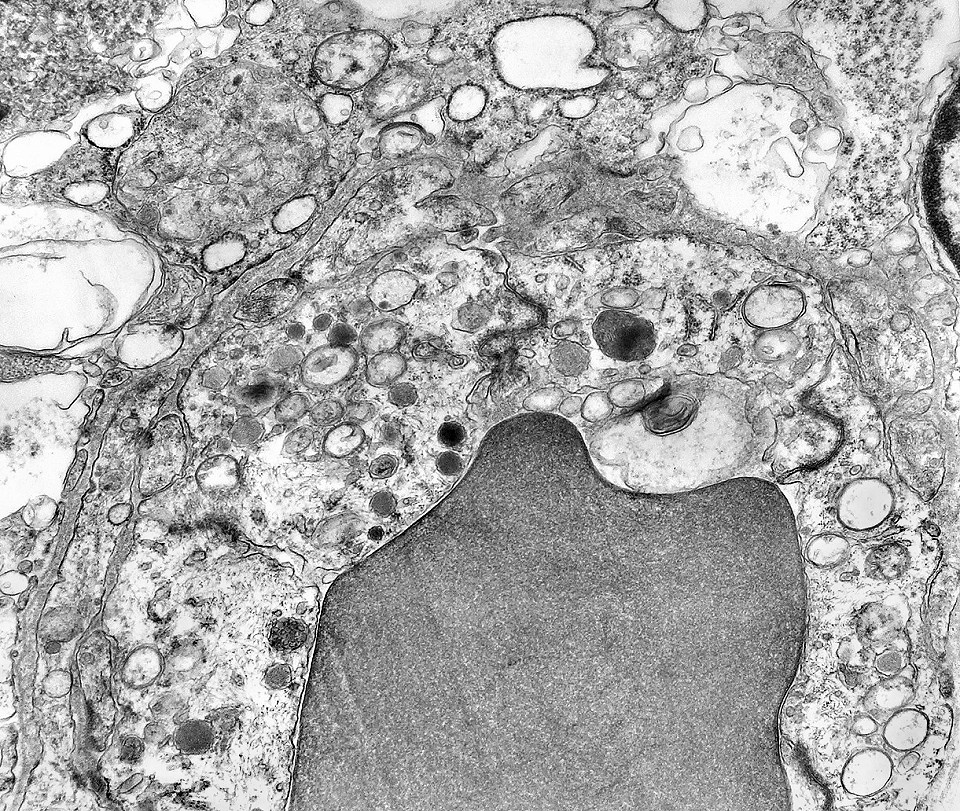
| Citoplasma. As células neoplásicas têm limites nítidos, contorno aproximadamente poligonal. Células vizinhas têm as membranas plasmáticas bem próximas e paralelas. O citoplasma é rico em ribossomos livres ou em rosetas (polirribossomos), menos freqüentemente em retículo endoplasmático rugoso. Mitocôndrias são facilmente observadas, várias mostrando tumefação artefatual devido à anóxia entre a retirada do tumor e a fixação. São também observados vários centríolos, especialmente em células participantes de rosetas. Junções intercelulares são também vistas nas proximidades do centro de rosetas. |
 |
 |
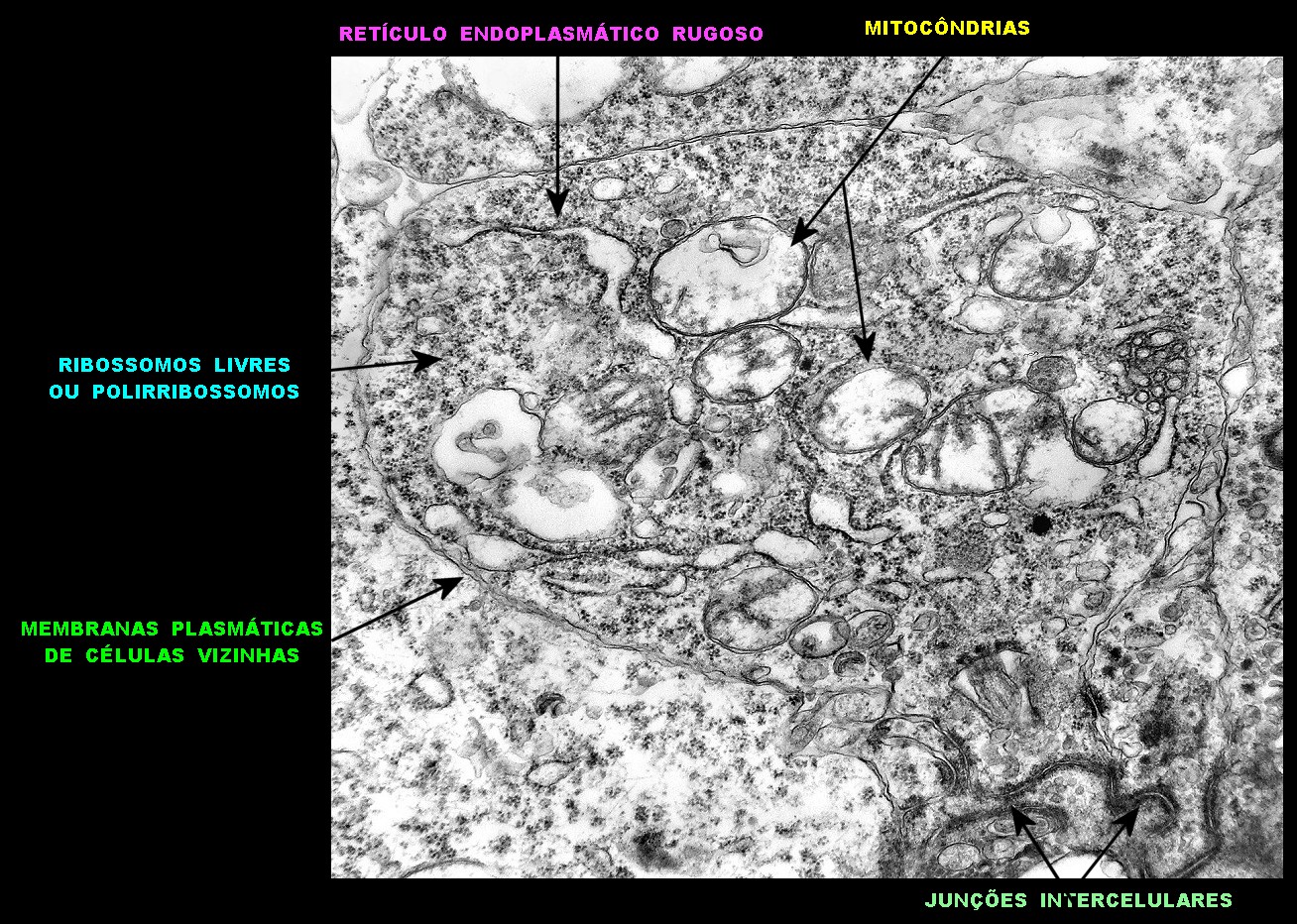 |
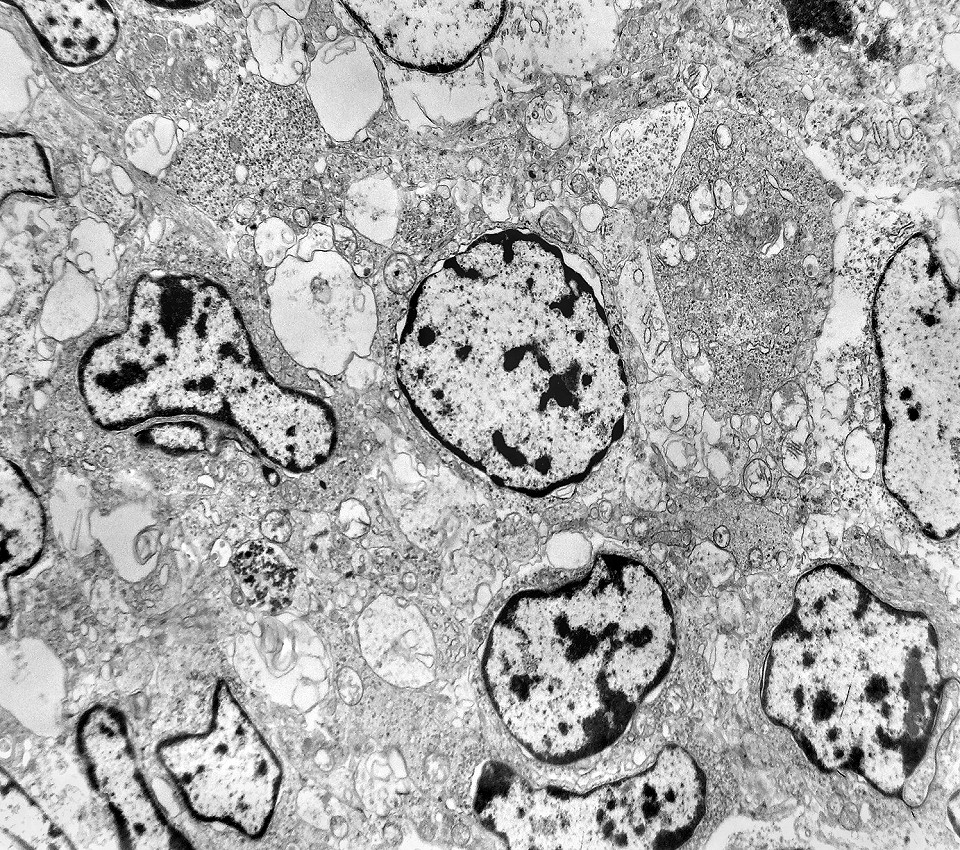
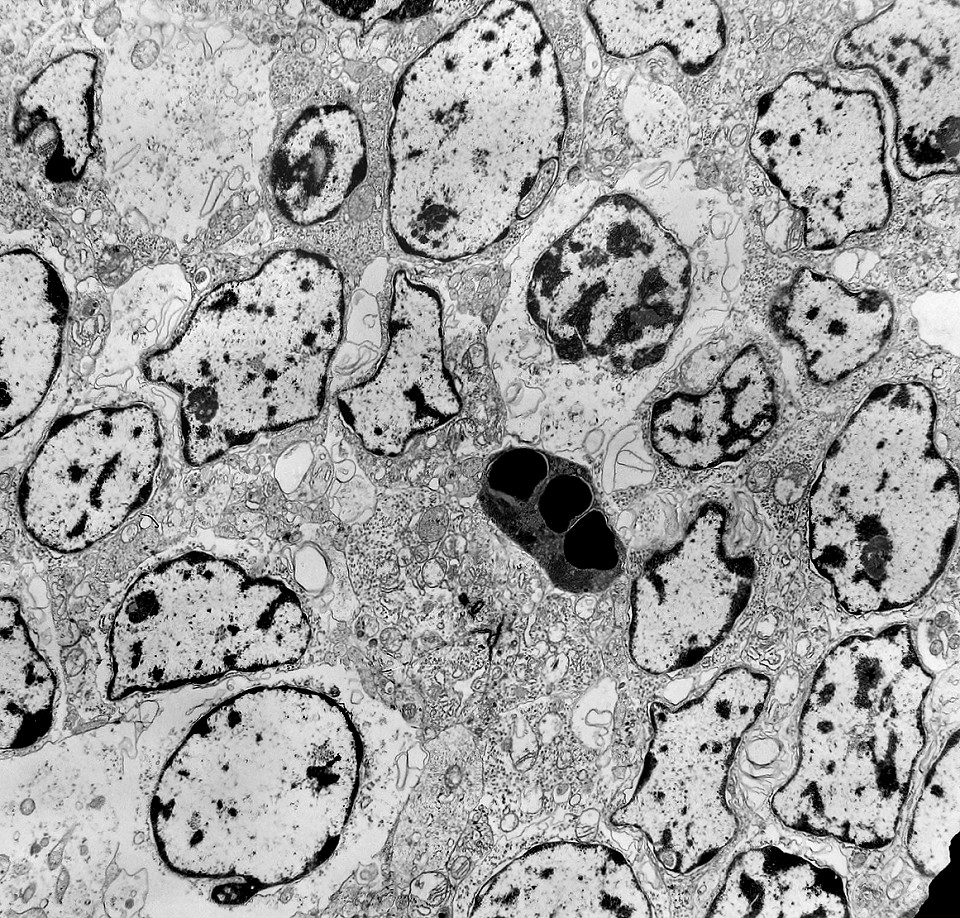
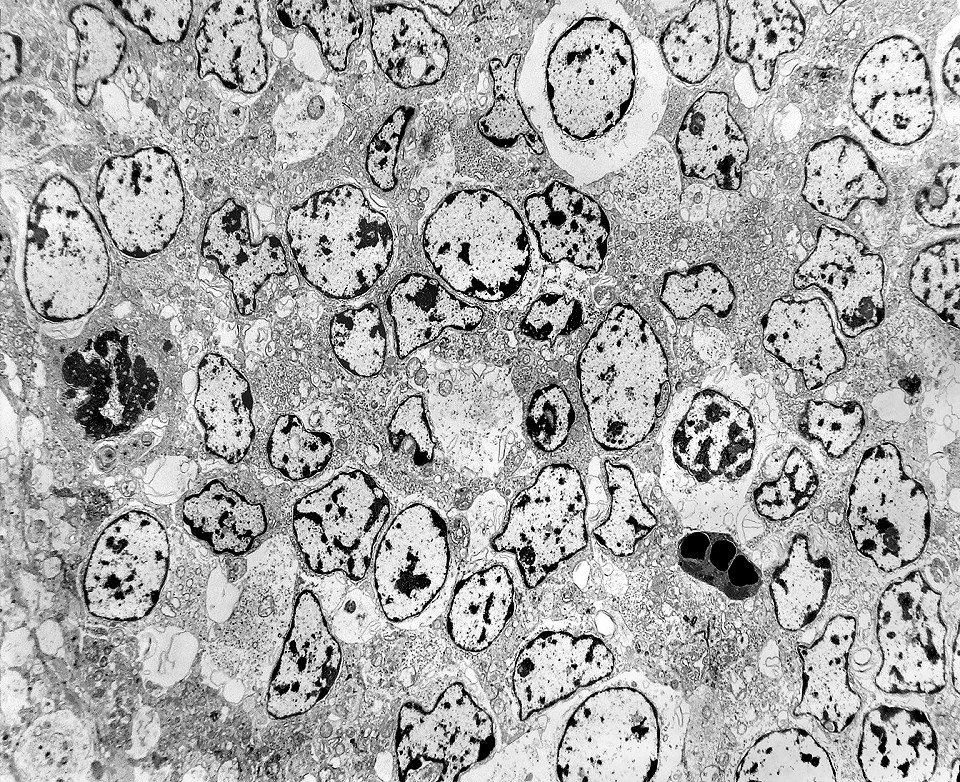
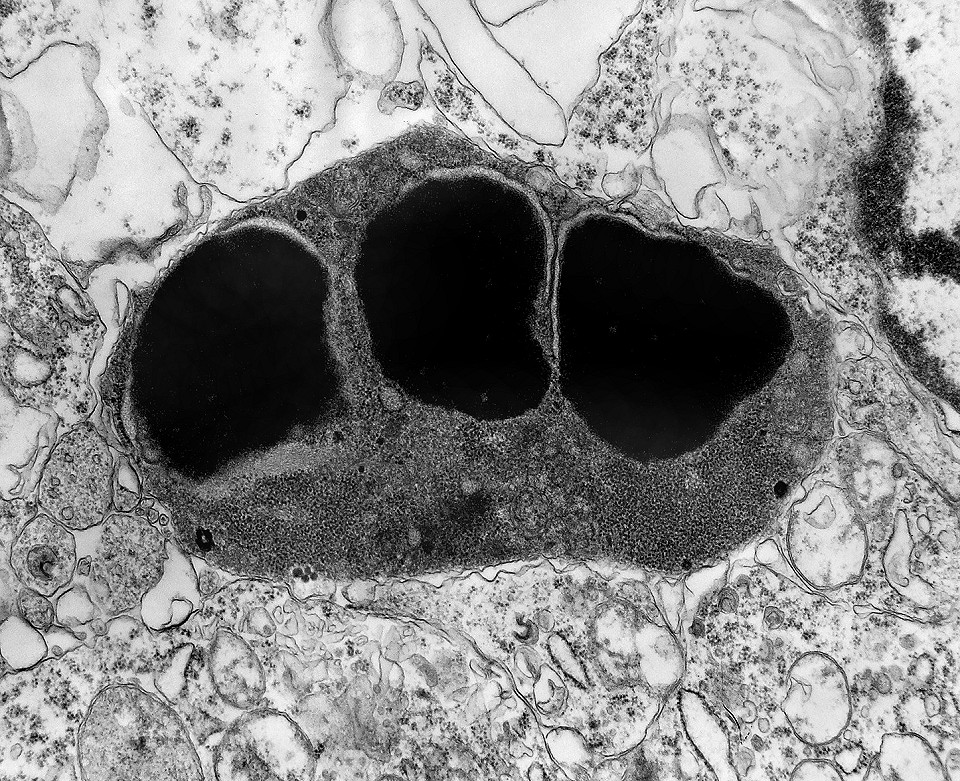
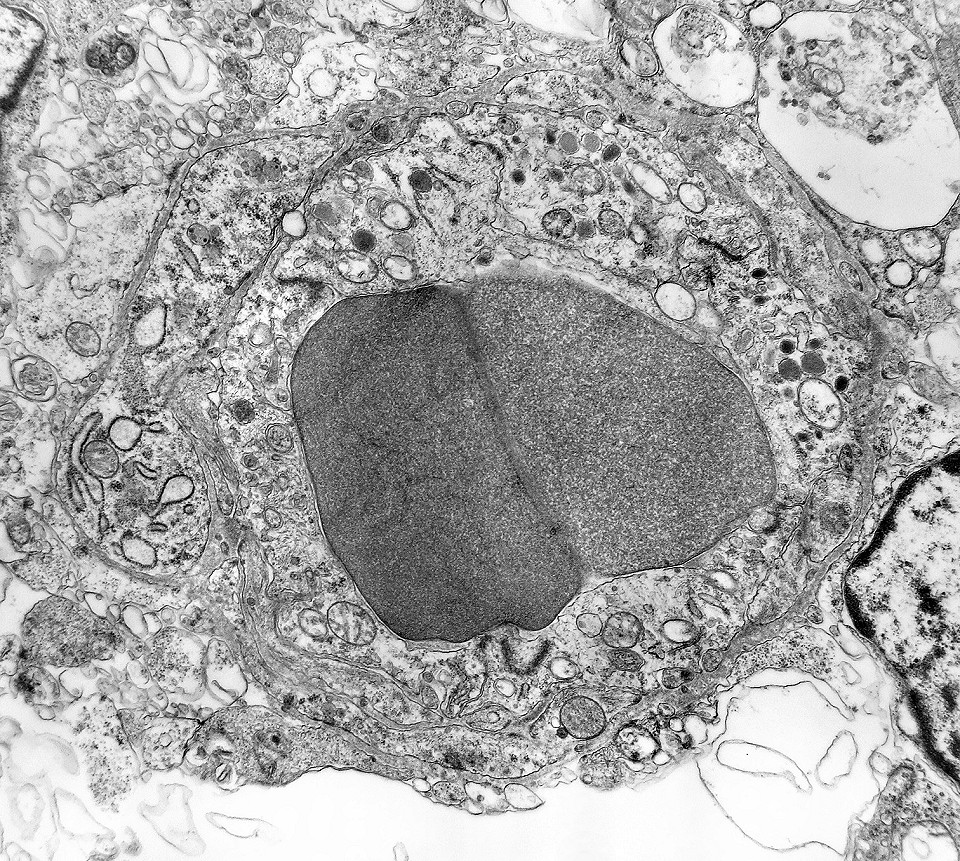
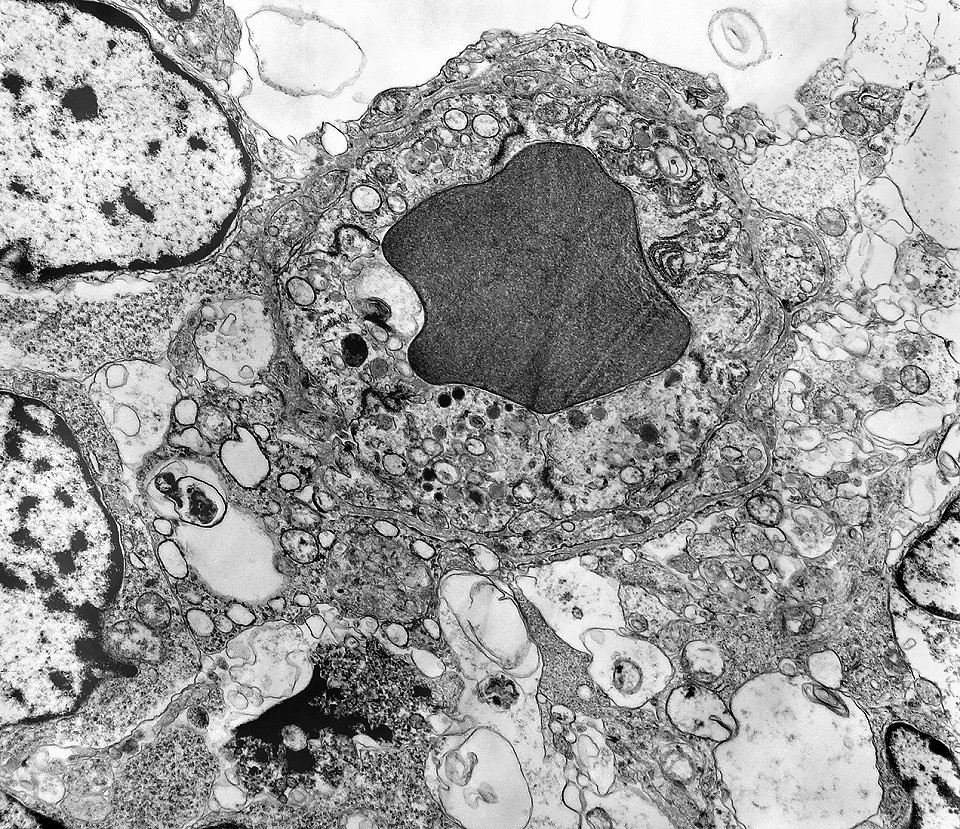
| Rosetas. A formação de rosetas (disposição radial das células em torno de um centro) era encontradiça na microscopia óptica e na microscopia eletrônica foram observados vários exemplos. Mais comumente, a luz da roseta aparecia preenchida por material compatível com debris ou citoplasma, inclusive com organelas. Era freqüente a dúvida se seria uma roseta do tipo Homer Wright (de centro preenchido por prolongamentos celulares) ou do tipo Flexner (centro efetivamente vazio). Poderia aparecer preenchida naquele plano de corte e abrir-se uma luz em outro plano. De qualquer forma, a roseta era reconhecida pela disposição aproximadamente circular dos núcleos celulares em torno de um centro. |
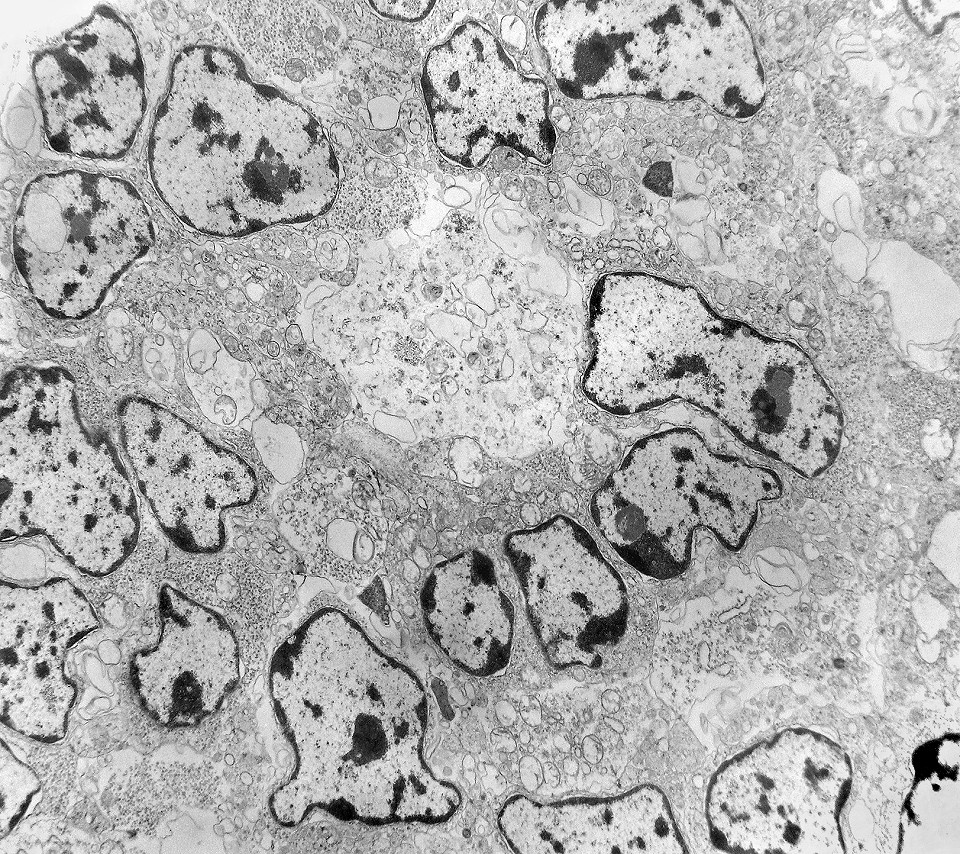 |
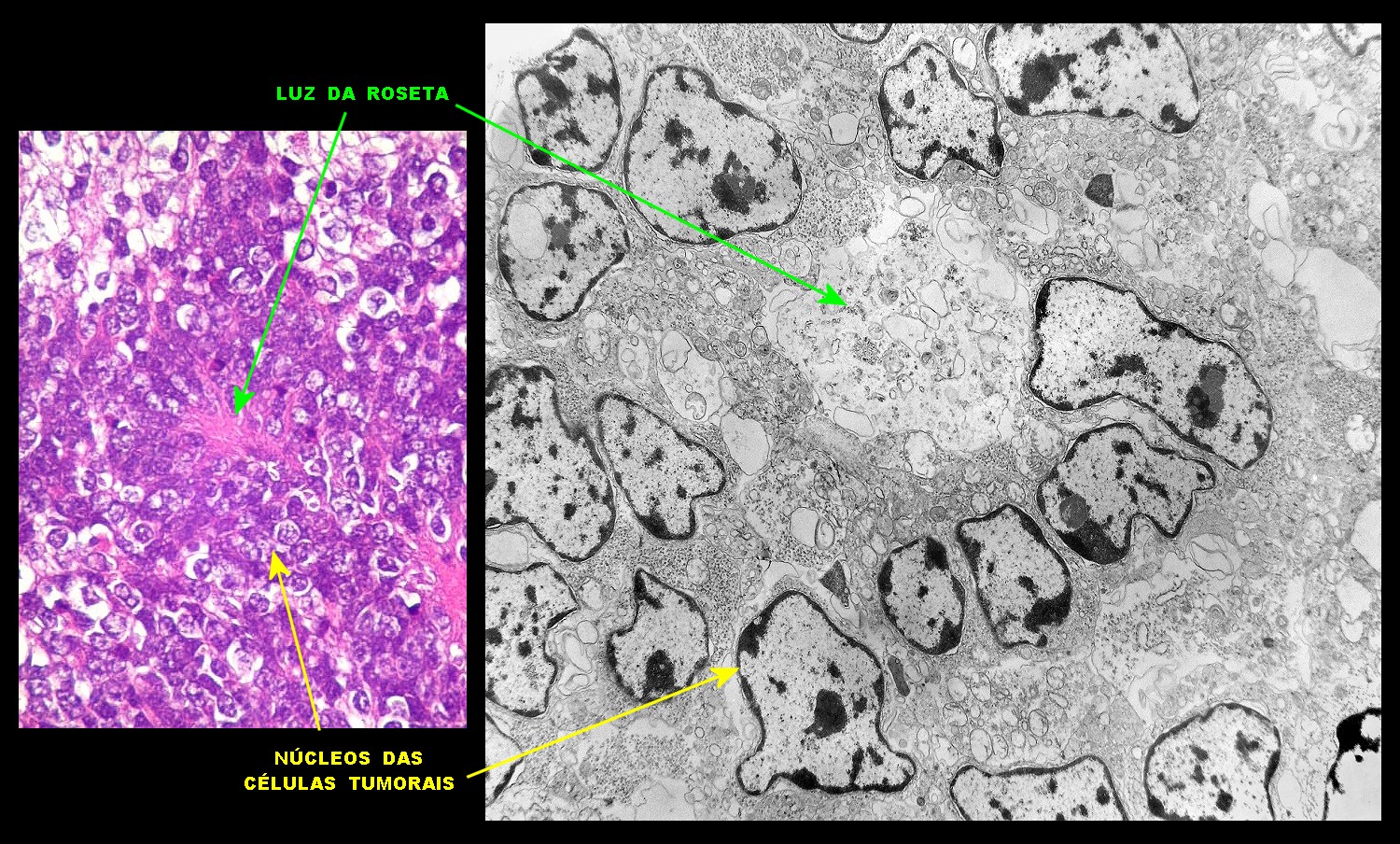 |
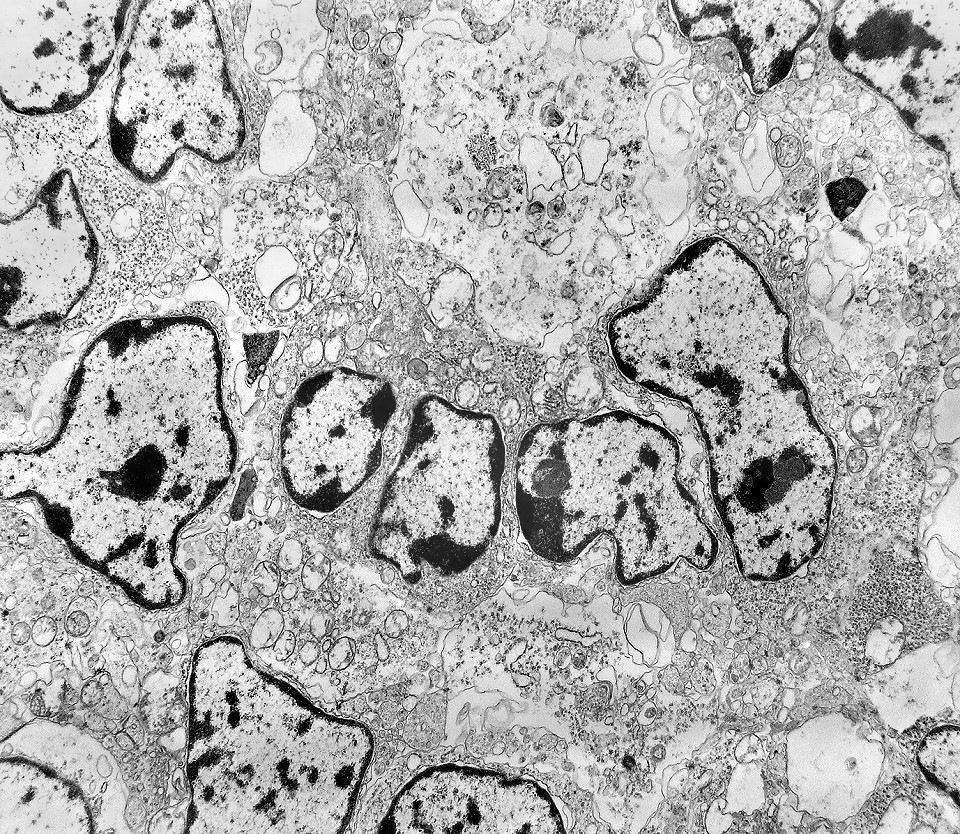 |
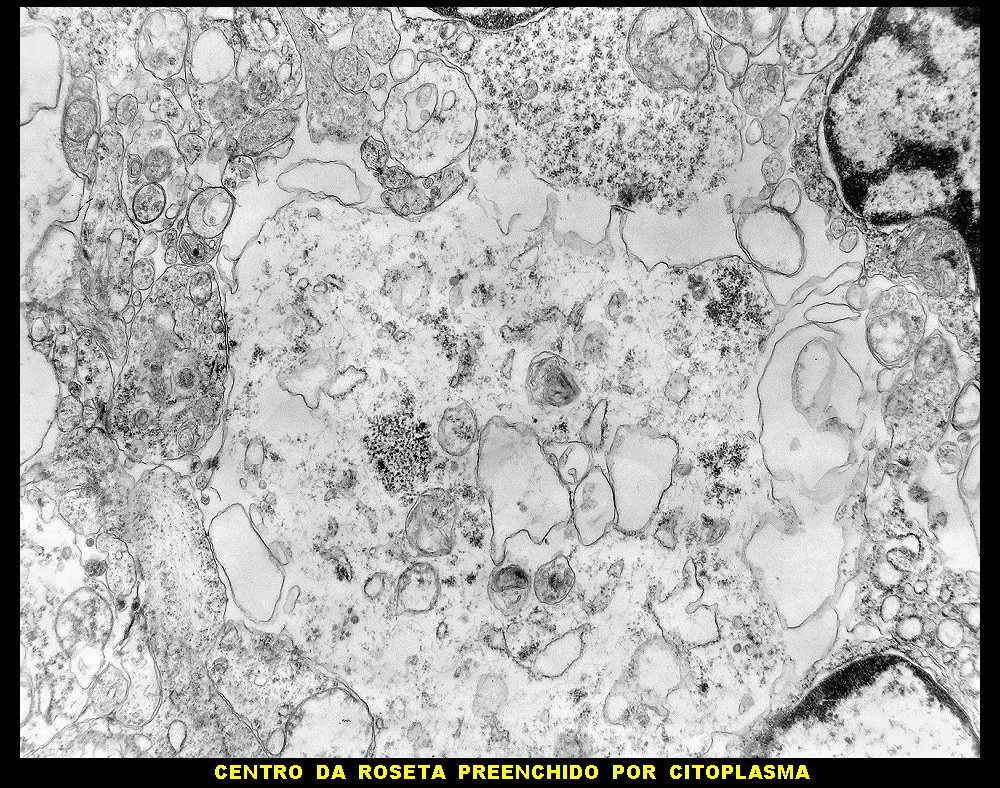 |
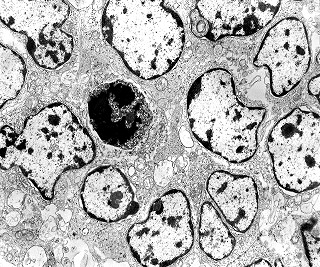
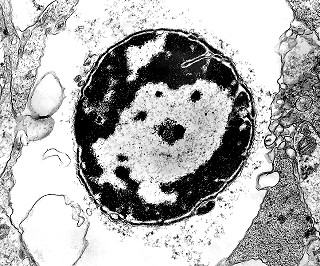
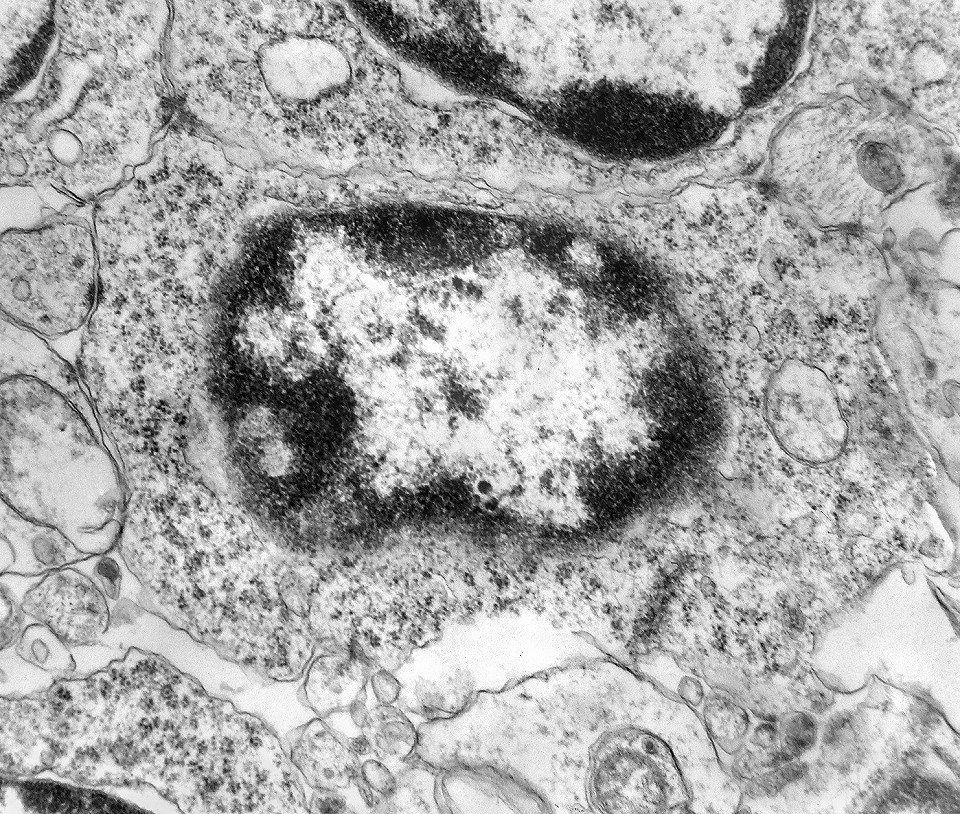
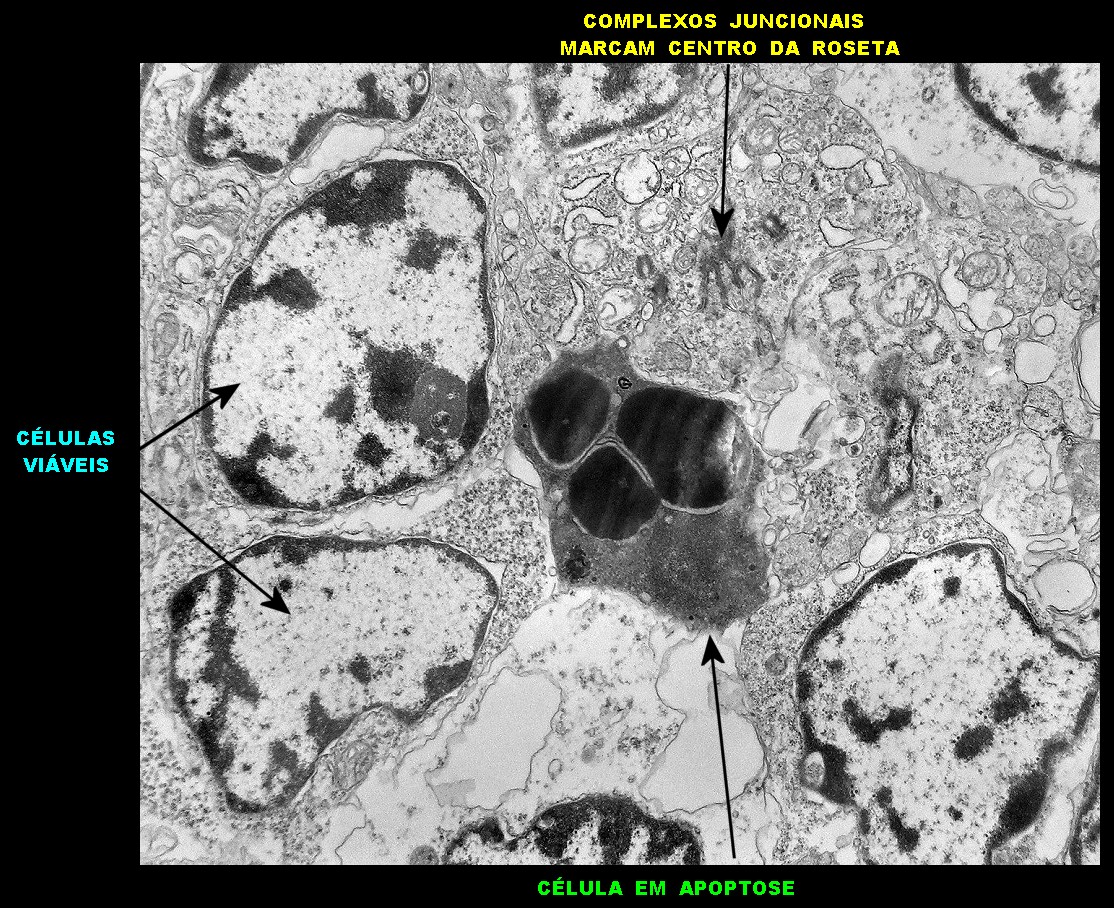
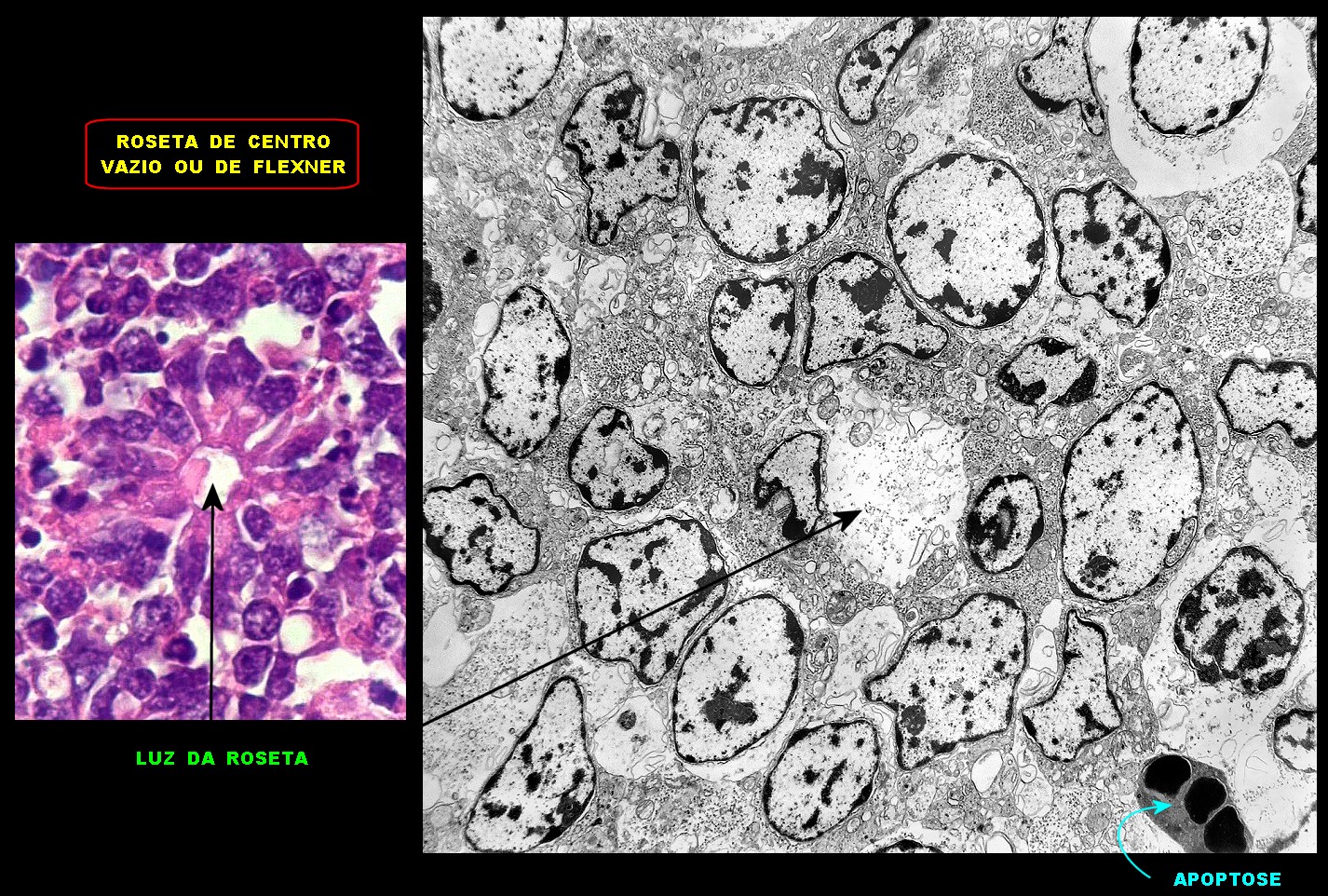
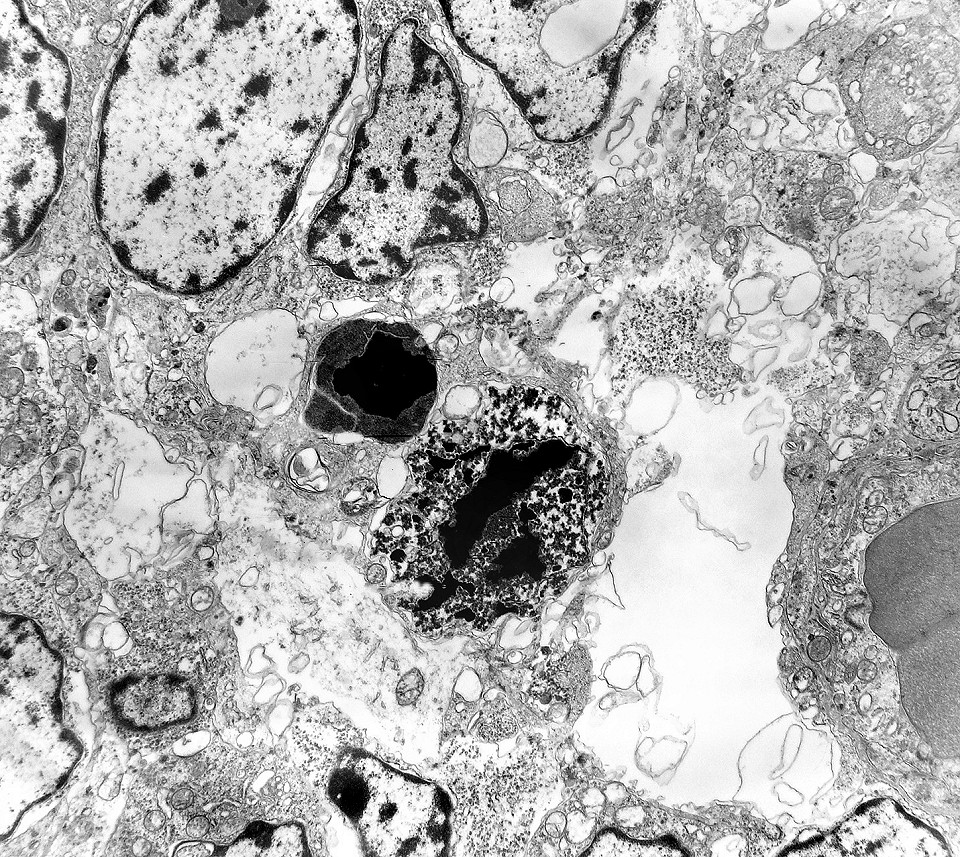
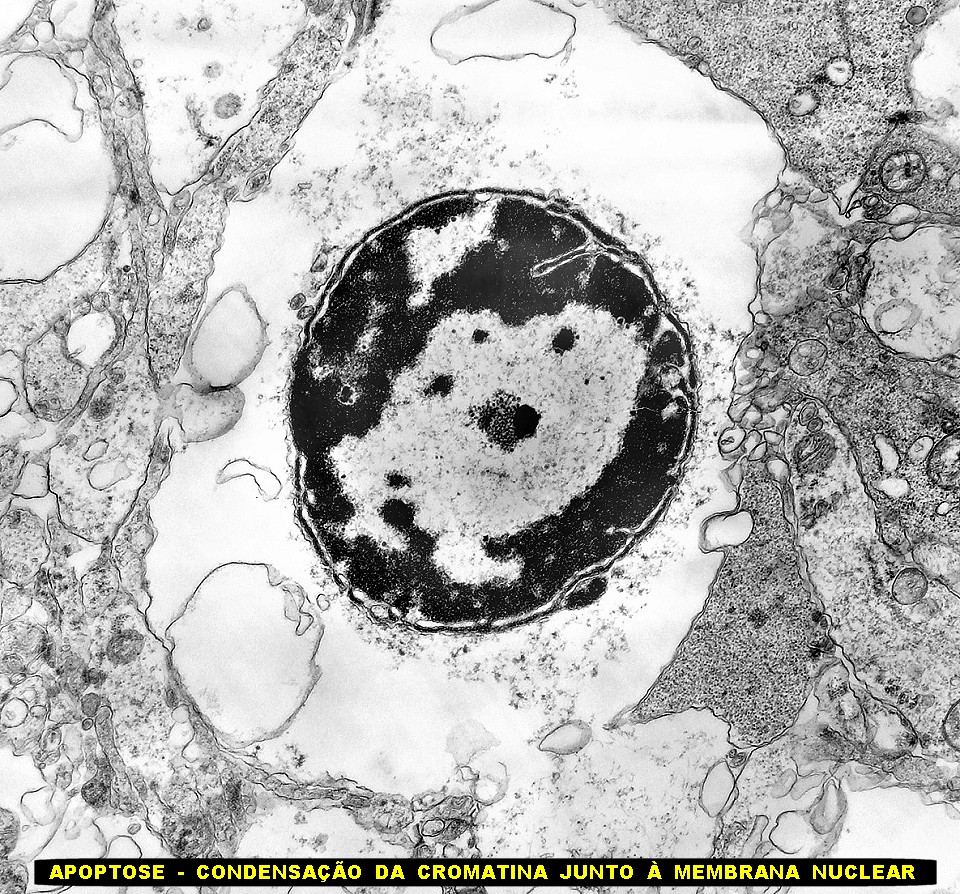
| Roseta com célula em apoptose. A roseta é uma área de ativa proliferação celular, com alta marcação por Ki-67, especialmente nas células próximas ao lúmen, onde é possível encontrar mitoses e apoptose. Abaixo, exemplo de uma roseta de centro preenchido, com uma célula em apoptose. Uma tentativa de correlação com HE é apresentada abaixo. |
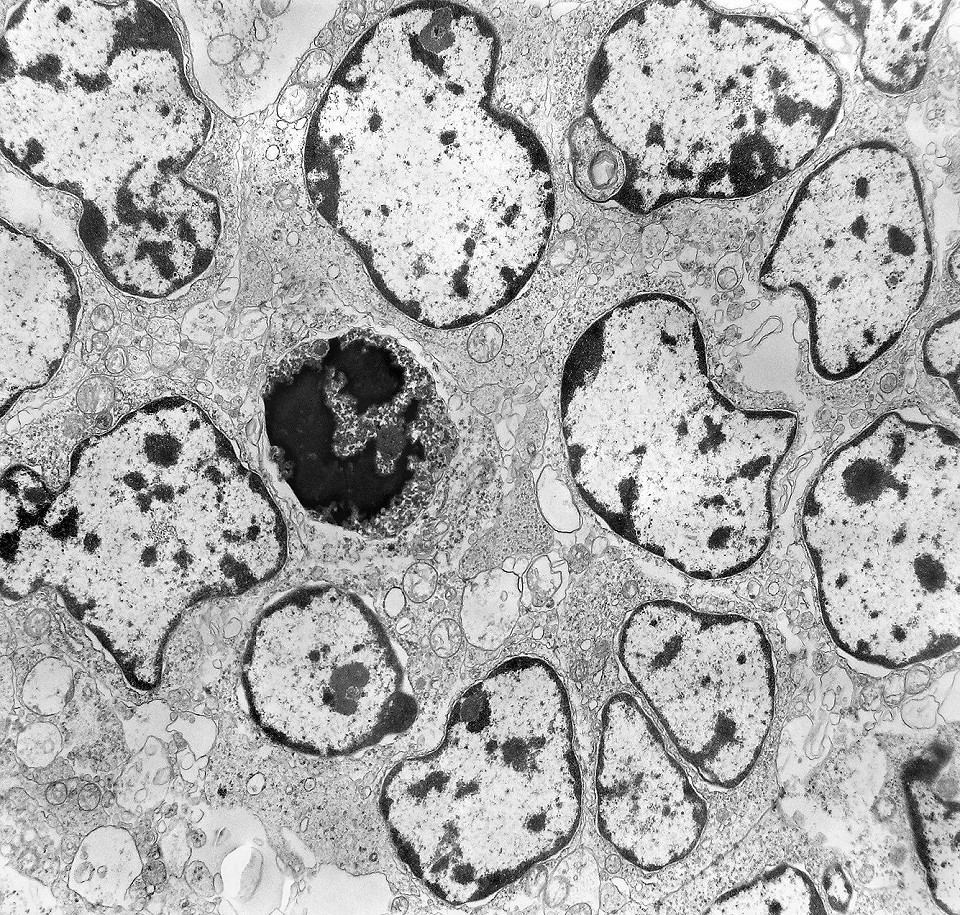 |
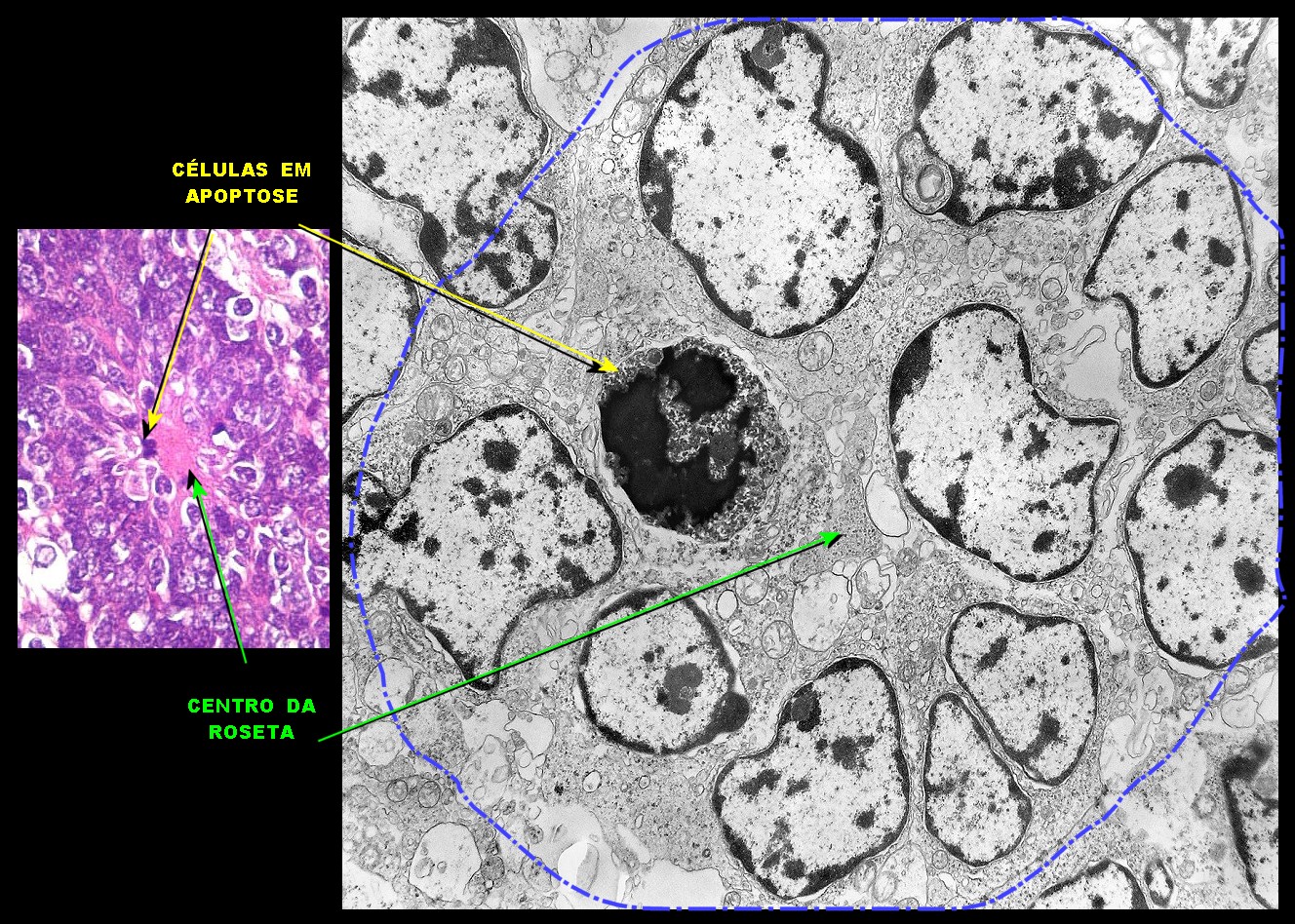 |
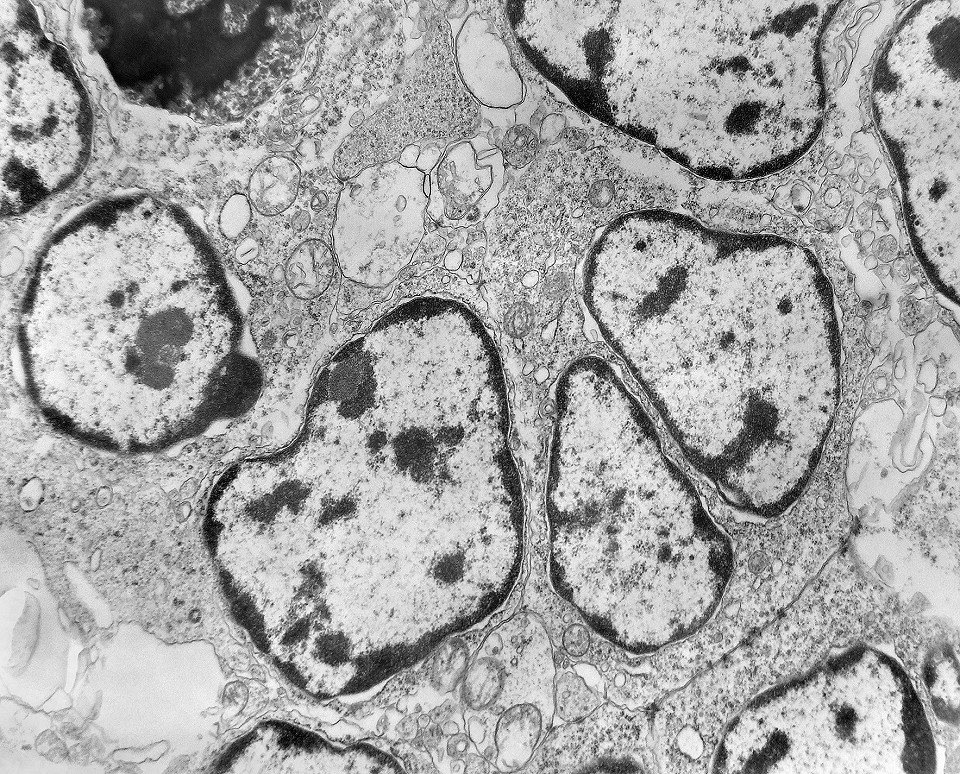 |
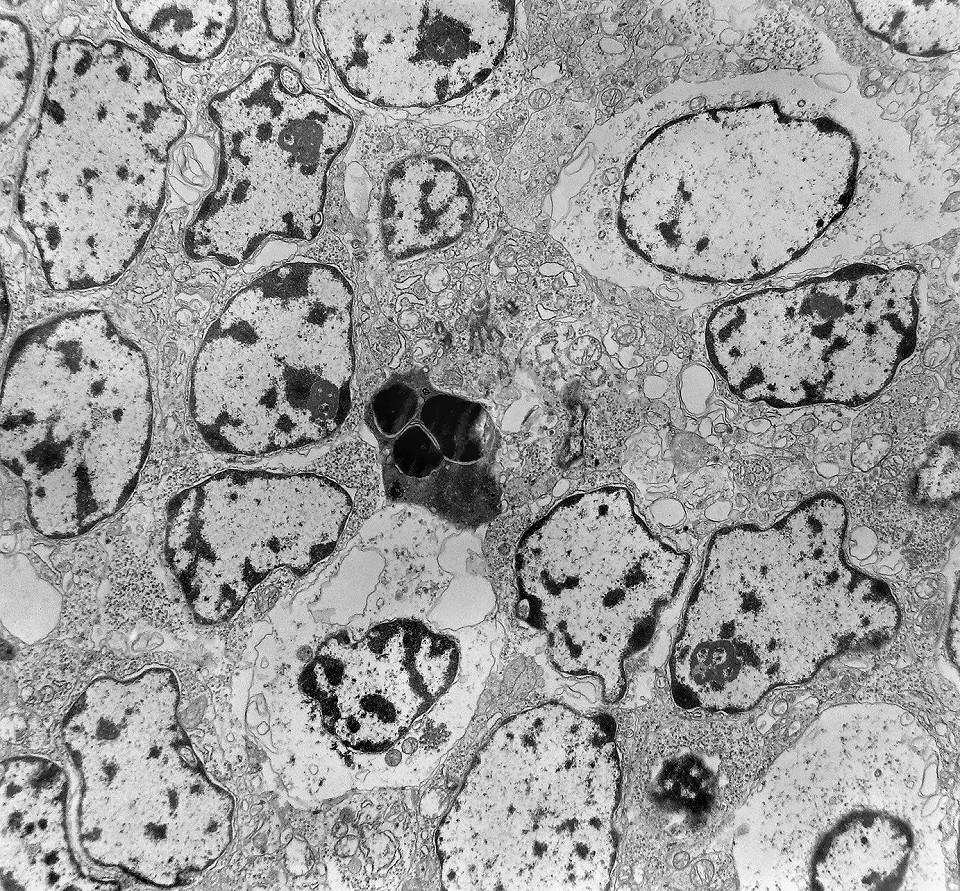
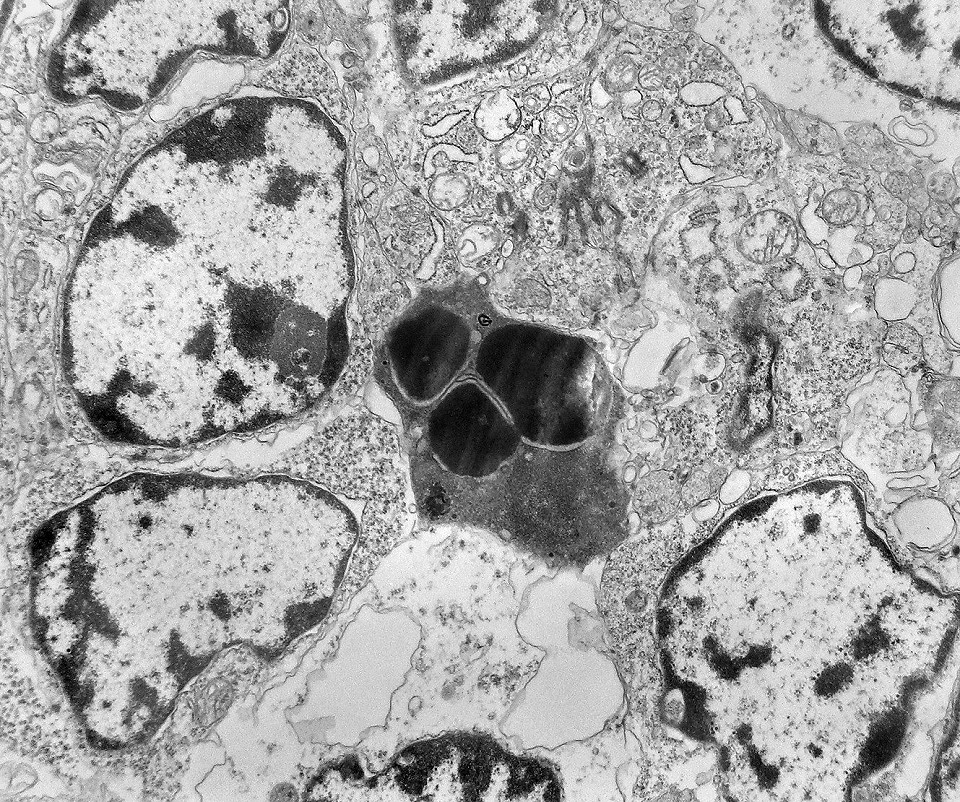
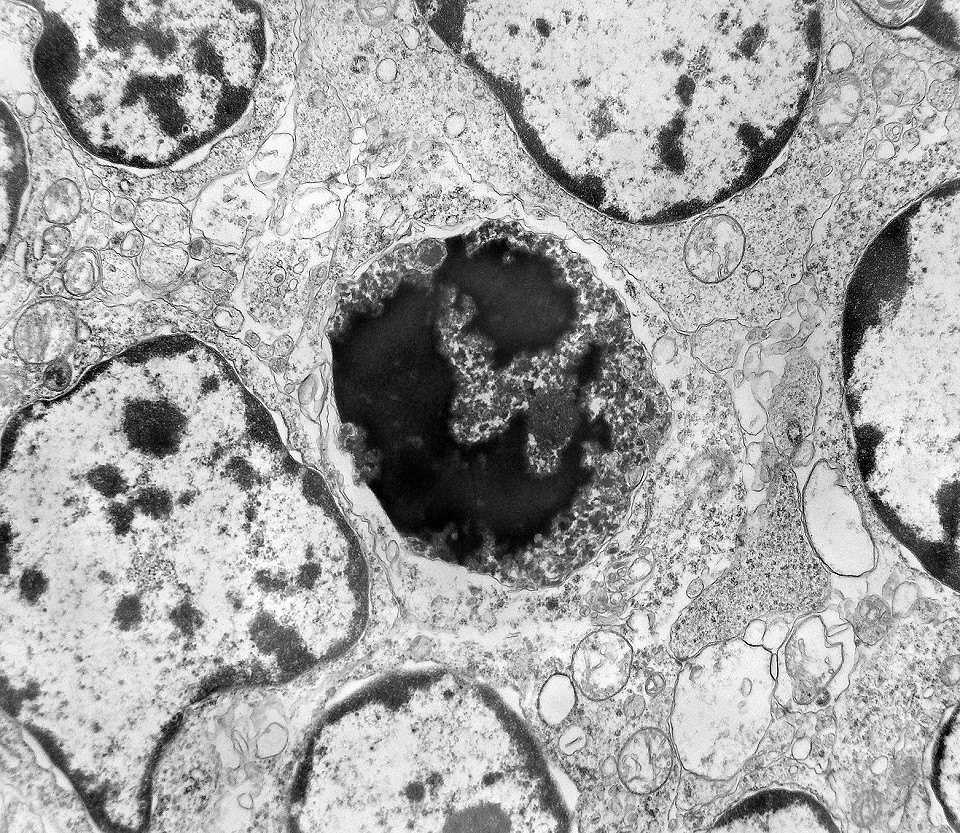
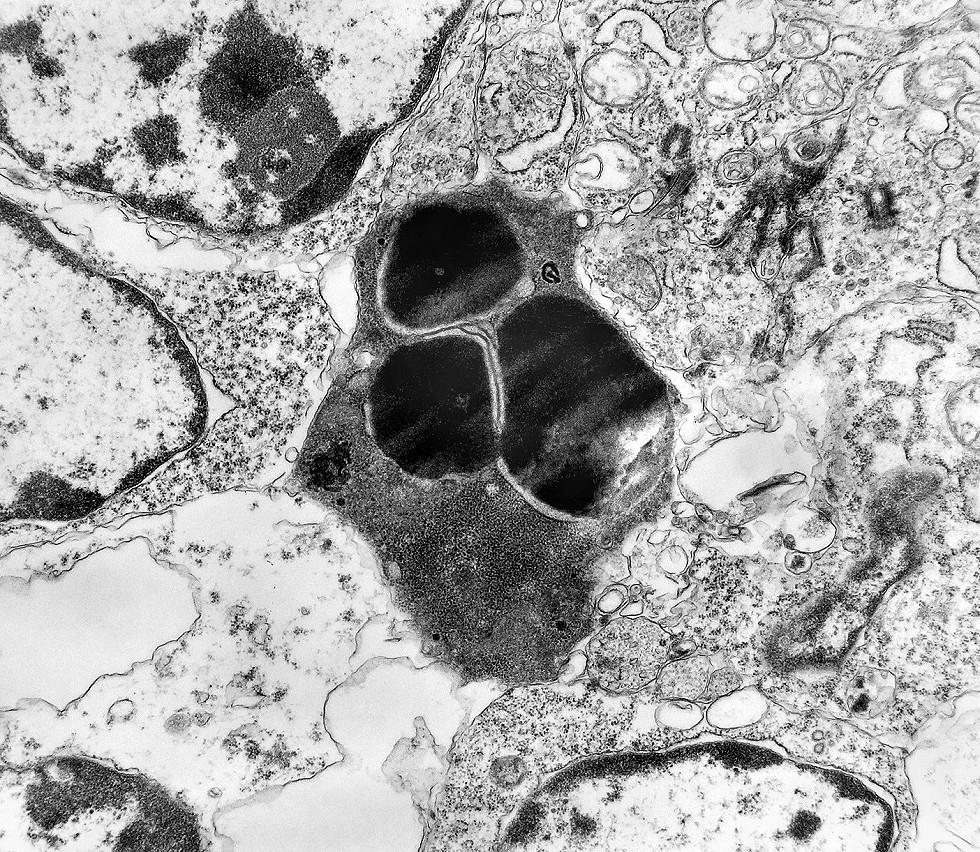
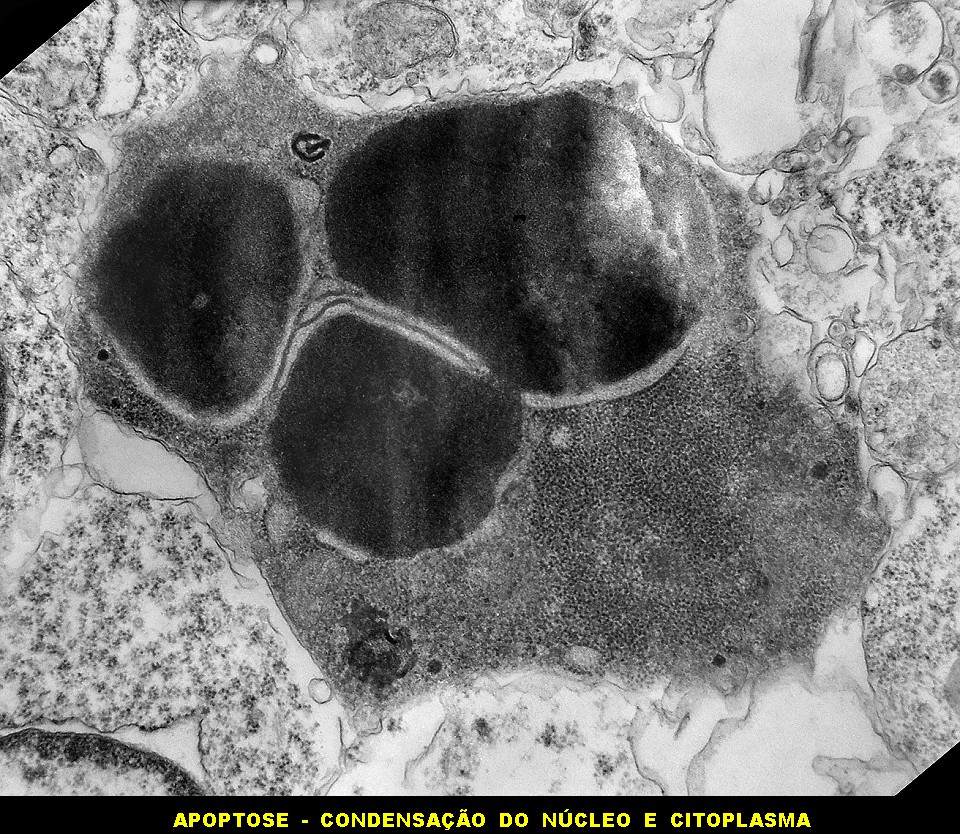
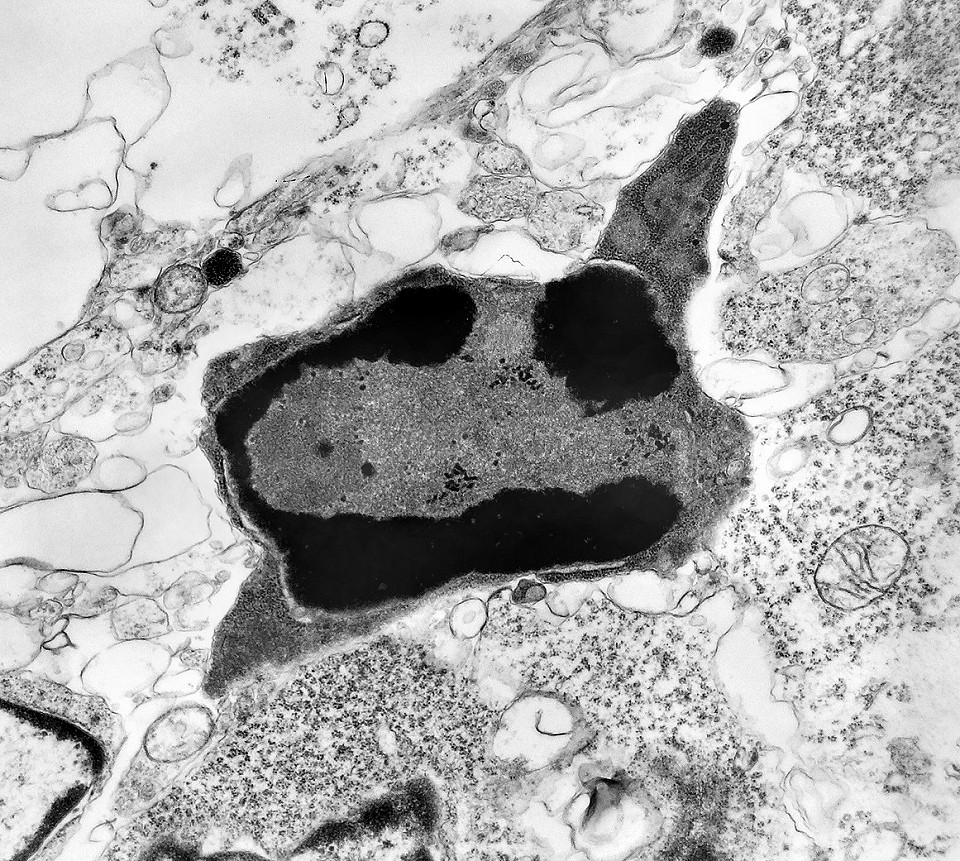
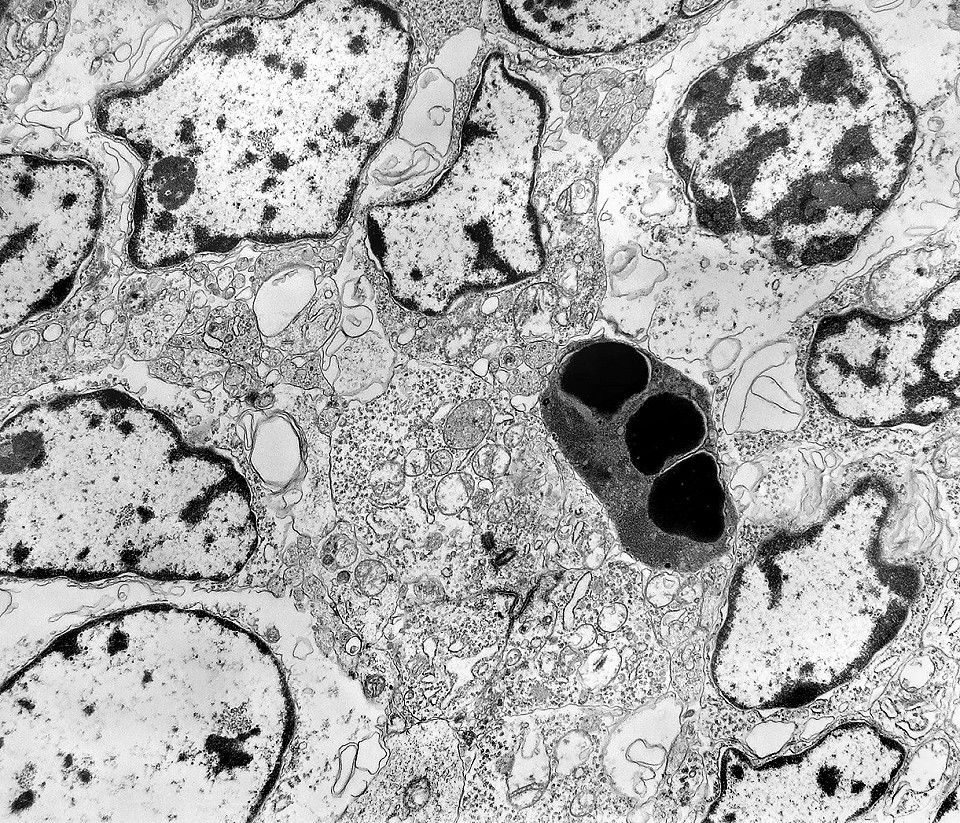
| Outros exemplos de apoptose próximos ao centro da roseta. |
 |
 |
 |
 |
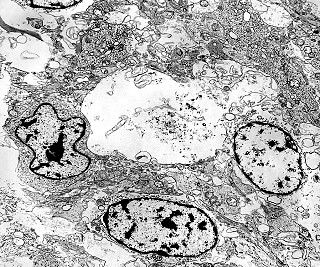
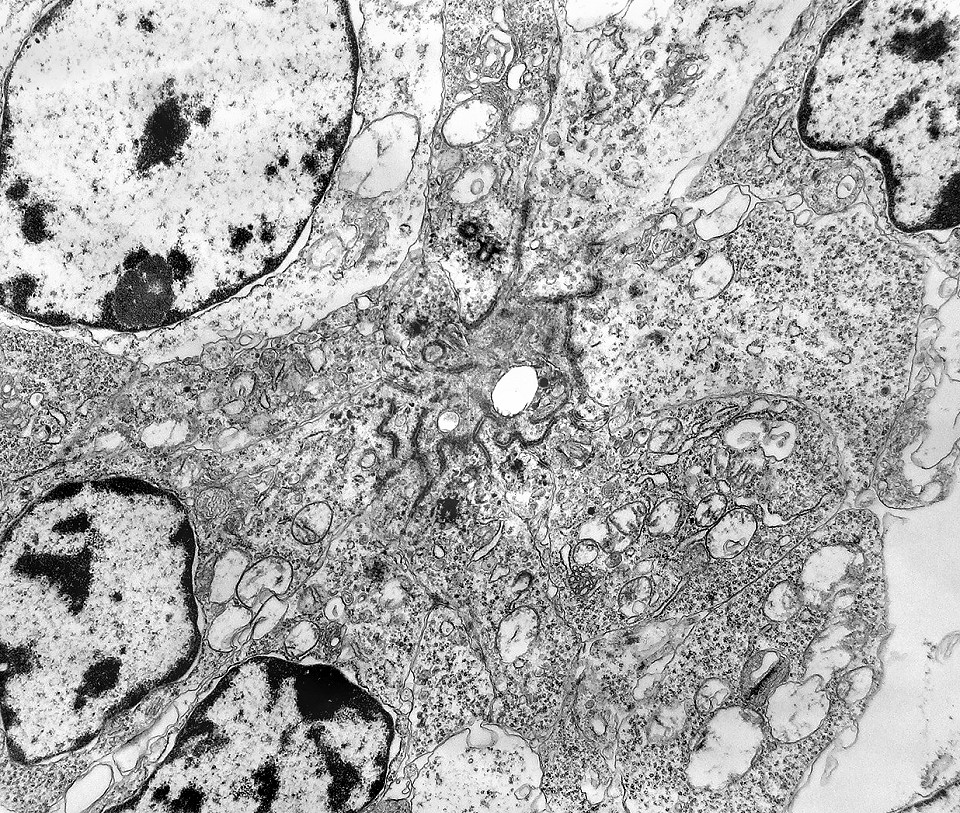
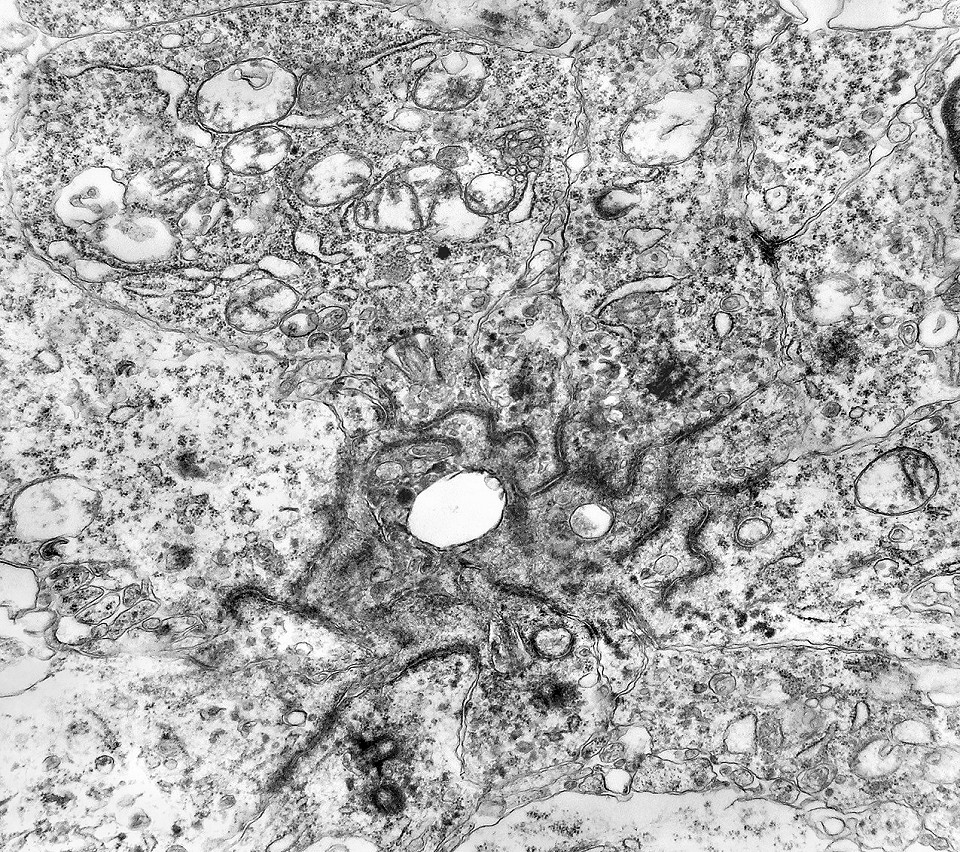
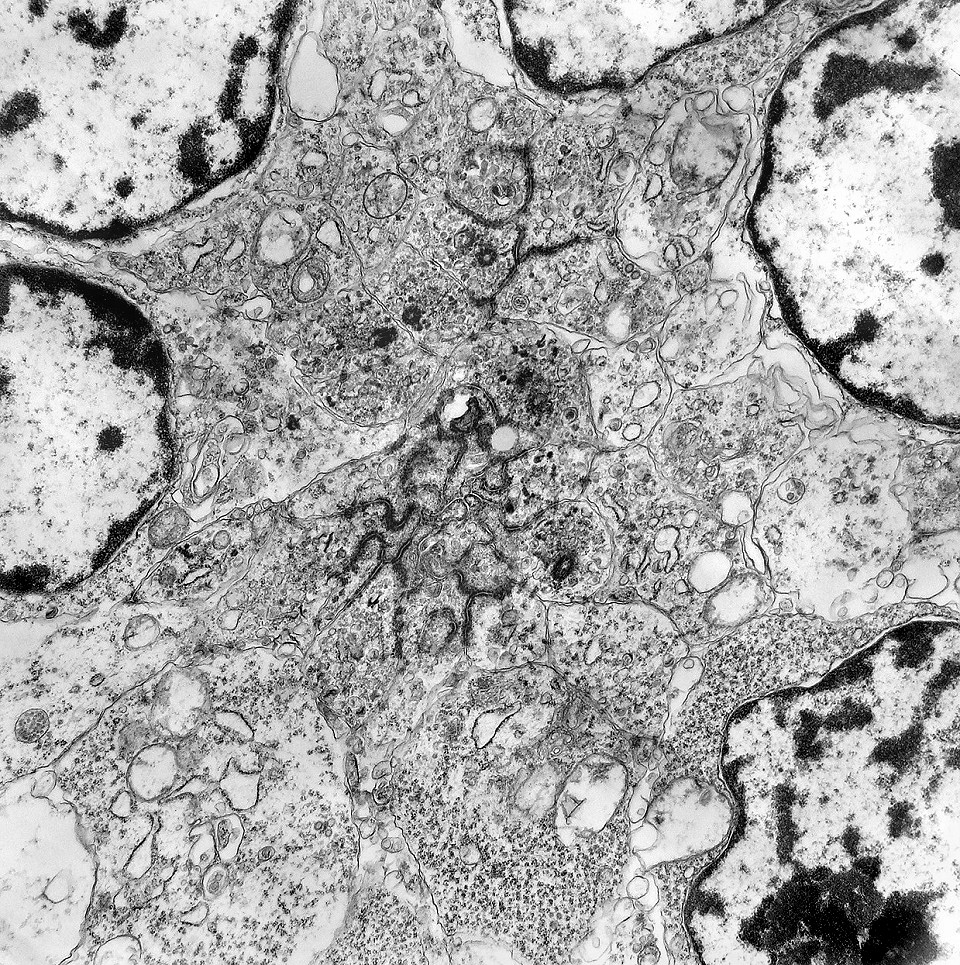
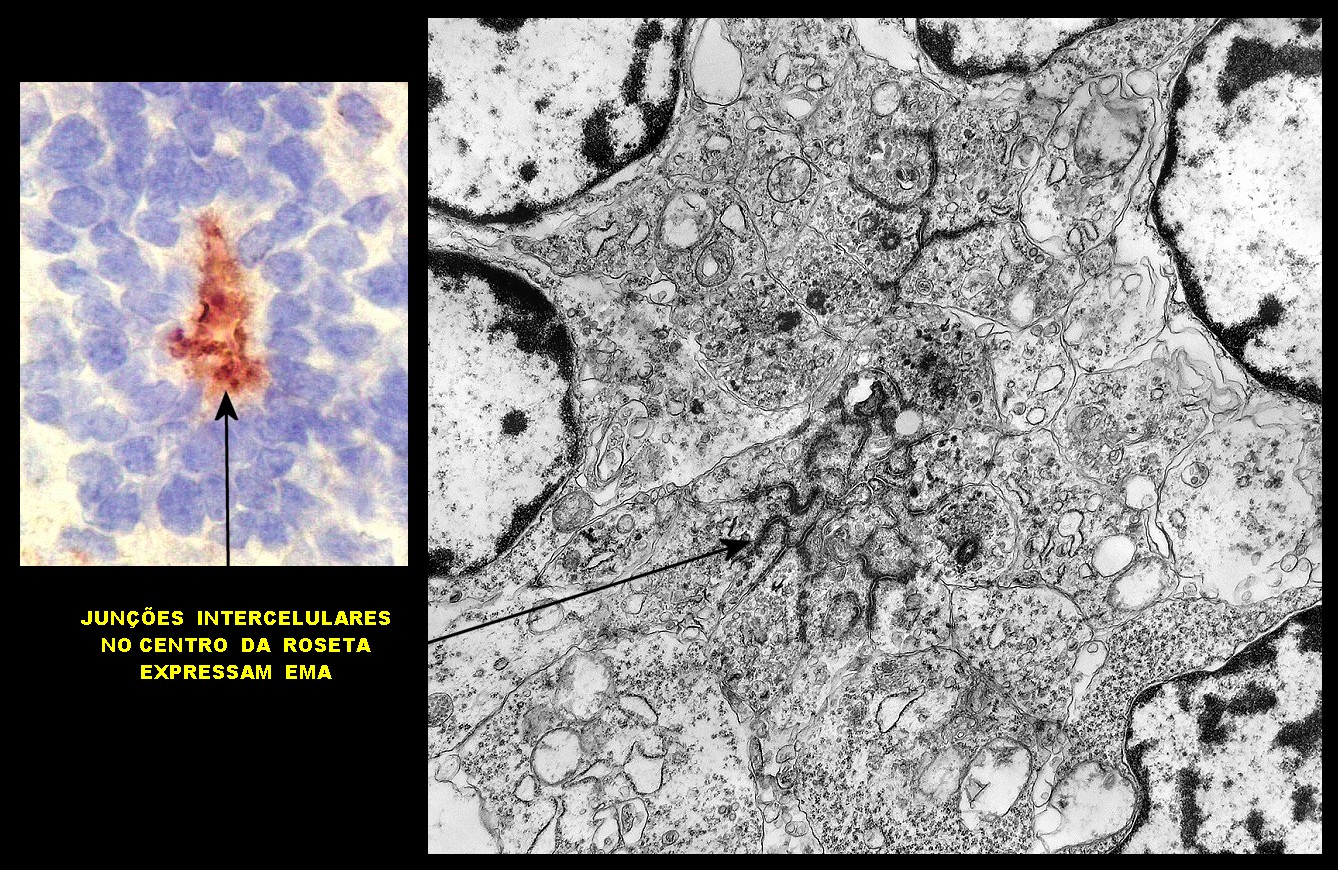
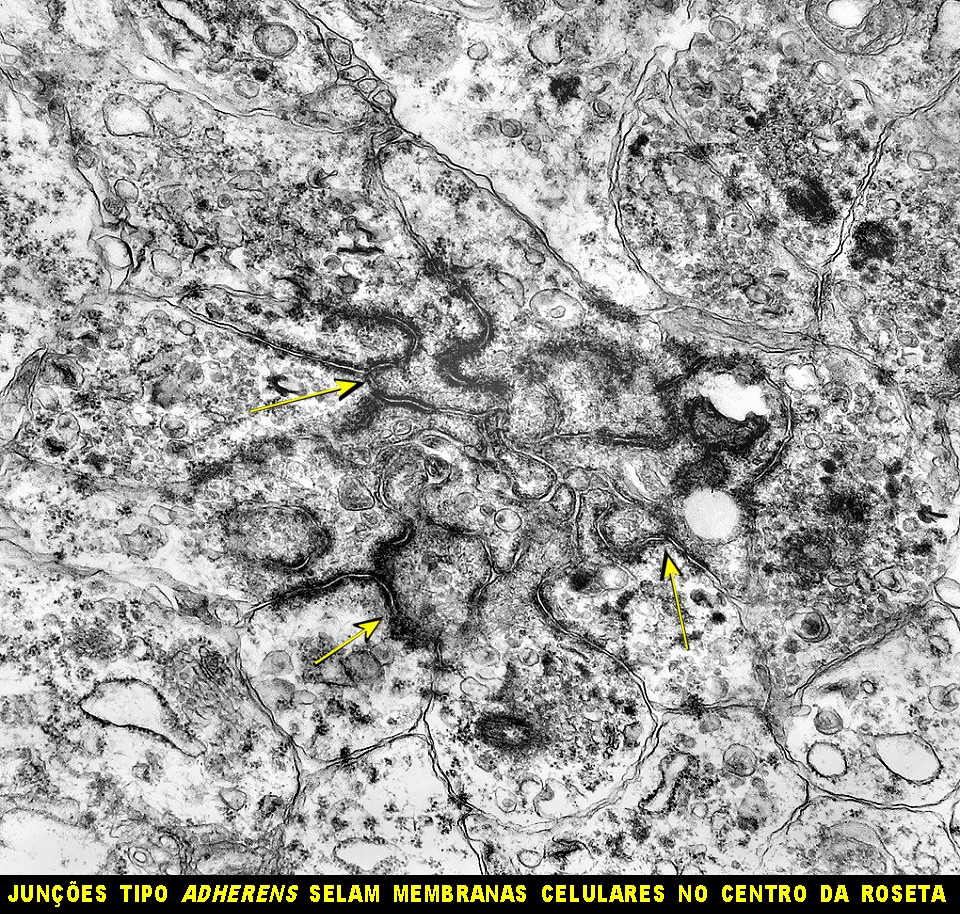
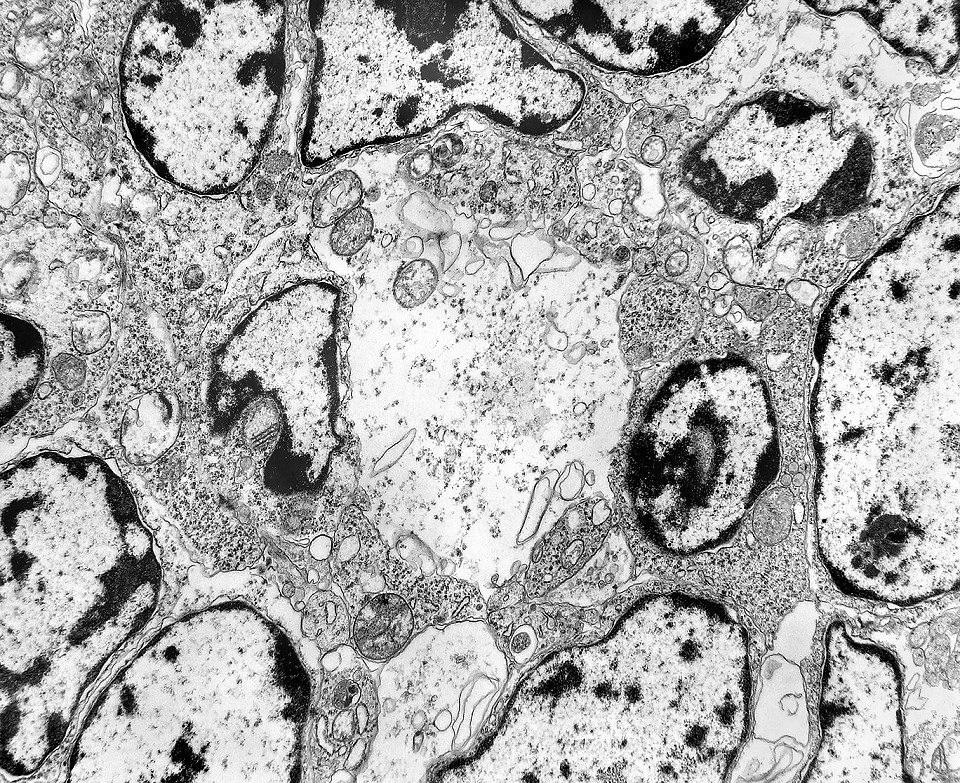
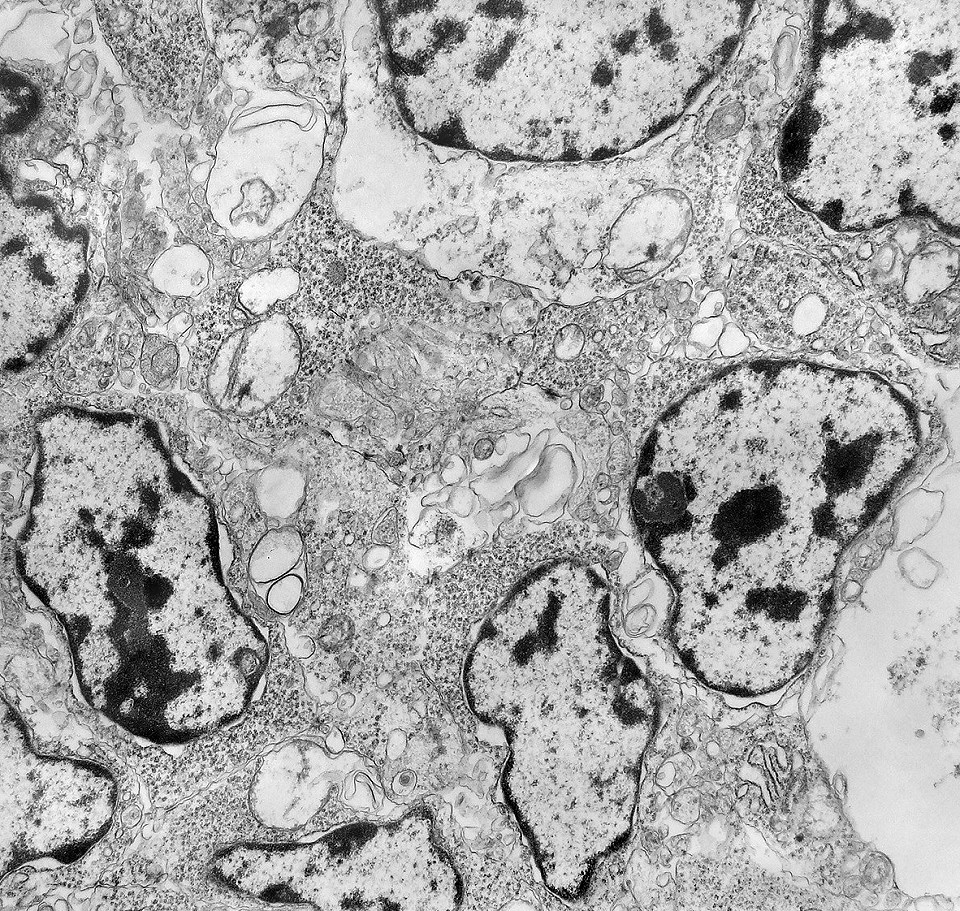
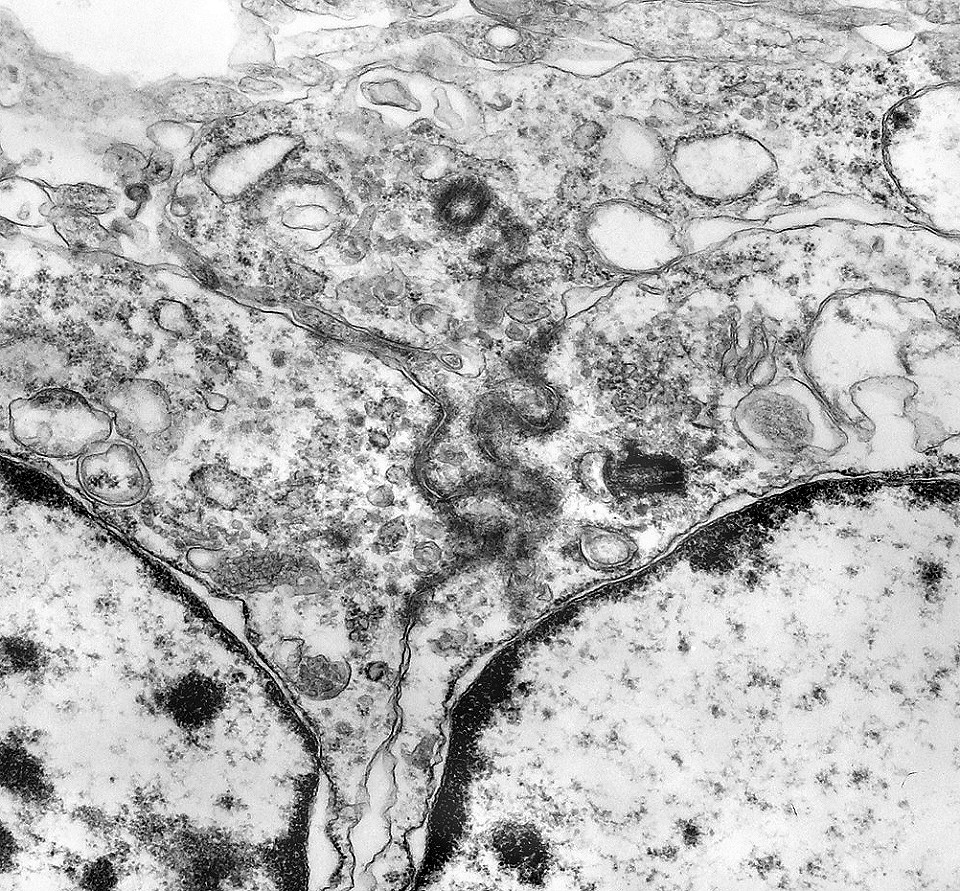
| Roseta de centro preenchido com junções entre os ápices celulares. No centro de rosetas de centro preenchido, as membranas celulares de células vizinhas são seladas por junções do tipo adherens, que aparecem como duplas linhas eletrodensas. As estruturas lembram as encontradas em rosetas de ependimomas. Ver exemplos (1)(2)(3) e breve texto sobre o assunto. Nestes ápices celulares de rosetas em ependimomas é comum a expressão de EMA (antígeno epitelial de membrana). O mesmo é observado neste tumor primitivo do SNC. |
 |
 |
 |
 |
 |
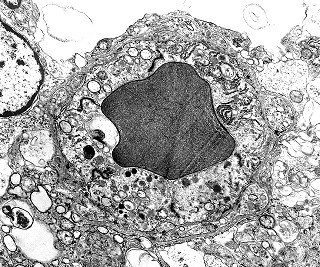
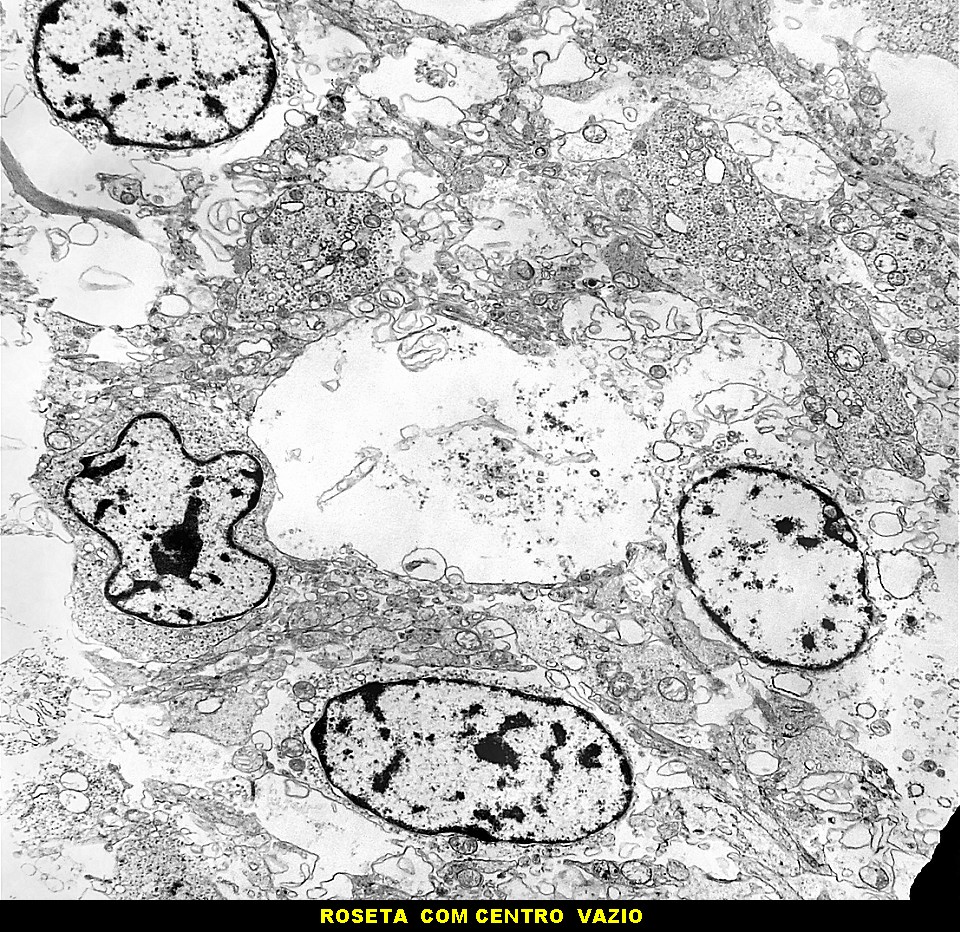
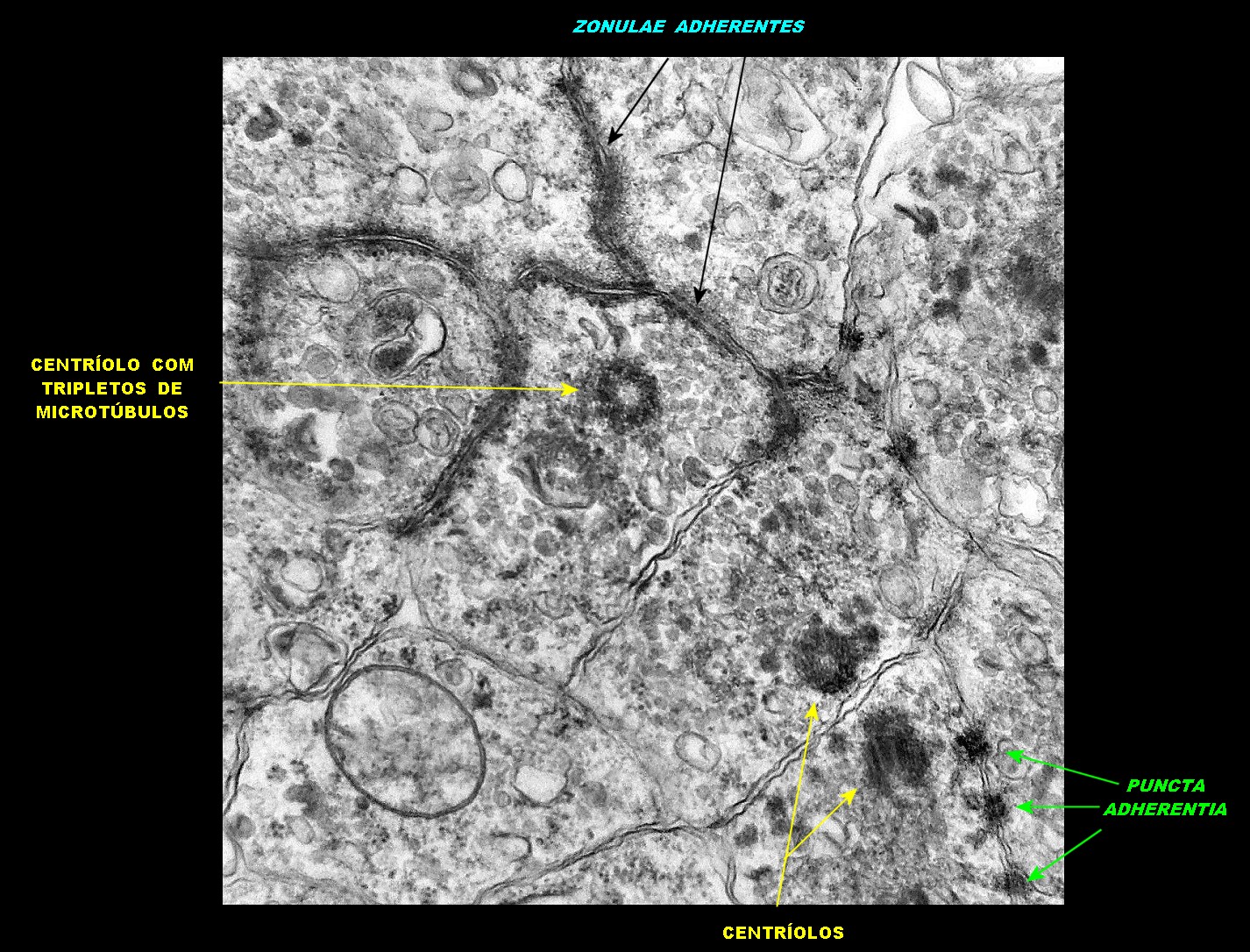
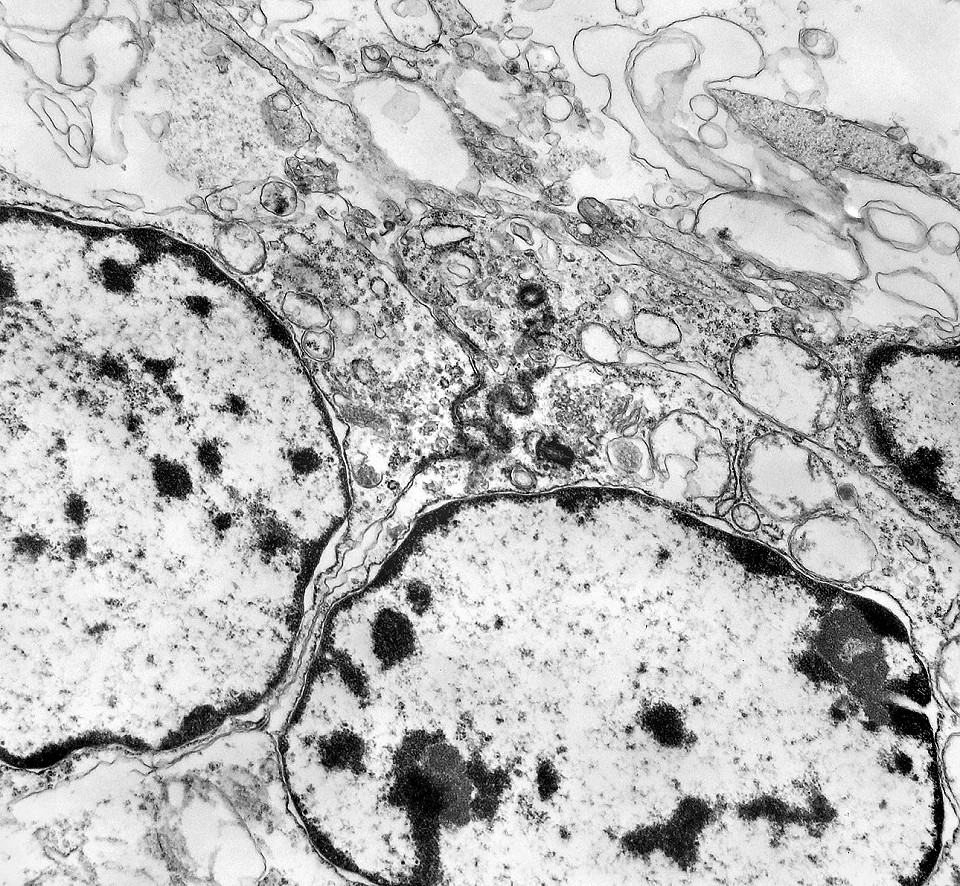
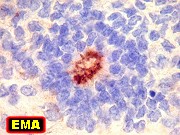
| Rosetas de centro vazio. Eram menos freqüentes que as de centro preenchido, com junções intercelulares, demonstradas acima. Apareciam como uma clareira no tecido, circundada por células íntegras. O centro continha debris de membranas ou restos de organelas. Curiosamente, nos 3 exemplos que obtivemos, não encontramos junções tipo adherens espessas e eletrodensas como nas de centro preenchido. Ou não vimos junções ou havia apenas junções pequenas, puntiformes (puncta adherentia). Ver exemplos neste caso em HE, EMA. |
 |
 |
 |
 |
 |
 |
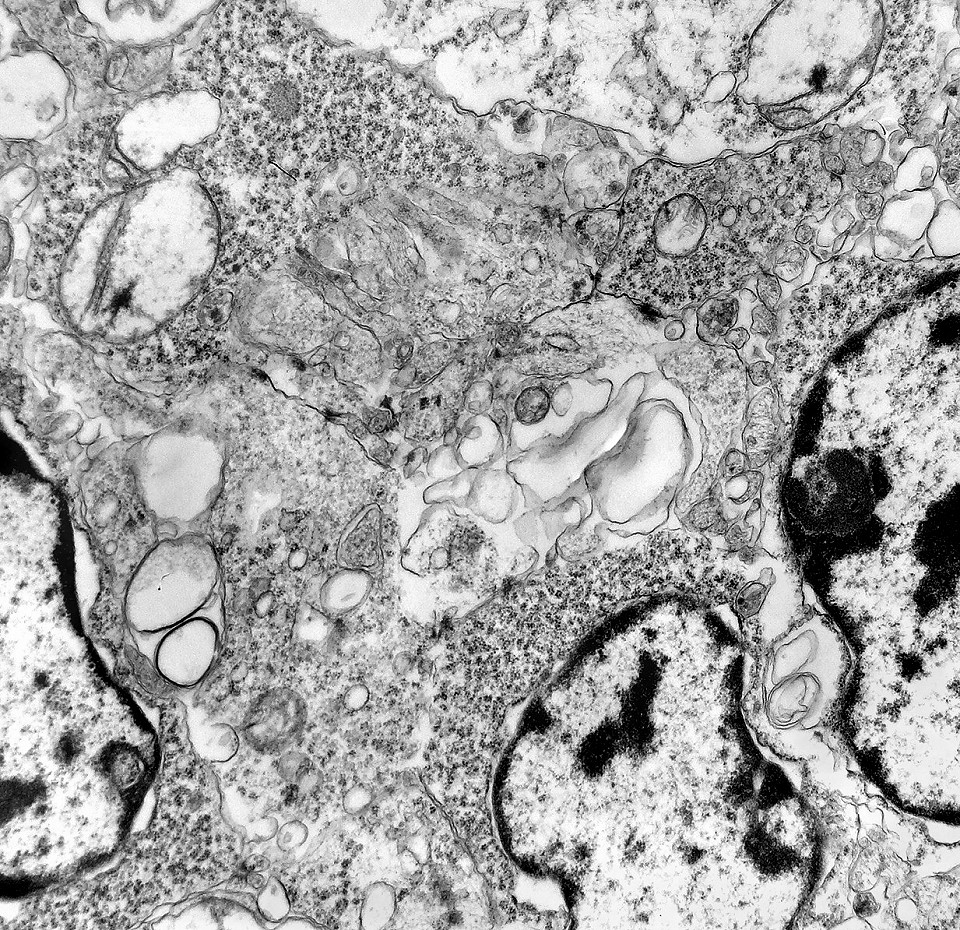 |
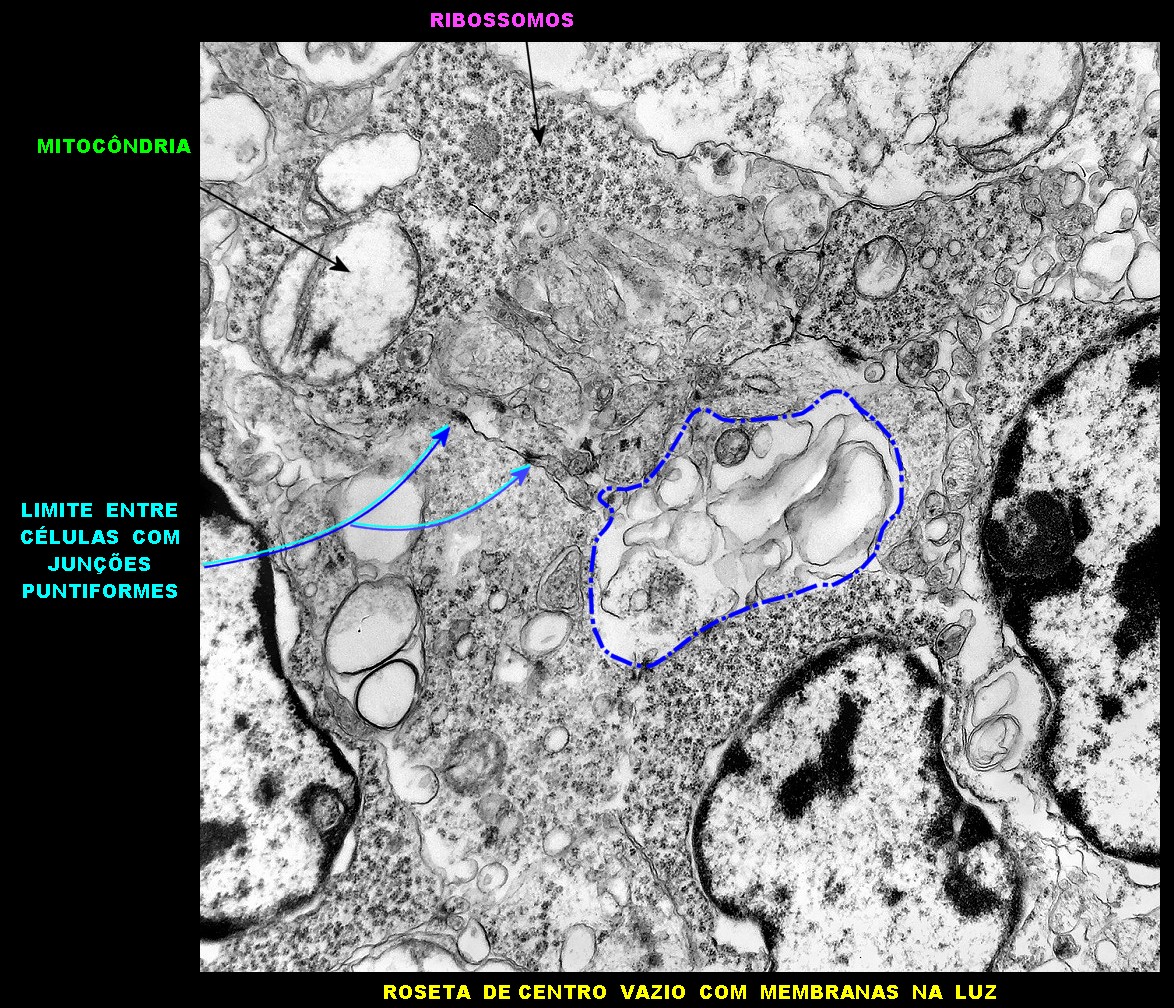 |
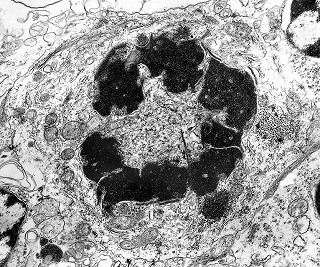
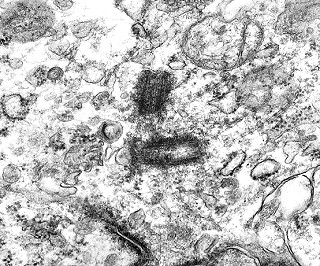
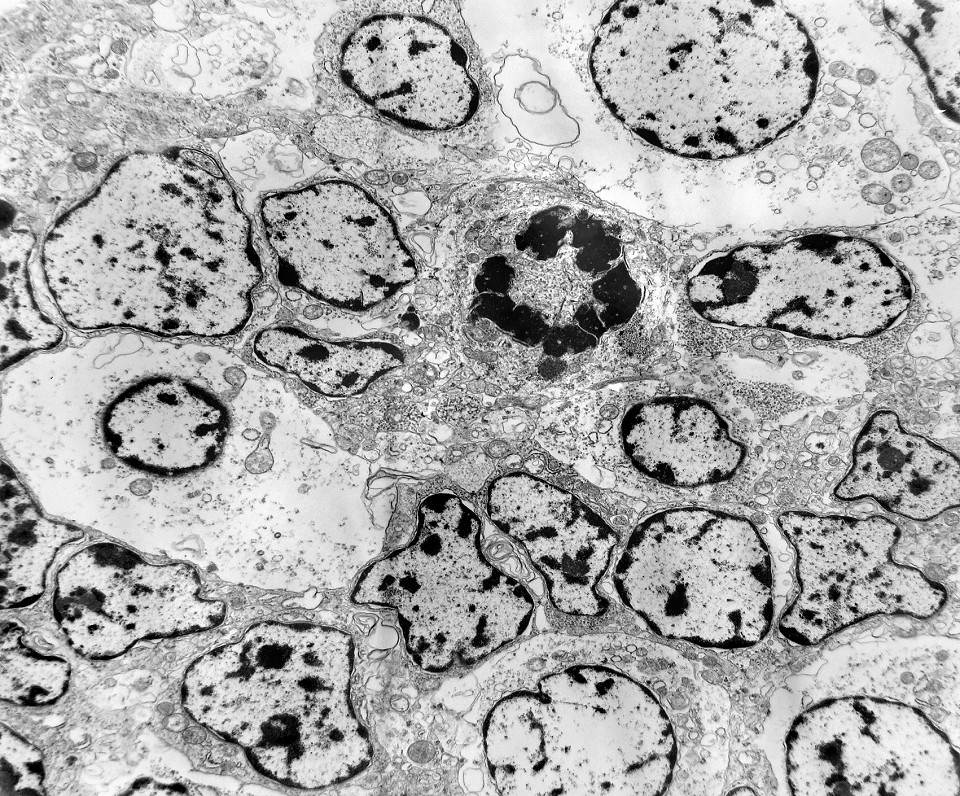
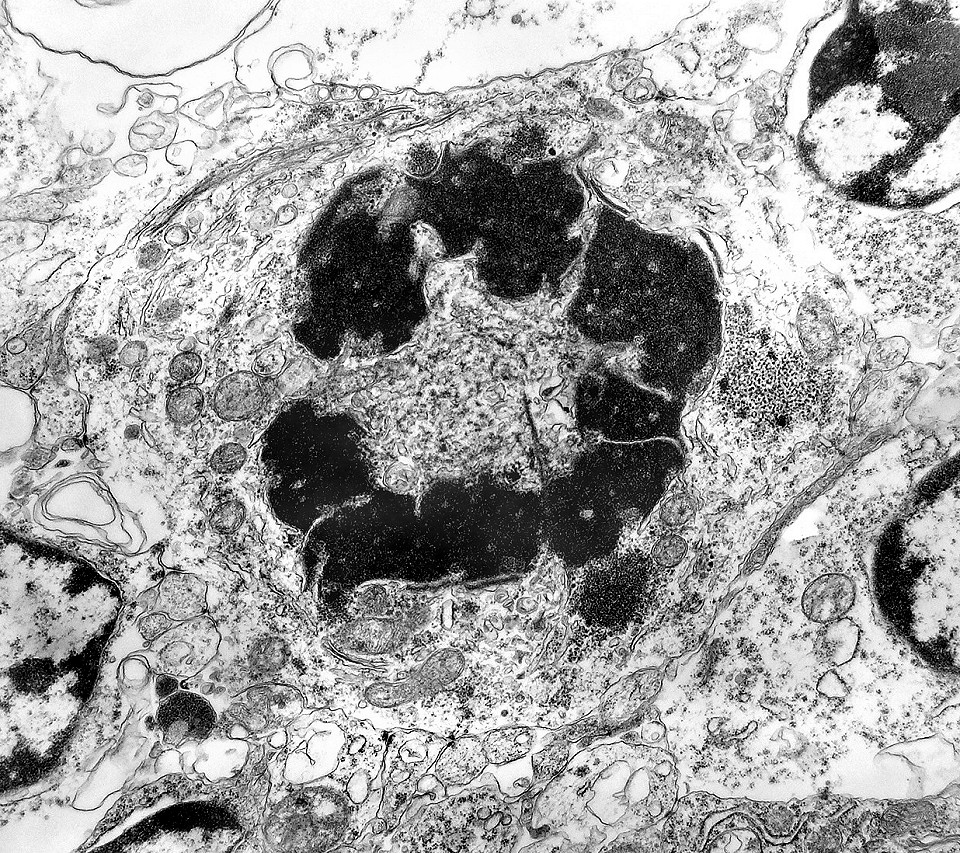
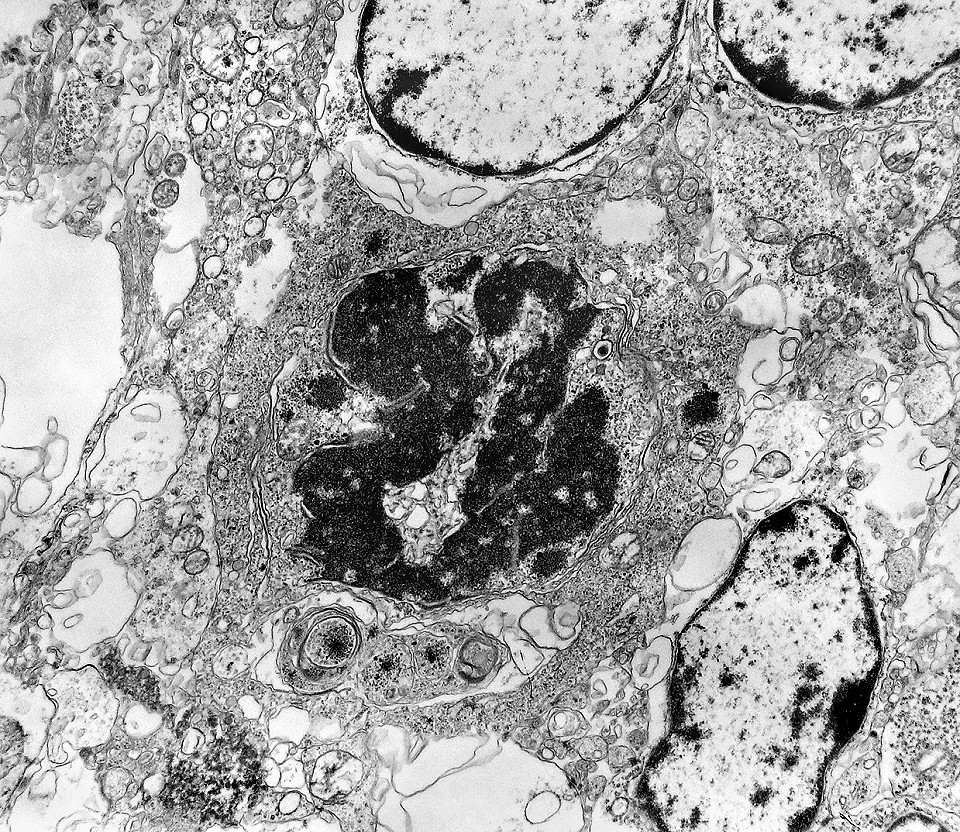
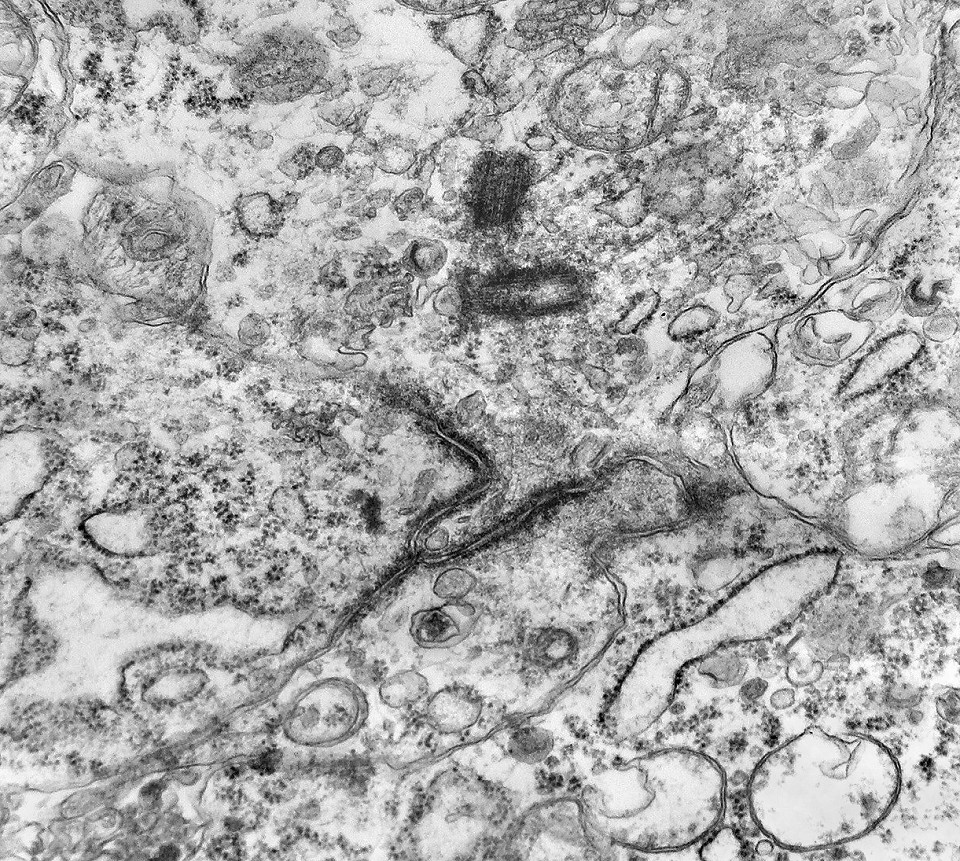
| Mitoses. Embora freqüentes em microscopia óptica, mitoses são difíceis de encontrar em microscopia eletrônica devido às limitações da técnica, que implicam em grande restrição na área de tecido que é possível examinar. Mesmo assim, encontramos três mitoses que provavelmente representavam placas metafásicas típicas. Não é possível descartar que alguma das figuras abaixo se trate da mesma mitose em cortes diferentes. Para exemplo de mitose em um tumor aparentado a este (ependimoblastoma), clique. |
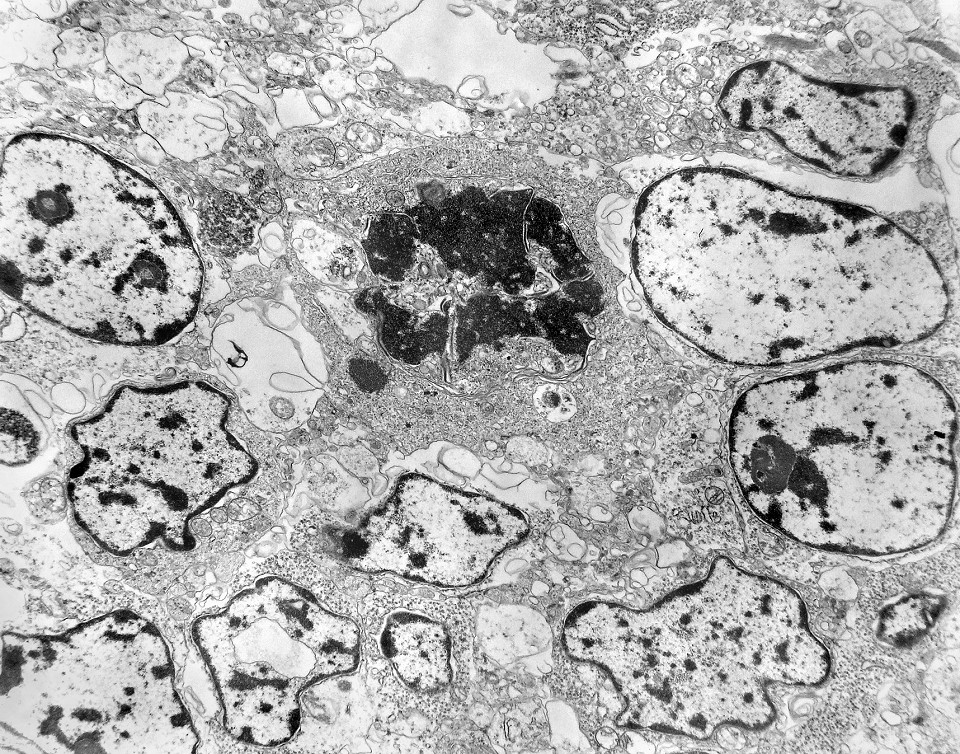 |
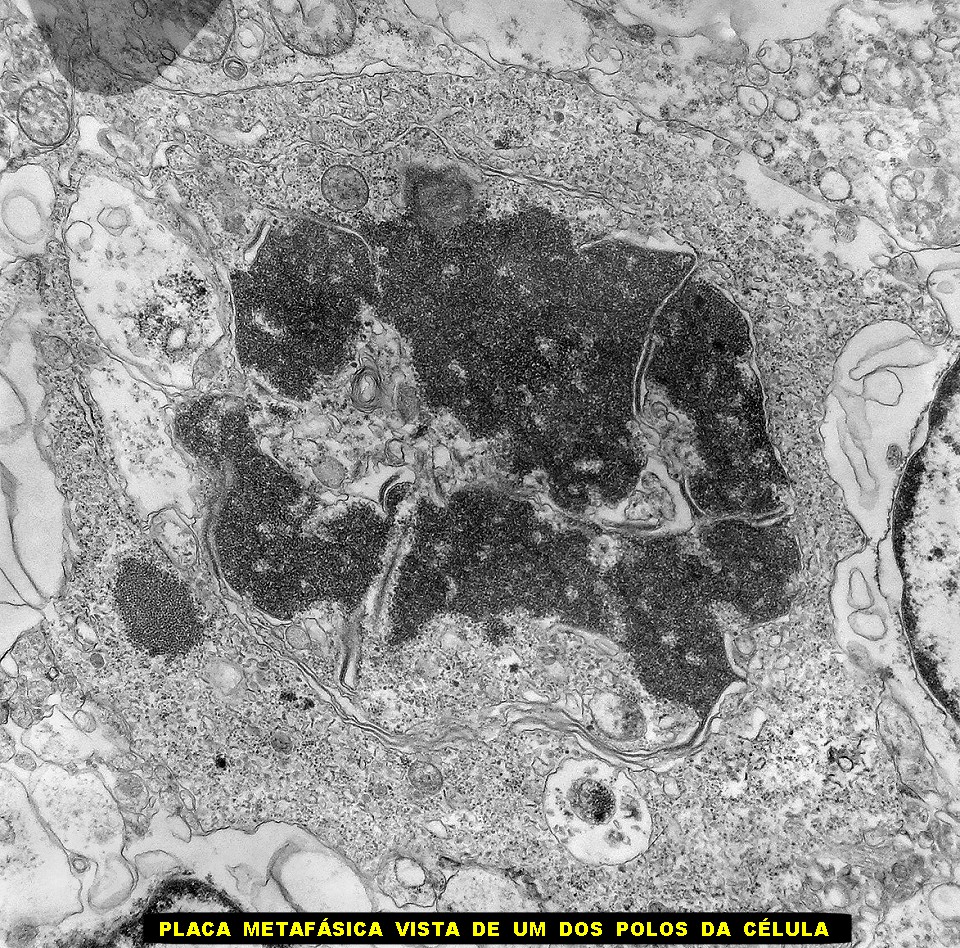 |
 |
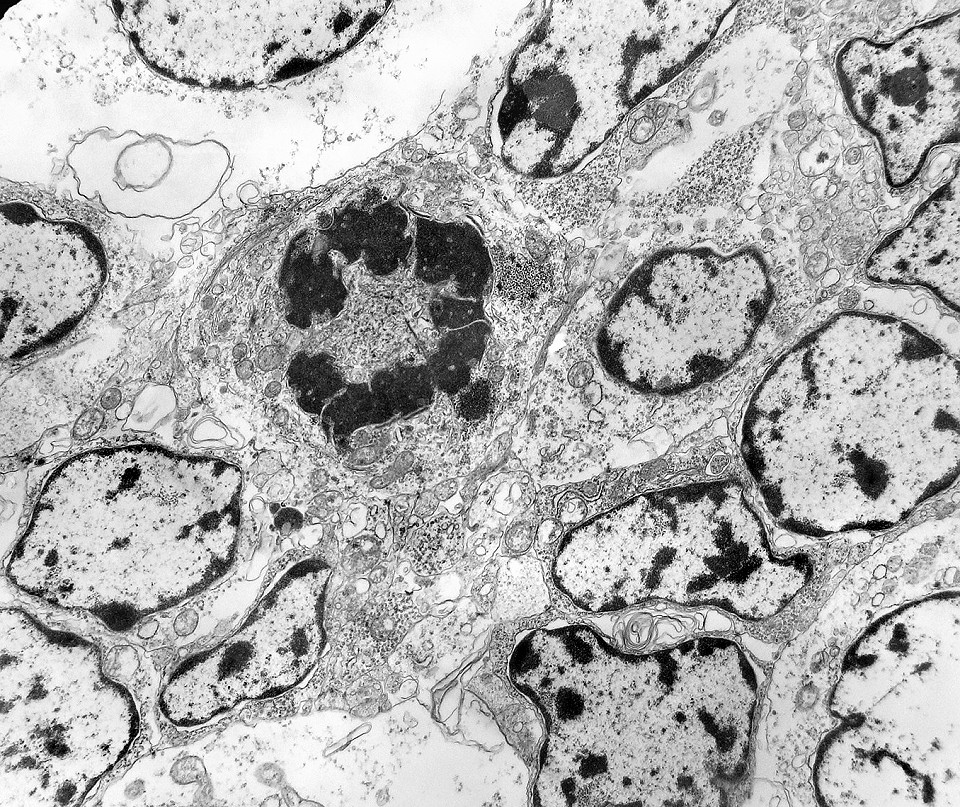 |
| Mitose (placa metafásica). Durante a fase inicial da mitose (prófase) há condensação dos cromossomos e a membrana nuclear (carioteca) se desfaz. Os cromossomos condensados posicionam-se no plano equatorial da célula (metáfase) formando a placa metafásica. Na fase seguinte (anáfase), os cromossomos são tracionados para os polos da célula por feixes de microtúbulos orientados pelos centríolos. Na telófase, há reformação da carioteca em torno dos dois novos núcleos e divisão do citoplasma (citocinese). Aqui observamos uma placa metafásica típica. Para outros exemplos de mitoses em tumores primitivos do sistema nervoso central, clique. |
 |
 |
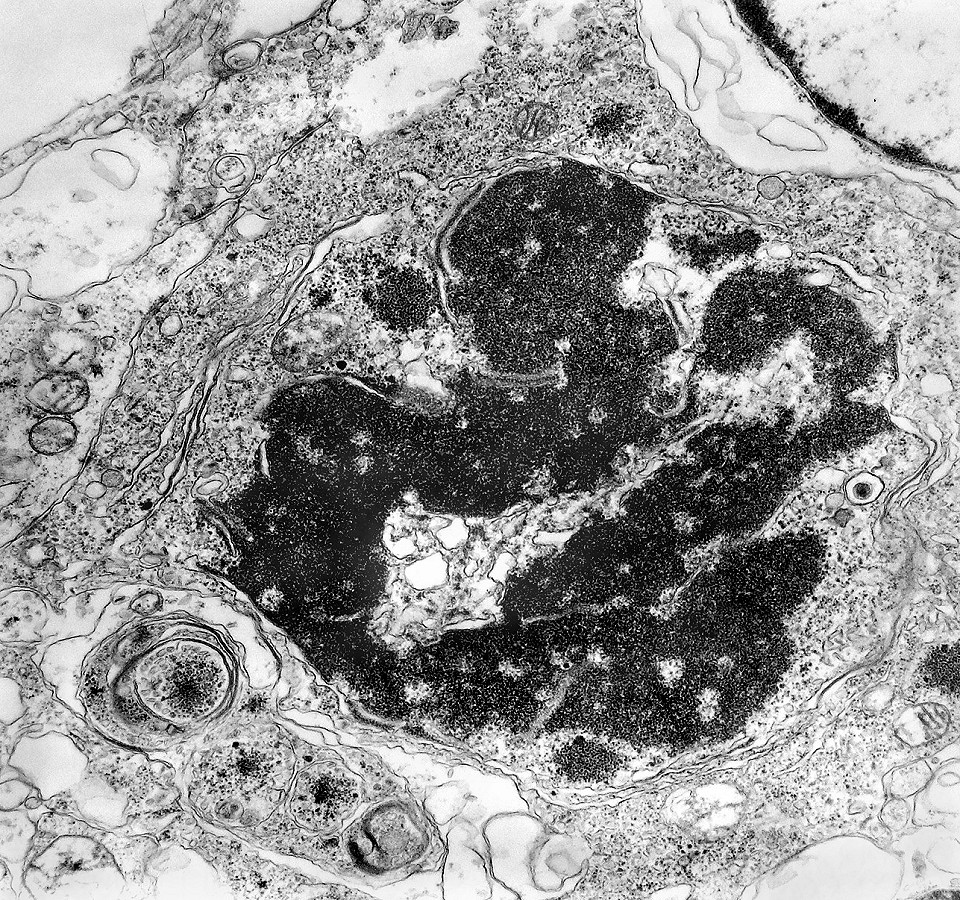 |
| Apoptose. Figuras de apoptose eram muito mais freqüentes que mitoses. Na apoptose, células geneticamente inviáveis desencadeiam sua própria morte acionando uma cascata de enzimas líticas chamadas caspases, que degradam o DNA cortando a cadeia de nucleotídeos entre as histonas. Para mais sobre apoptose, clique. Morfologicamente, há condensação da cromatina em massas eletrodensas que podem situar-se na periferia do núcleo, e perda de estrutura do citoplasma e suas organelas. O corpúsculo apoptótico chama a atenção já em aumento fraco por sua forte eletrodensidade, destacando-se do tecido em volta. Para outros exemplos, clique. |
 |
 |
 |
 |
 |
 |
 |
 |
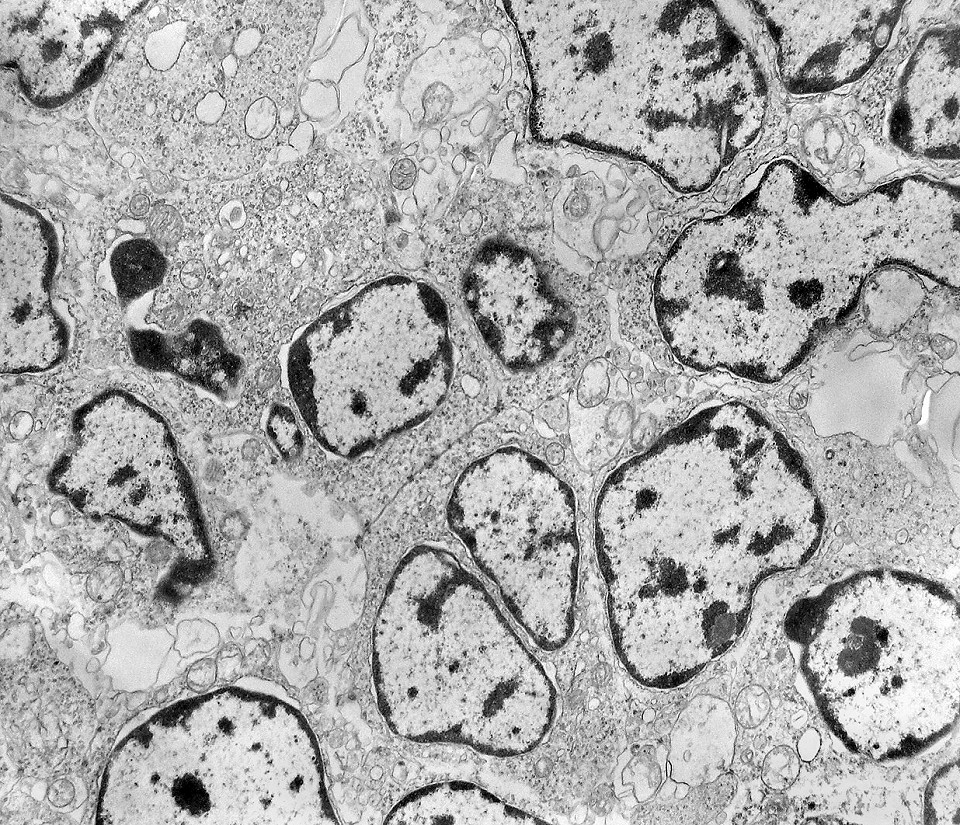
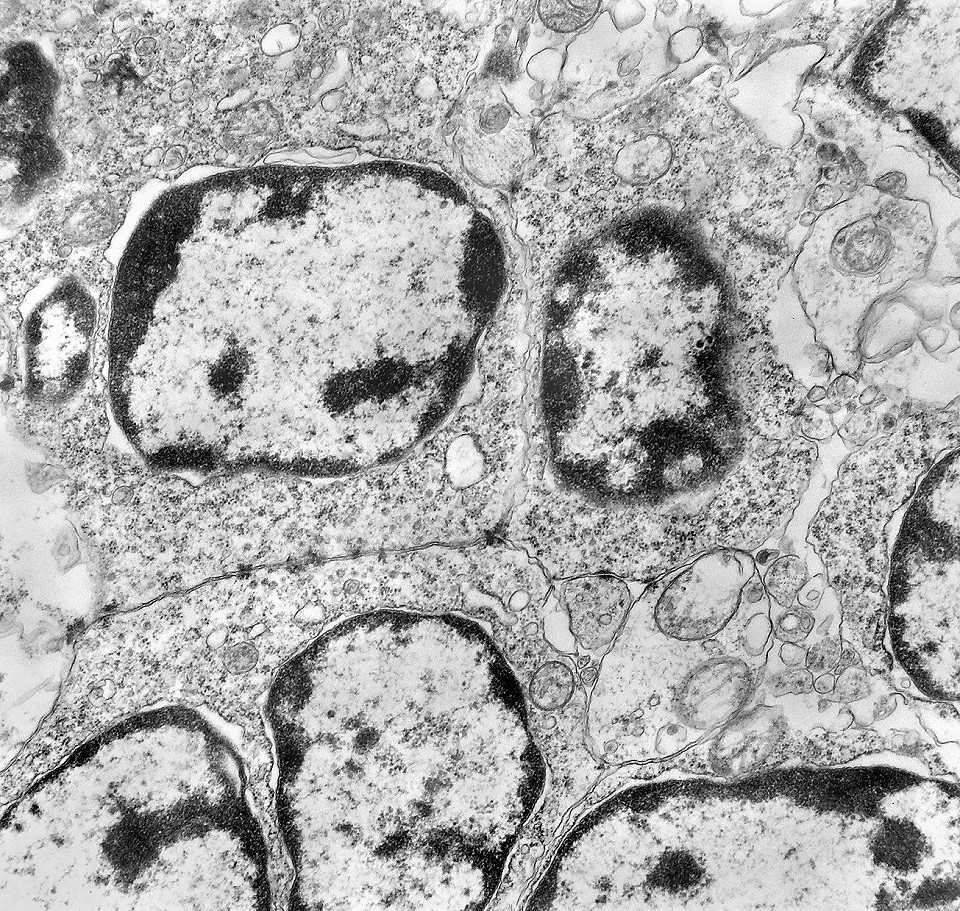
| Junções intercelulares. Junções intercelulares eram escassas neste tumor embrionário com neurópilo abundante e rosetas em multicamadas. Na grande maioria dos campos e células examinados não havia junções. As observadas estavam quase sempre associadas às rosetas e correspondiam a junções de ancoragem ou do tipo aderente (adherens junctions). Nas células participantes das rosetas de centro vazio observamos junções pequenas e delicadas, pontuais, do tipo puncta adherentia. Já nas rosetas de centro preenchido predominavam junções mais extensas e eletrodensas, do tipo zonulae adherentes. Ambas conectam filamentos de actina de células vizinhas e são intermediadas por proteínas do grupo das cadherinas, que fazem uma ponte que cruza o espaço extracelular. Para mais sobre junções intercelulares, clique. |
 |
 |
 |
 |
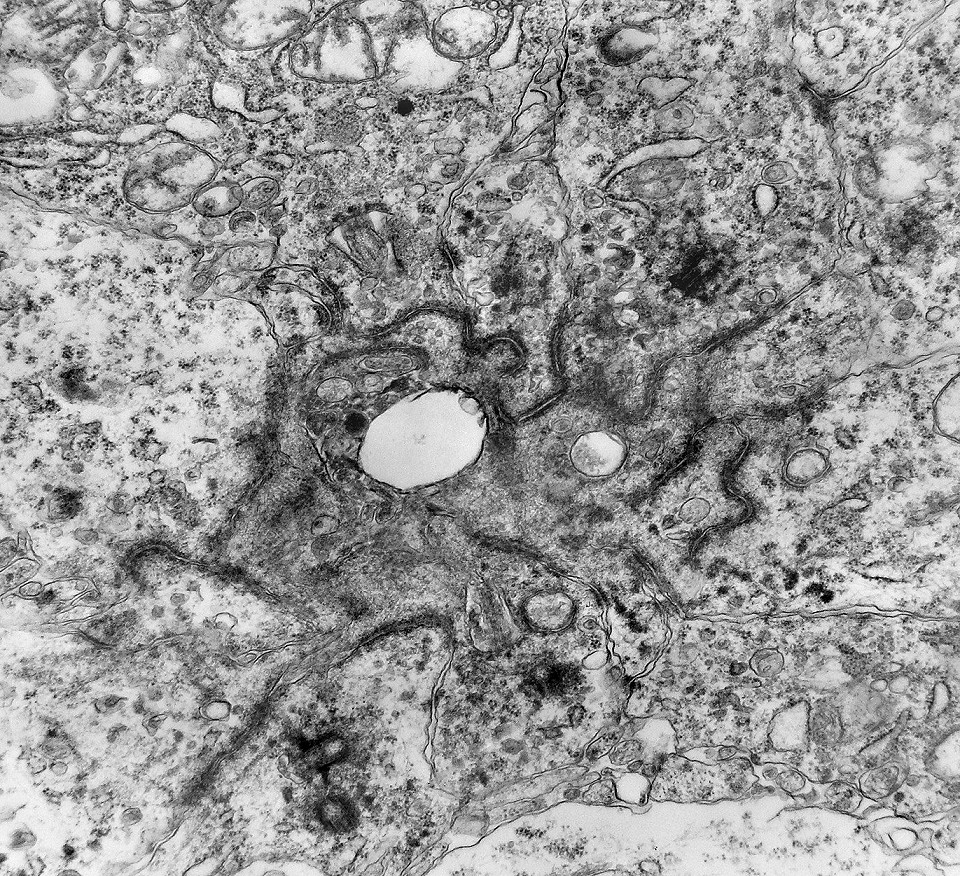
| Junções complexas do tipo zonulae adherentes ocorriam entre membranas apicais de células de rosetas de centro preenchido, e marcavam o centro das mesmas. Neste ápices era comum também a observação de centríolos, sugerindo que se trata de células mitoticamente ativas. Esta impressão é apoiada pelo alto índice Ki67 das células das rosetas. |
 |
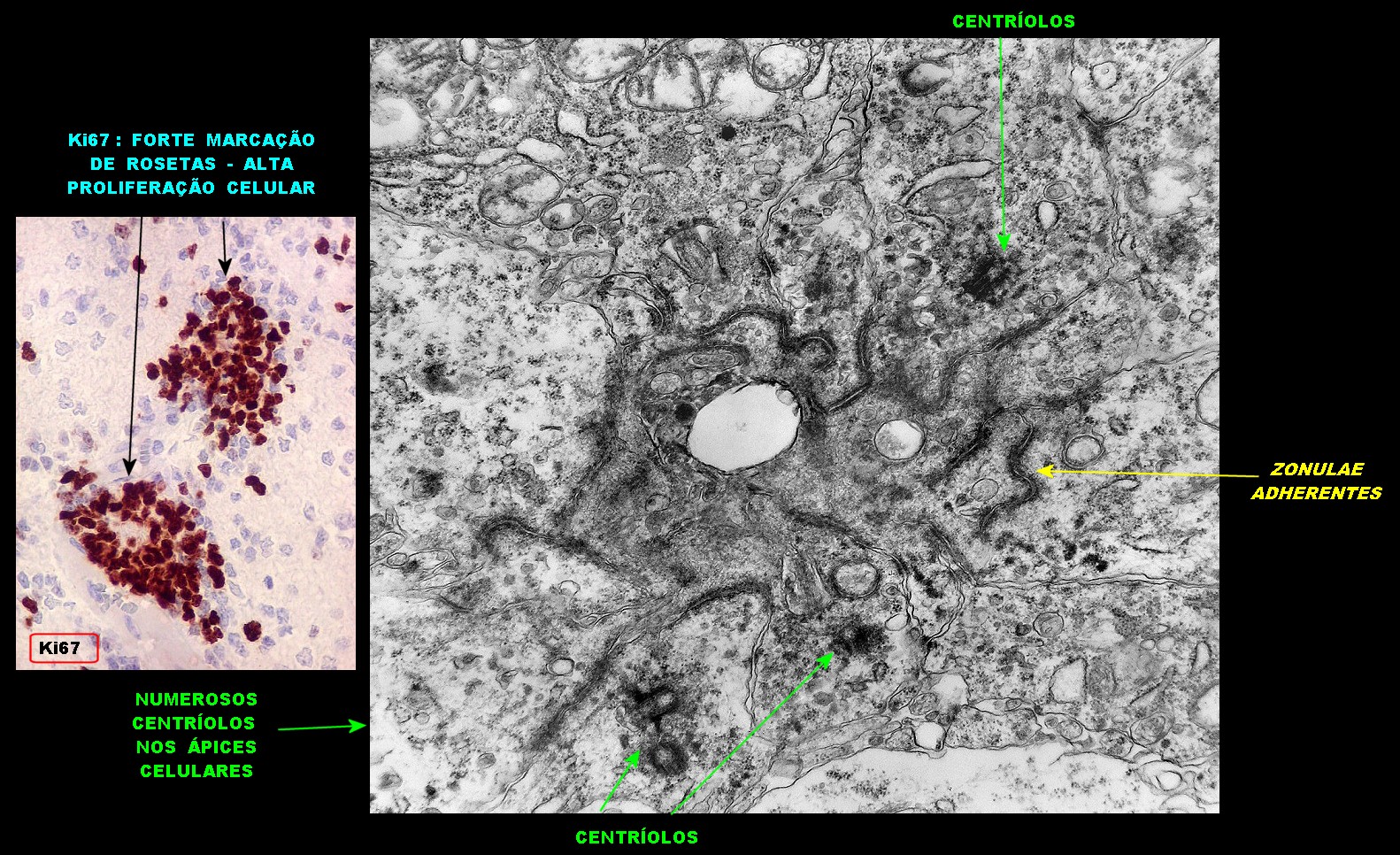 |
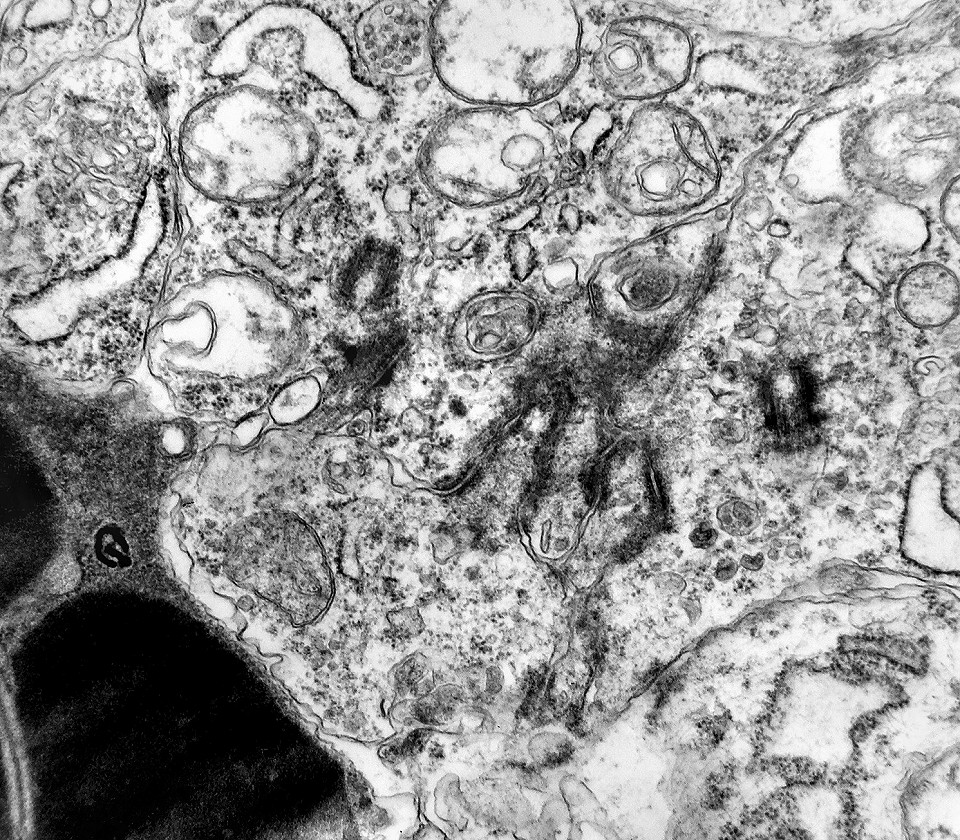
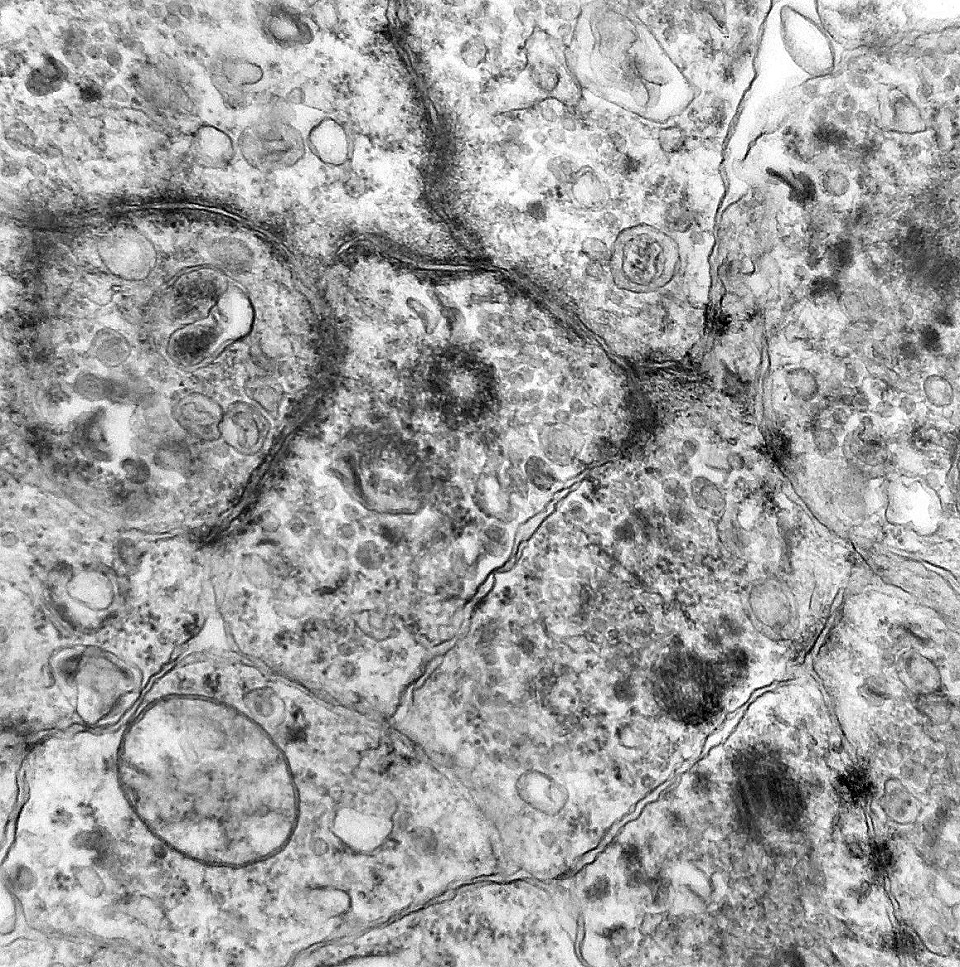
| Centríolos. Estas organelas que orientam o fuso mitótico concentravam-se nos ápices de células participantes de rosetas, especialmente as de centro preenchido. Podiam ser vistos aos pares, com a característica disposição perpendicular das subunidades, ou isoladamente. Em raros exemplos, em corte perfeitamente transversal ao maior eixo de um dos cilindros, foi possível encontrar a arquitetura em 9 tripletos de microtúbulos. A boa preservação destas estruturas ilustra a eficiência do formol per se na fixação do tecido. |
 |
 |
 |
 |
 |
 |
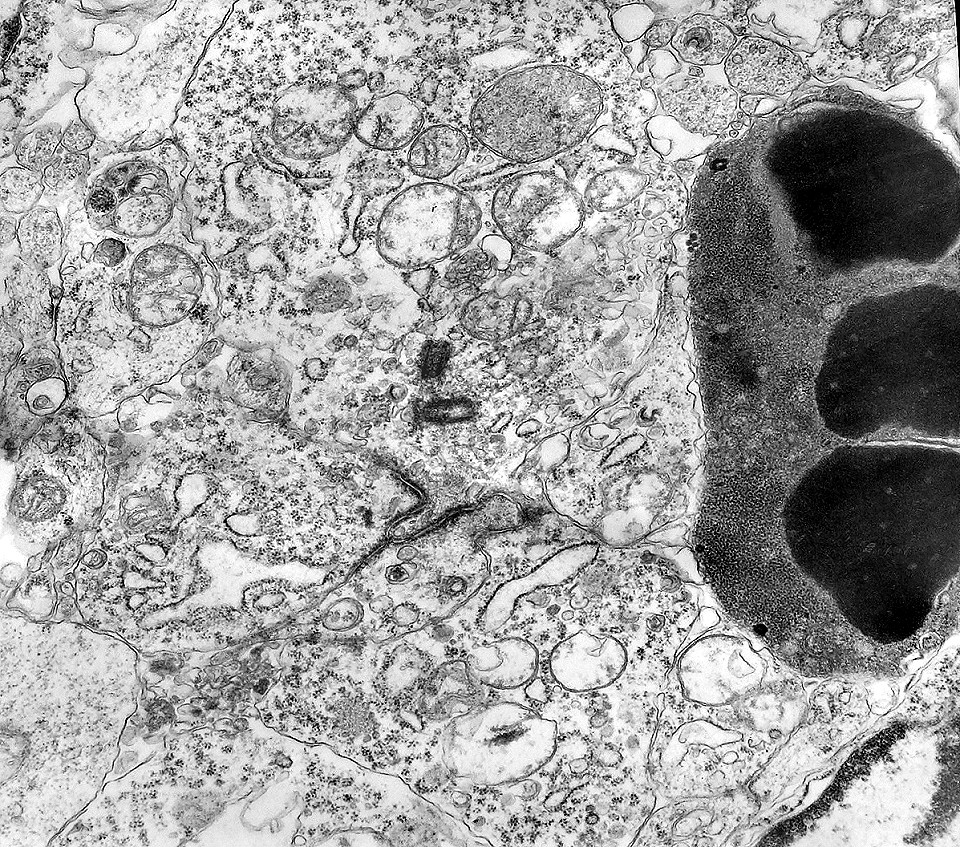
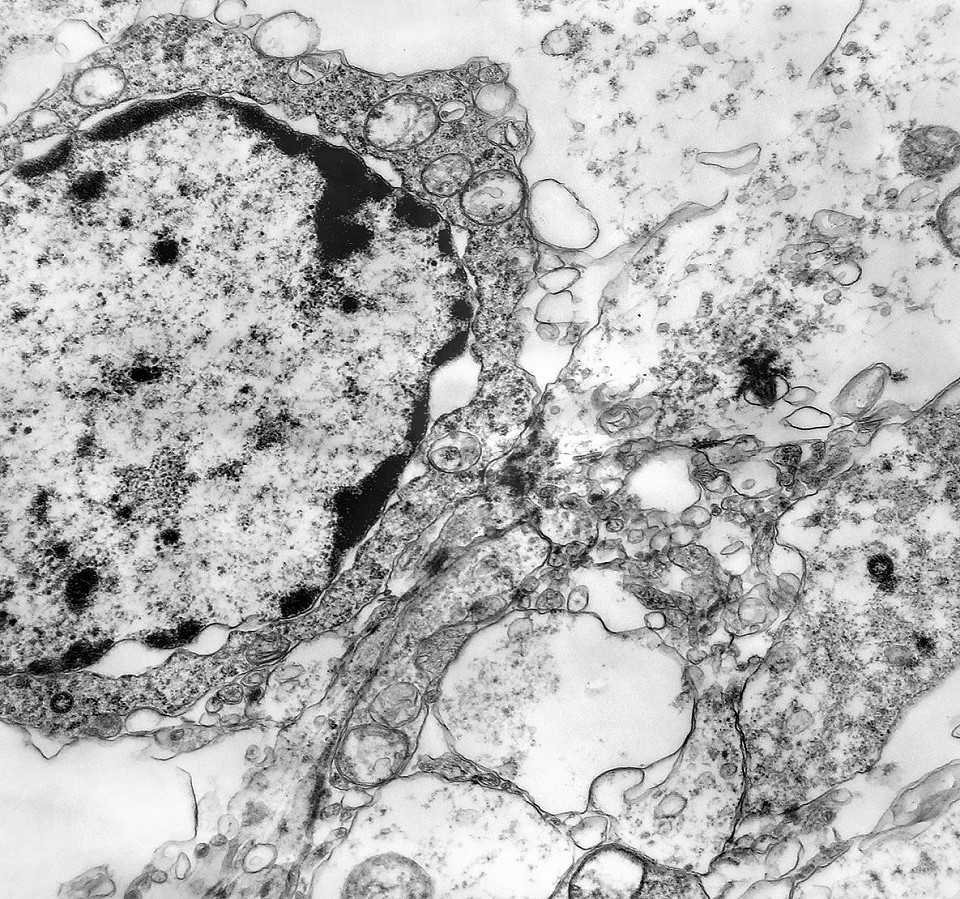
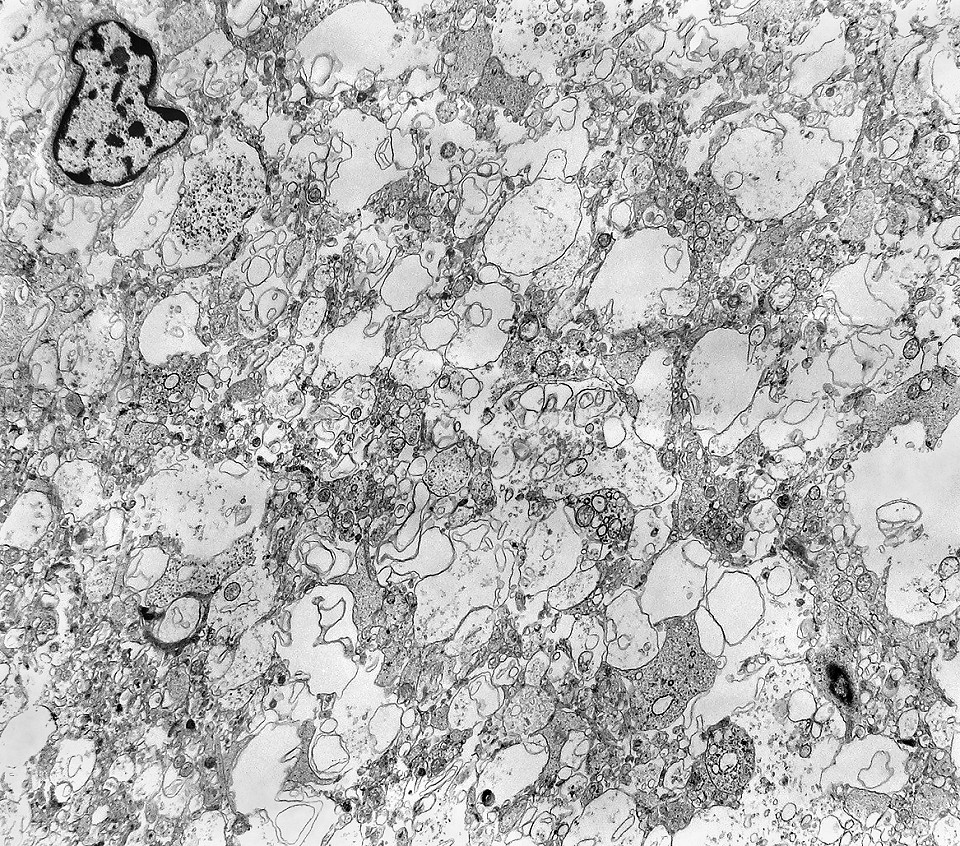
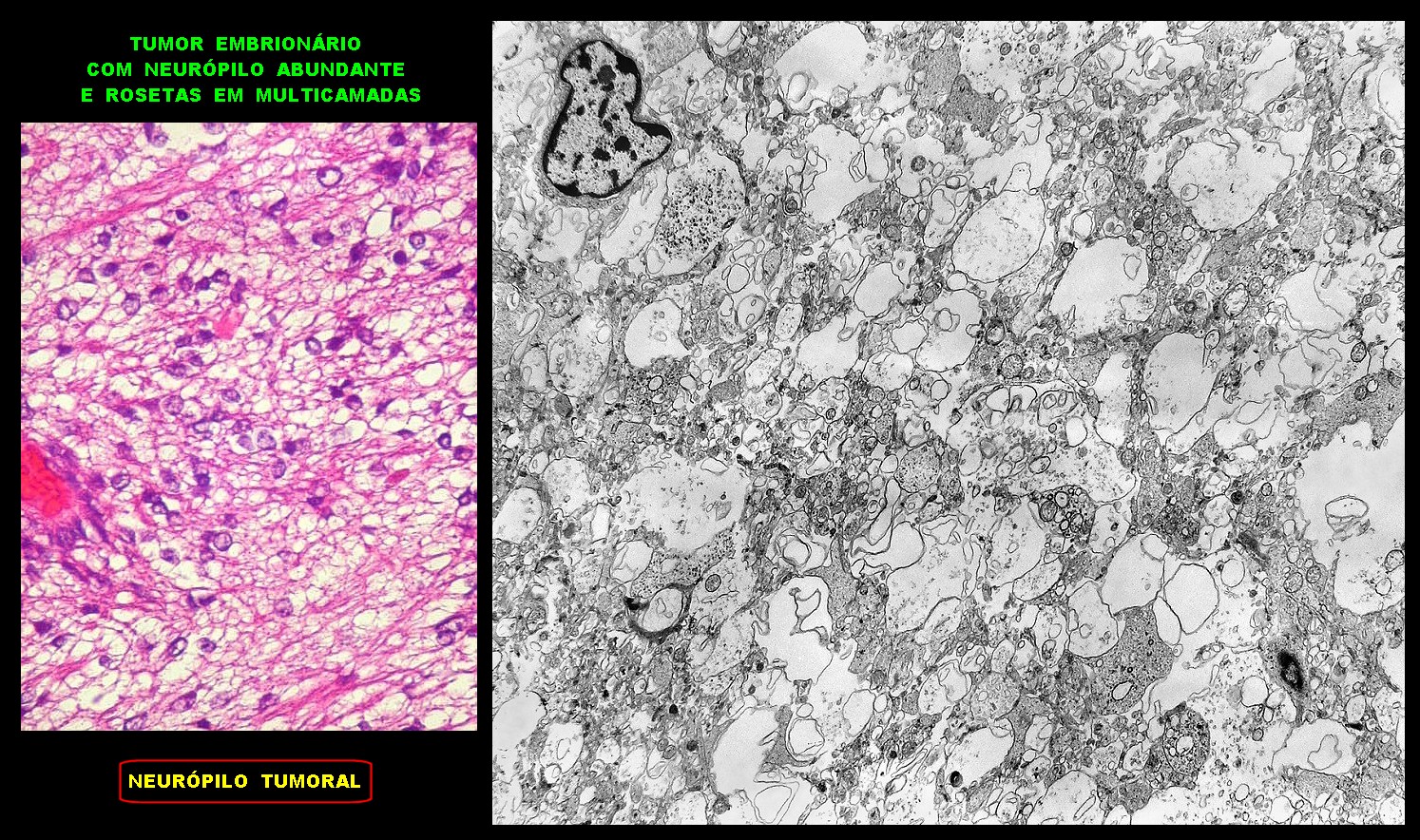
| Neurópilo. O tecido entre os corpos celulares encontrado em extensas áreas do tumor (ver HE) guarda semelhanças com o neurópilo do córtex cerebral e outras áreas de substância cinzenta normal, daí o uso do termo 'neurópilo' para partes desta neoplasia. O neurópilo aqui é constituído por prolongamentos celulares de variado aspecto em íntima aposição, formando um mosaico de alta complexidade. A participação deste tecido justifica o termo tumor embrionário 'com neurópilo abundante' e rosetas em multicamadas. Ao contrário do neurópilo normal, porém, não foram encontradas sinapses. |
 |
 |
 |
 |
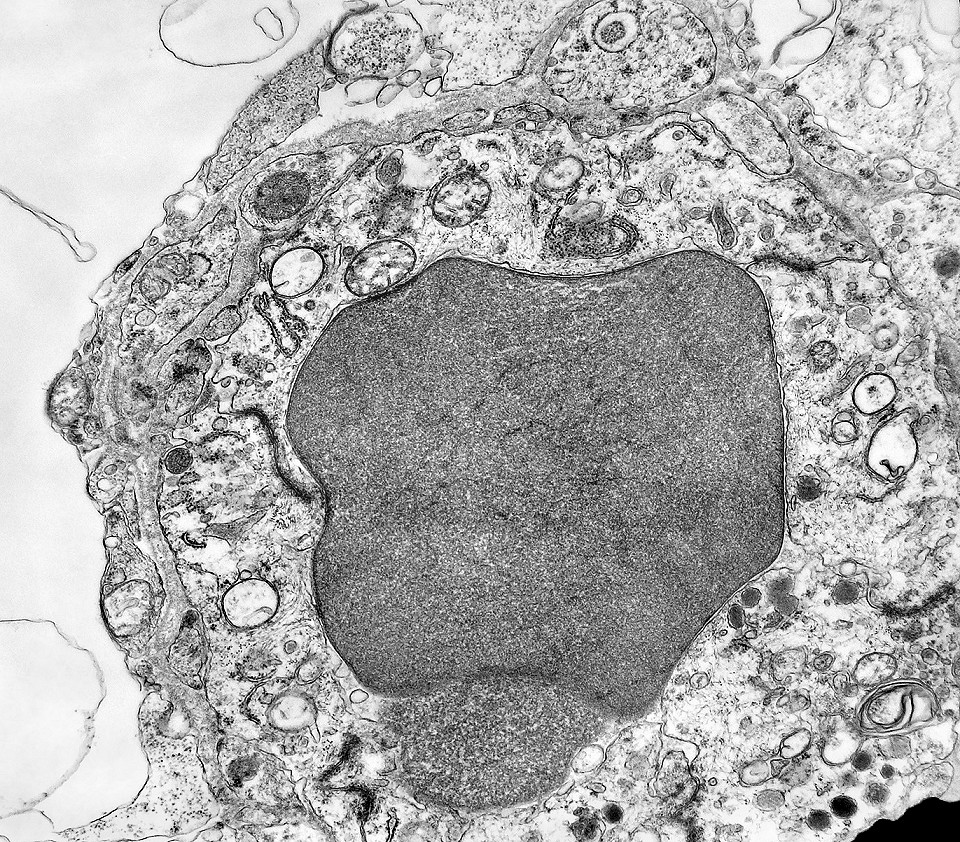
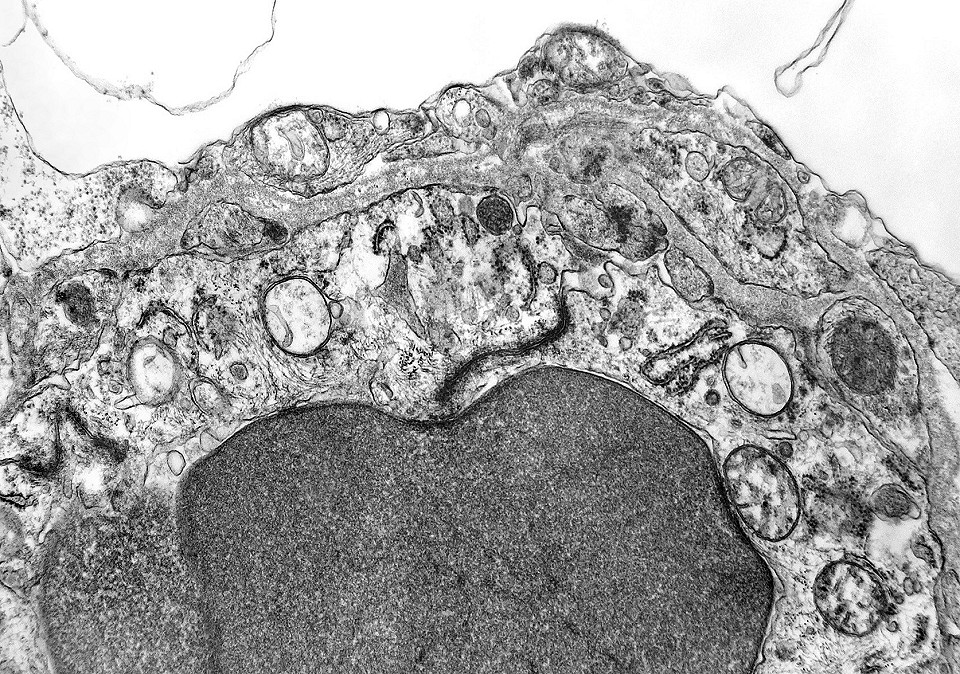
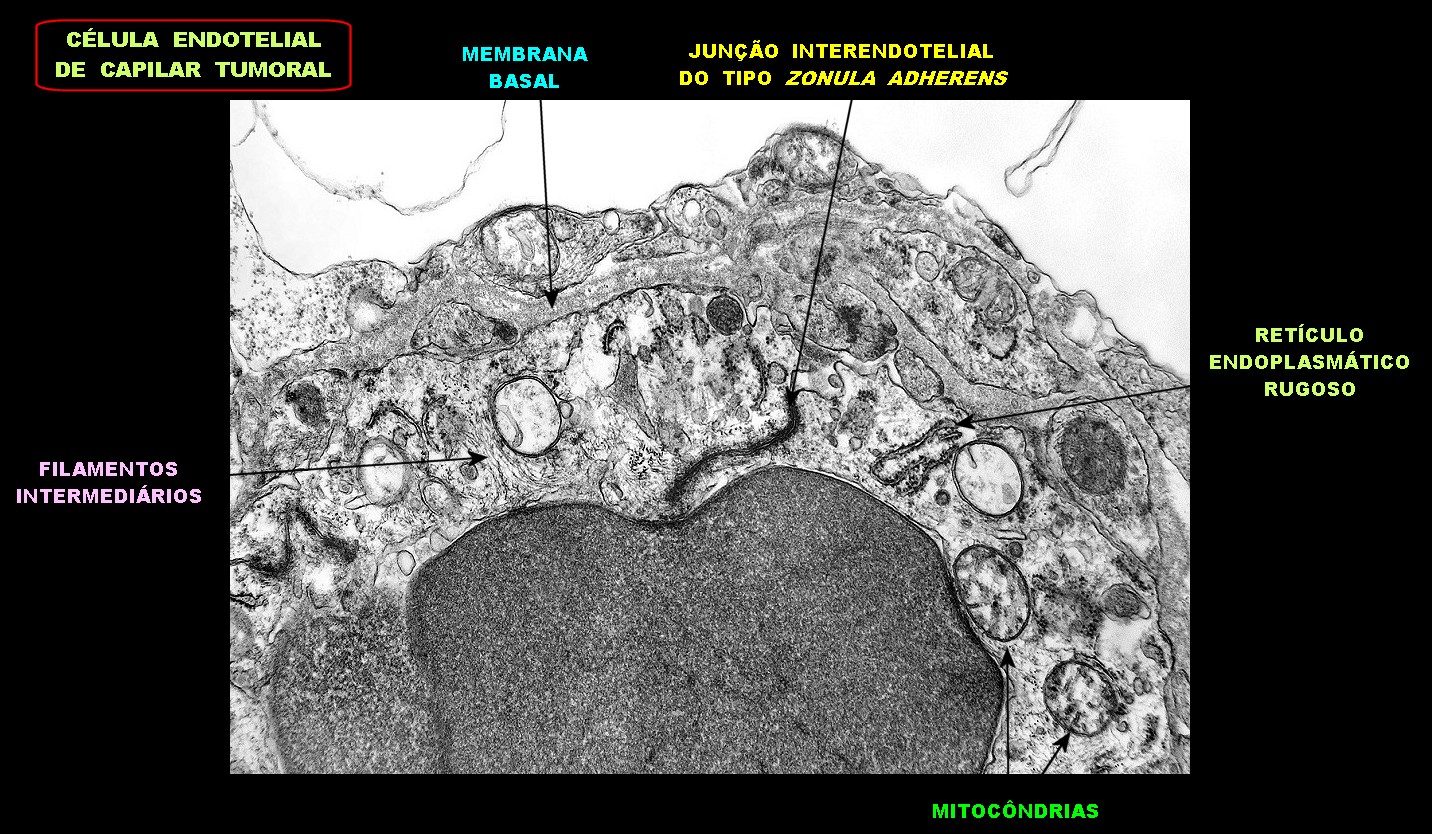
| Capilares. Os poucos vasos encontrados em microscopia eletrônica não diferiam dos capilares habituais em tecido nervoso normal. Uma monocamada de células endoteliais apoiava-se sobre membrana basal, unidas por junções interendoteliais do tipo zonula adherens. Observava-se o complemento normal de organelas, com mitocôndrias, perfis do retículo endoplásmico rugoso e filamentos intermediários, mas chamava a atenção a virtual ausência de vesículas pinocitóticas. Nisto, estes capilares também acompanhavam o encontrado em capilares cerebrais normais, onde a falta destas vesículas é um dos elementos anatômicos responsáveis pela barreira hemoencefálica. É também de interesse que, em RM, o tumor praticamente não se impregnava por contraste, testemunhando a existência da barreira no tecido neoplásico. Deve-se notar que no tecido normal são os astrócitos que induzem nas células endoteliais as funções da barreira e, neste tumor, não se observam astrócitos maduros. |
 |
 |
 |
 |
 |
 |
 |
| Agradecimentos.
Preparações de microscopia eletrônica desta página
executadas pela técnica Mayara Rodrigues Linares Silva, Depto
de Anatomia Patológica da FCM-UNICAMP, Campinas, SP.
Caso do Centro Infantil Boldrini, Campinas, SP, com especial reconhecimento ao Sr. Irineu Mantovanelli Neto, técnico macroscopista do Laboratório de Patologia, pelo gentil fornecimento do material de reserva, que tornou possível a microscopia eletrônica. |
| Para mais imagens deste caso: | TC, RM | Macro, HE, texto | |
 |
 |
||
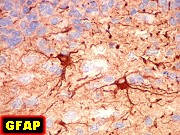
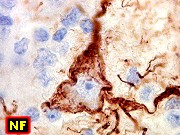
| GFAP, VIM | NF, SNF, MAP2, NeuN | EMA, Ki-67 | Microscopia eletrônica |
 |
 |
 |
 |
| Textos sobre PNETs supratentoriais (1) (2) | Tumor embrionário com rosetas em multicamadas | Ependimoblastomas | Pineoblastomas (1) (2) | Características de imagem dos PNETs |
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|
|
|