|
|
com diferenciação ependimária e neuroblástica. 2. IH |
|
|
|
com diferenciação ependimária e neuroblástica. 2. IH |
|
| Destaques da imunohistoquímica.... HE | ||
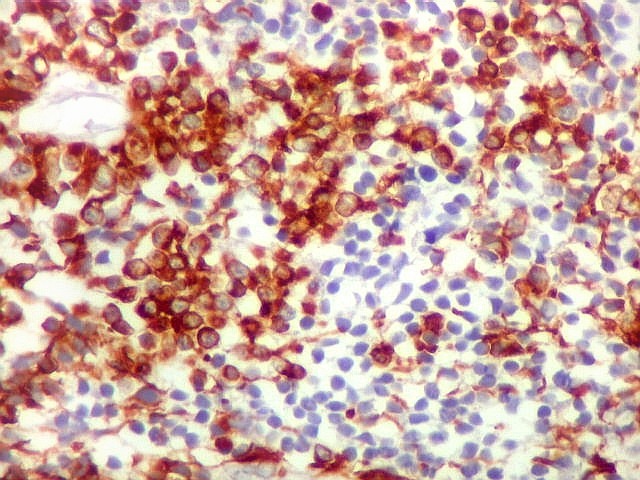
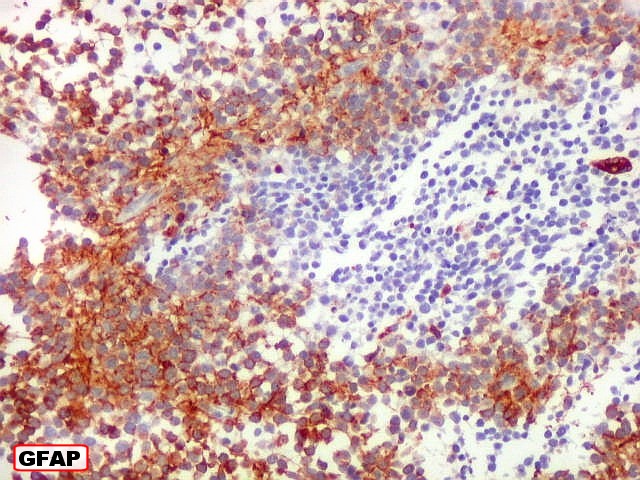
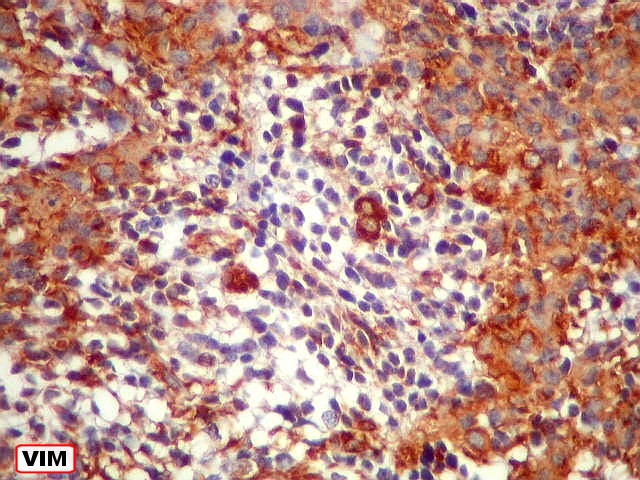
| GFAP. Positivo em parte das células neoplásicas, notadamente nas pseudorrosetas perivasculares | VIM. Variável, semelhante a GFAP, positiva forte nas pseudorrosetas perivasculares | EMA. Positividade citoplasmática focal : apóia diferenciação ependimária |
 |
 |
|
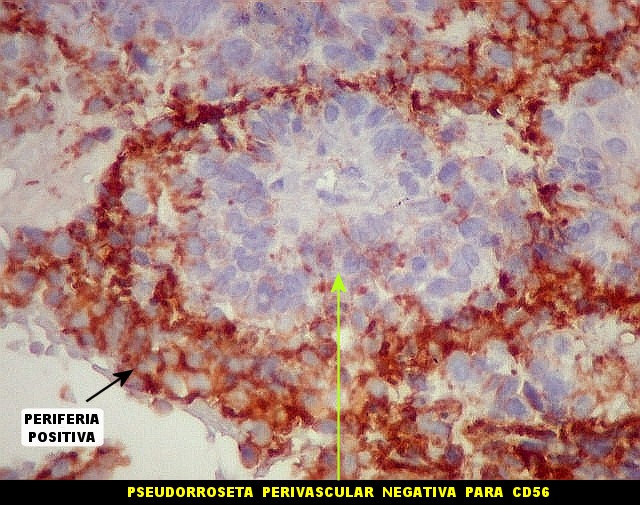
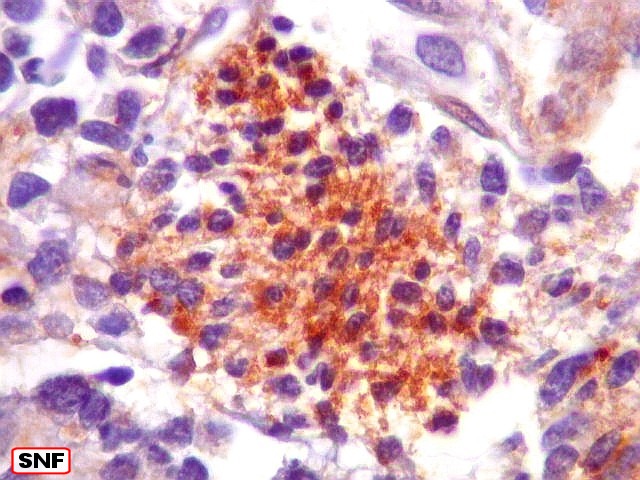
| SNF. Positiva nas ilhotas frouxas - sugestivo de diferenciação neuroblástica | CD56. Marcação variável. Pseudorrosetas positivas ou negativas | CD99. Marcação variável. Pseudorrosetas positivas, ilhotas negativas |
 |
||
| 1A4. Positivo em vasos, e em certa área no tumor | Ki-67. Positividade em cerca de 50% dos núcleos das células neoplásicas, chegando a quase 100% em certas pseudorrosetas | p53. Positividade em cerca de 50% dos núcleos das células neoplásicas |
GFAP._Com
este marcador para astrócitos, também expressado por células
ependimárias, o tumor mostrou uma mescla de áreas fortemente
marcadas e áreas negativas, sugerindo aspecto organóide.
|
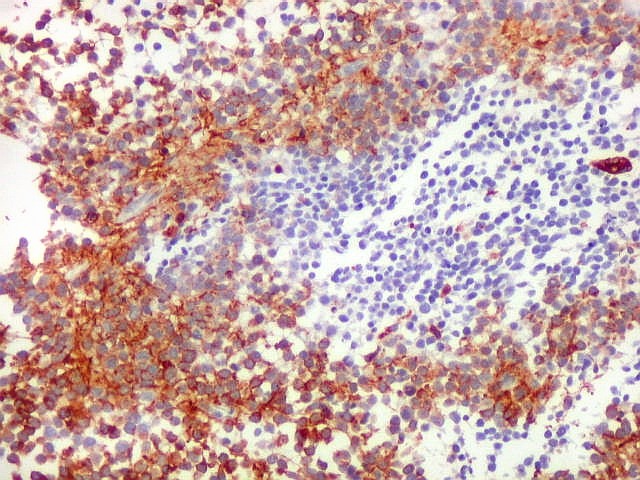
| GFAP._Mistura de células positivas e negativas para GFAP, com tendência a formar agrupamentos. |
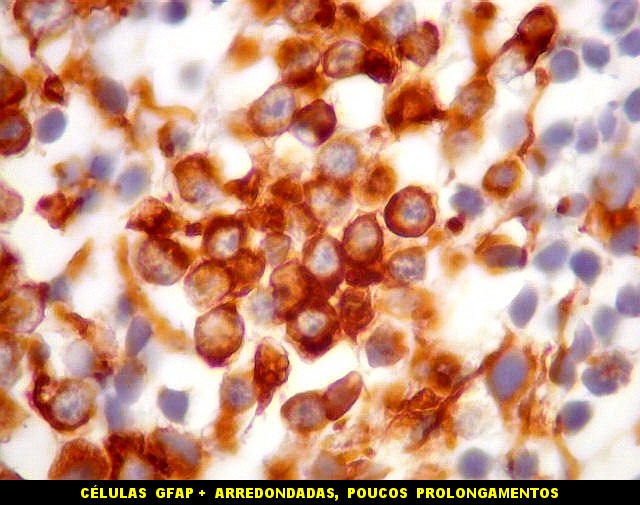
| Áreas ricas em células GFAP positivas. Algumas células eram arredondadas, sem prolongamentos aparentes. Em outras, o contorno lembrava o de astrócitos, com prolongamentos, ainda que primitivos. | |
 |
|
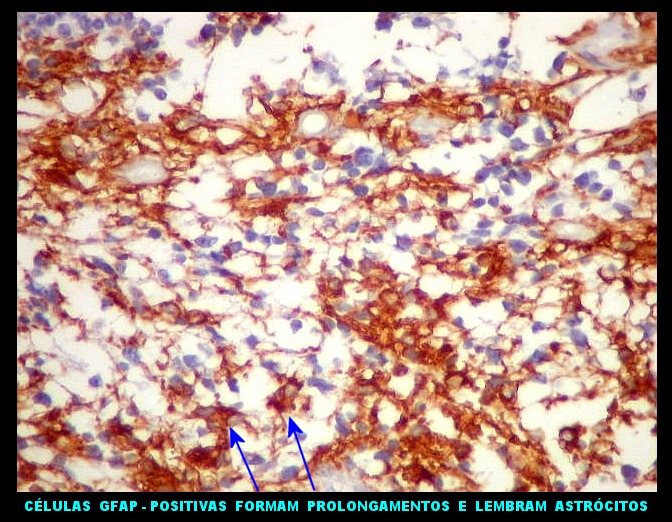 |
| GFAP
- Pseudorrosetas perivasculares
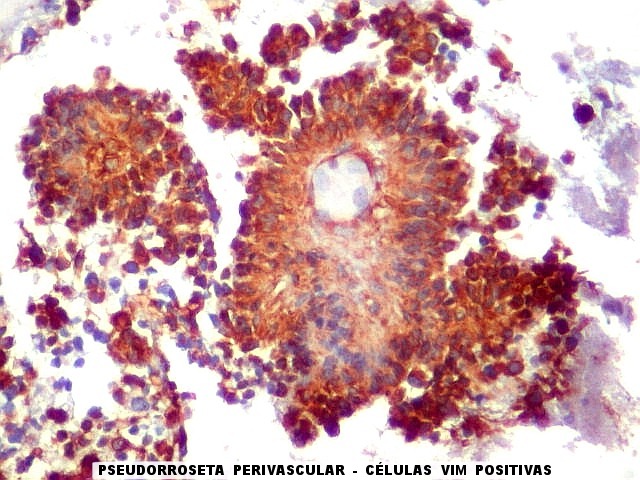
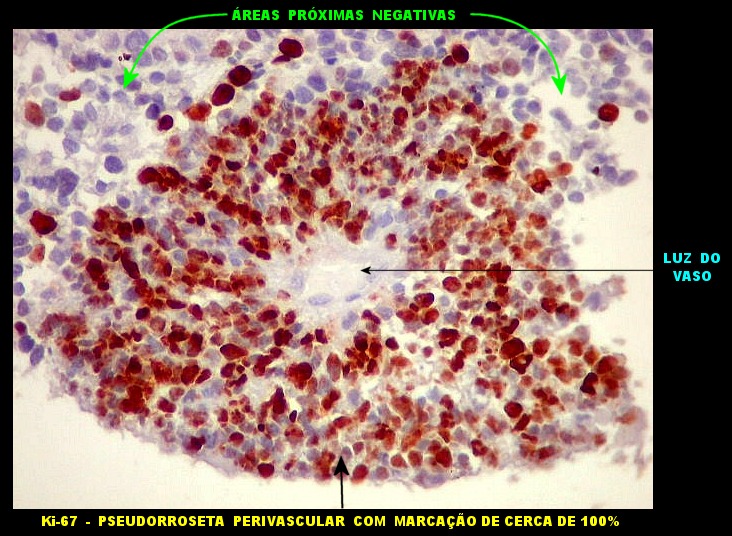
A disposição perivascular das células neoplásicas, com o maior eixo perpendicular ao vaso, lembra fortemente as pseudorrosetas perivasculares dos ependimomas. A positividade para GFAP e VIM nestas células reforça esta impressão. Com EMA, há positividade focal, também como nos ependimomas. |
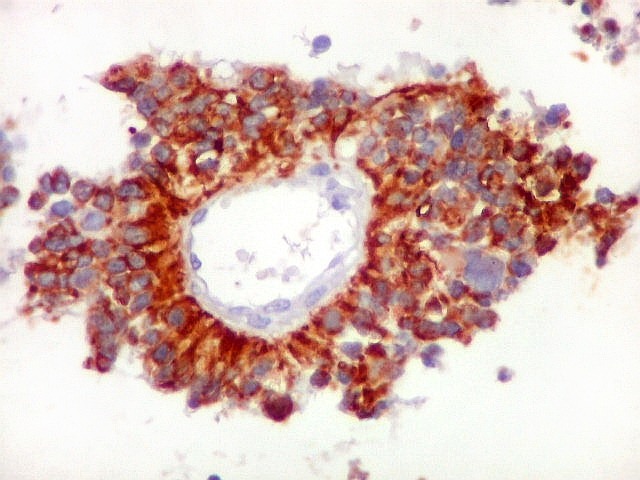 |
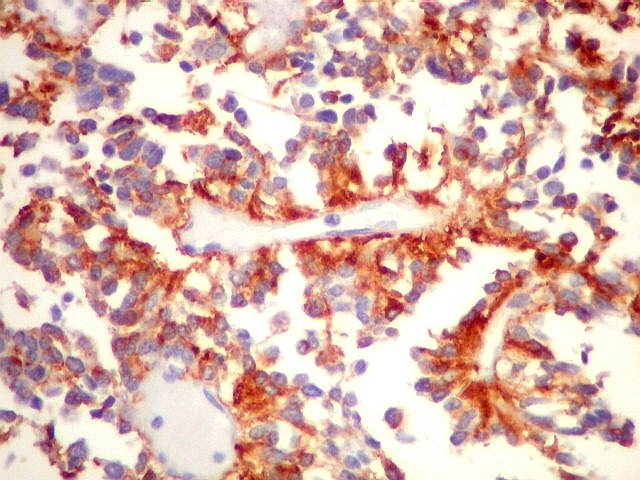 |
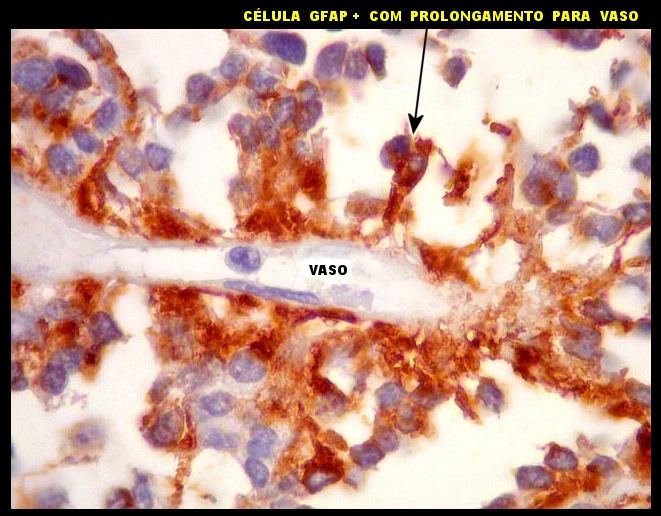 |
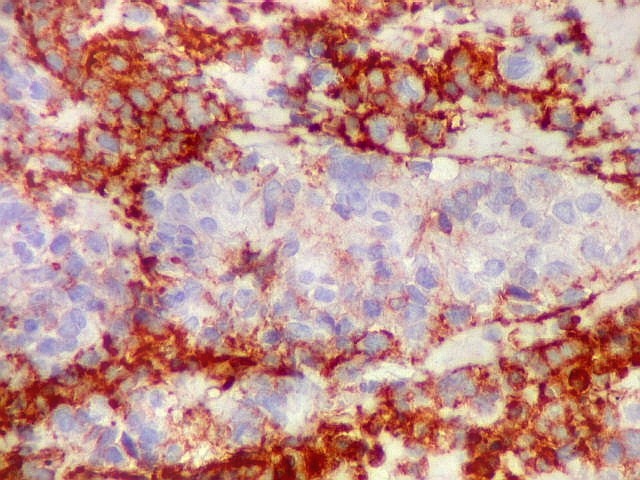
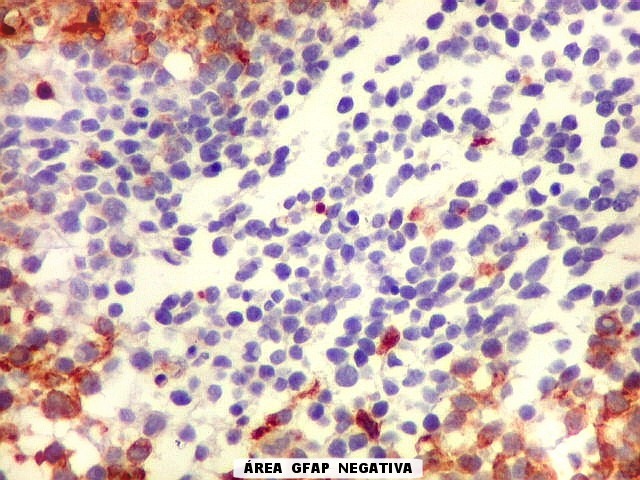
| Áreas com células GFAP negativas. Algumas áreas em que as células não reagiam para GFAP eram positivas para sinaptofisina, indicando diferenciação neuronal. As células são muito primitivas e não expressaram outros marcadores de neurônios, como neurofilamento e cromogranina. | |
 |
 |
 |
 |
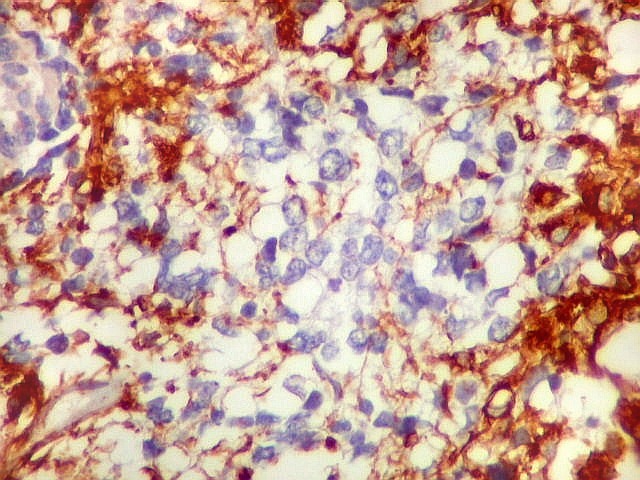
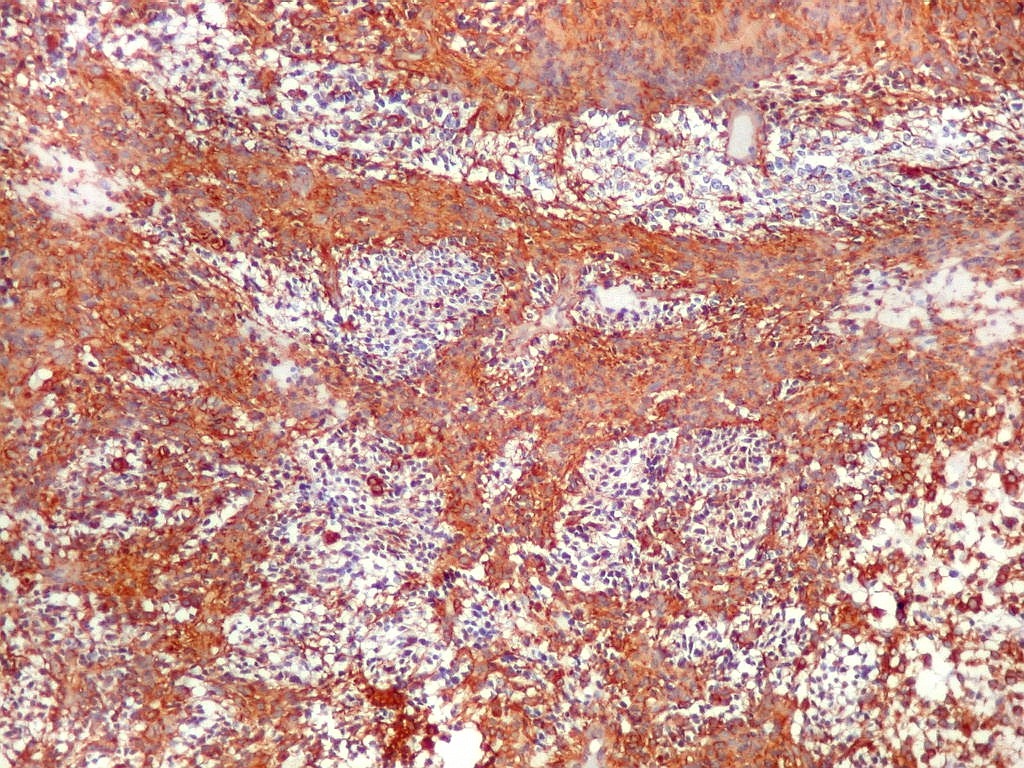
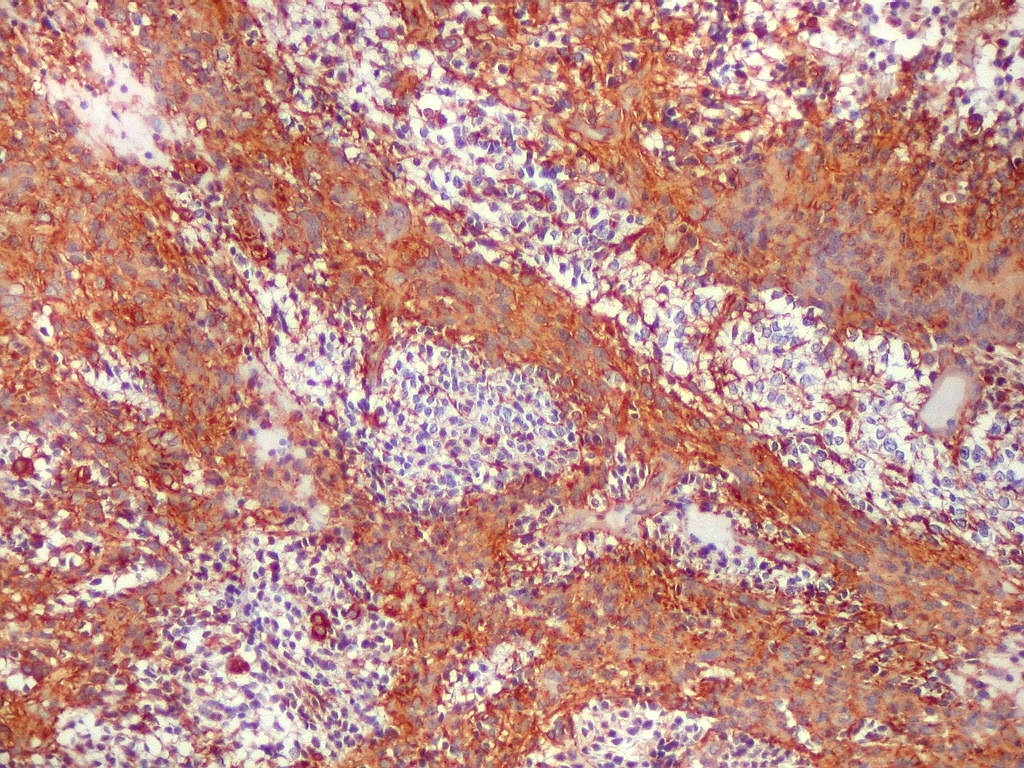
| VIM.
Com vimentina observa-se aspecto semelhante ao com GFAP (acima). O principal é a alternância entre áreas positivas e negativas, que coincidem com as mesmas com GFAP. Há também positividade nas pseudorrosetas perivasculares, como nos ependimomas. |
 |
 |
 |
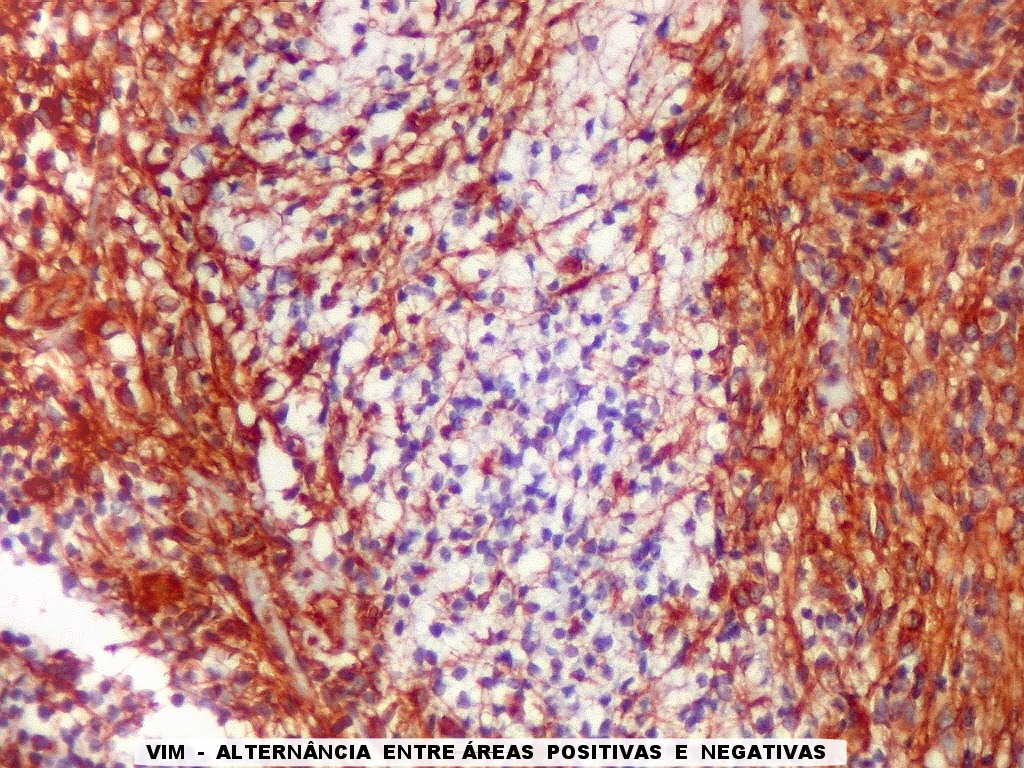 |
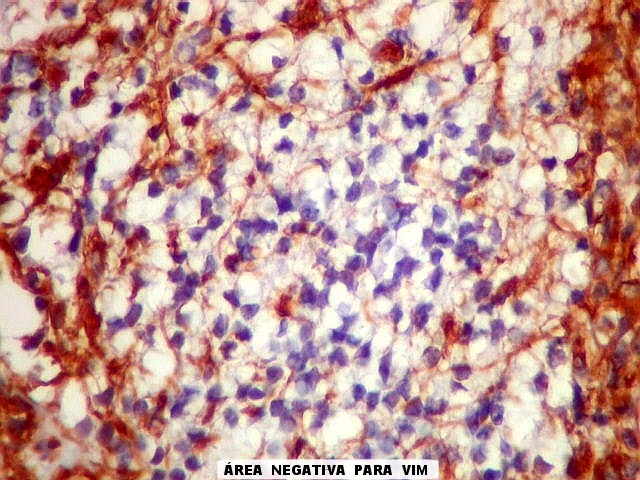
| VIM._Alternância de áreas positivas e negativas. Áreas negativas para VIM (e GFAP) foram positivas para SNF, indicando diferenciação neuronal. Esta diferenciação divergente é compatível com a natureza primitiva do tumor. | |
 |
|
 |
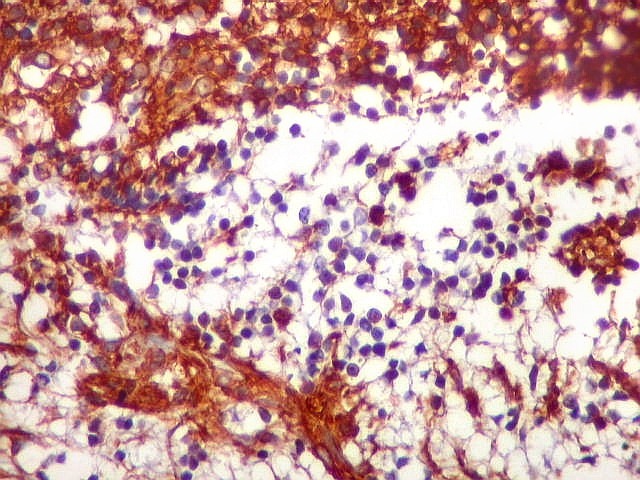 |
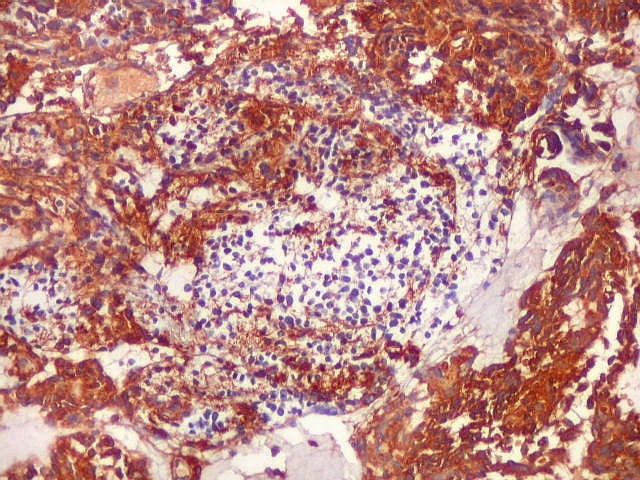
| Células VIM - positivas. Como já notado com GFAP, células VIM-positivas podiam ser arredondadas, quase sem prolongamentos, ou mostrar prolongamentos citoplasmáticos, como astrócitos primitivos. | |
| VIM - Pseudorrosetas perivasculares. Células que adotavam esta disposição perivascular geralmente eram fortemente positivas para VIM, como nos ependimomas. | |
 |
|
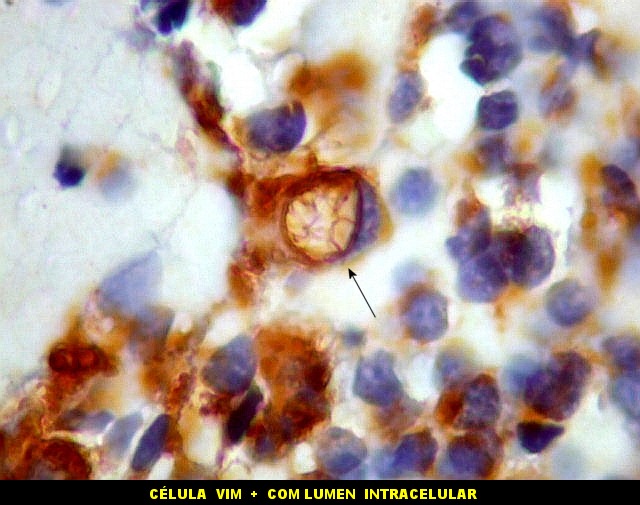
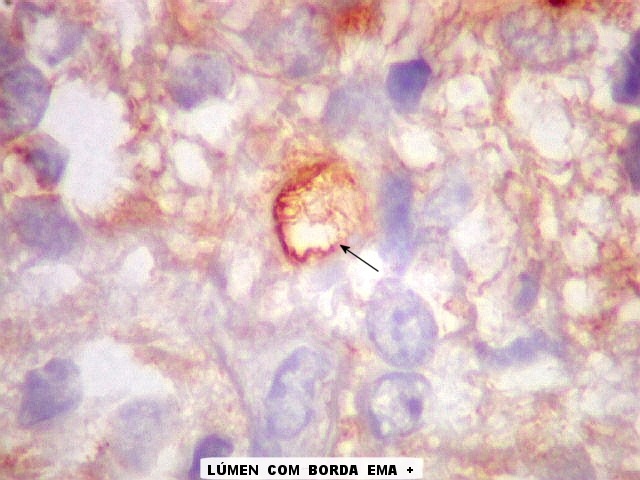
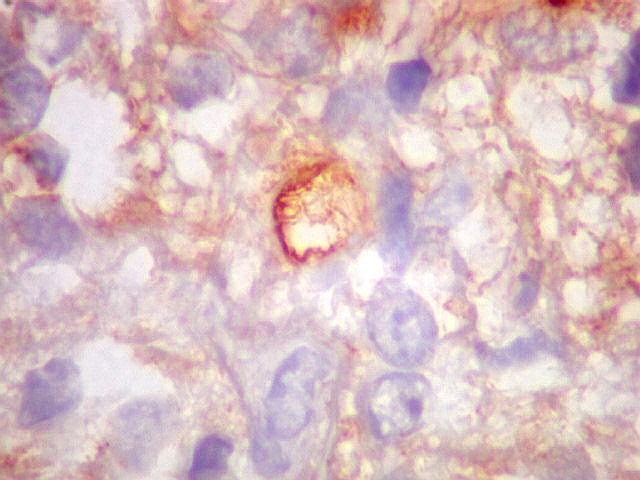
| VIM.
Esta célula mostra um raro lúmen intracelular, como em ependimomas. O lúmen é notável pelo seu tamanho, que causa até deformação do núcleo em meia lua. Filamentos no interior poderiam representar microvilos como em ependimomas em microscopia eletrônica (1) (2). A borda de tais lúmens em ependimomas geralmente são EMA positivos, como também foram no presente caso. |
 |
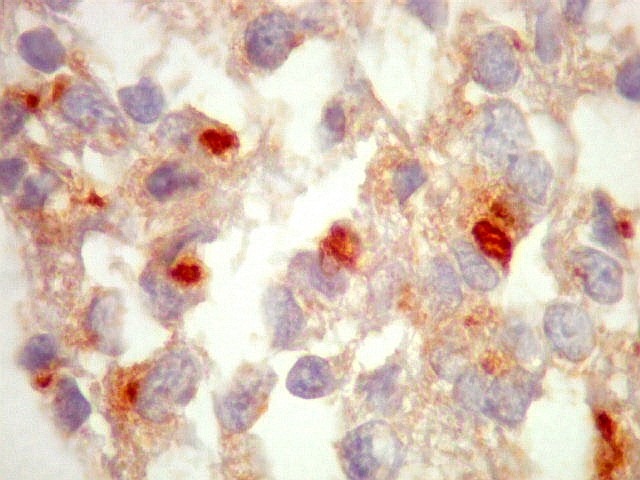
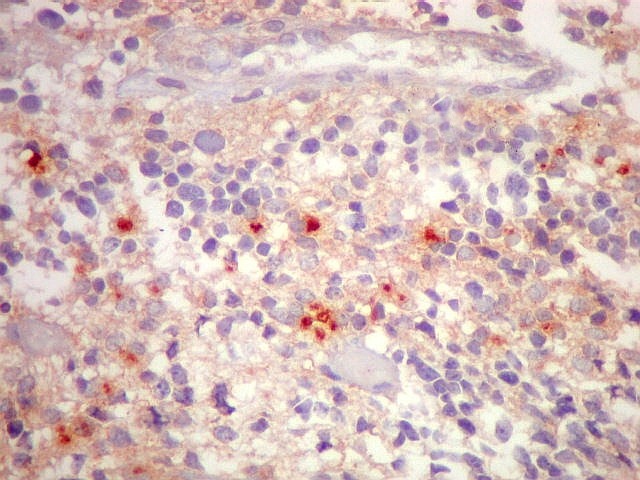
| EMA. Foram observados pequenos focos de positividade para antígeno epitelial de membrana, em vários parecendo delimitar uma pequena luz. Tais formações são próprias de ependimomas e reforçam a impressão de que parte deste tumor tinha diferenciação ependimária. | |
 |
|
 |
|
 |
|
 |
|
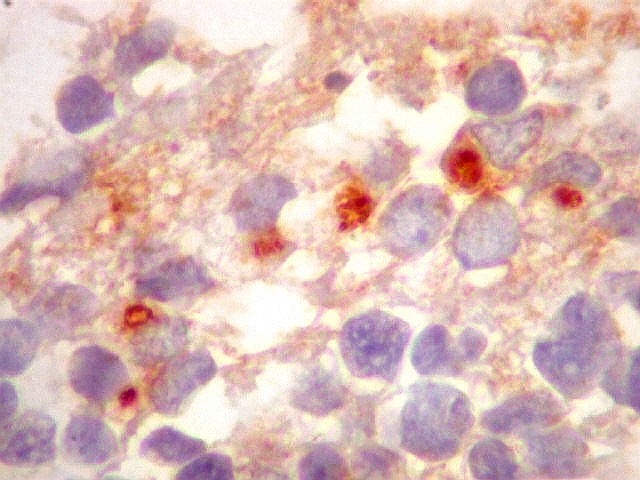
| Comparação entre duas células marcadas por VIM e EMA mostrando lúmens intracelulares. Vimentina marca todo o citoplasma, enquanto que EMA marca só a borda do lúmen e microvilos projetando para a luz. | |
| VIM. | EMA. |
 |
|
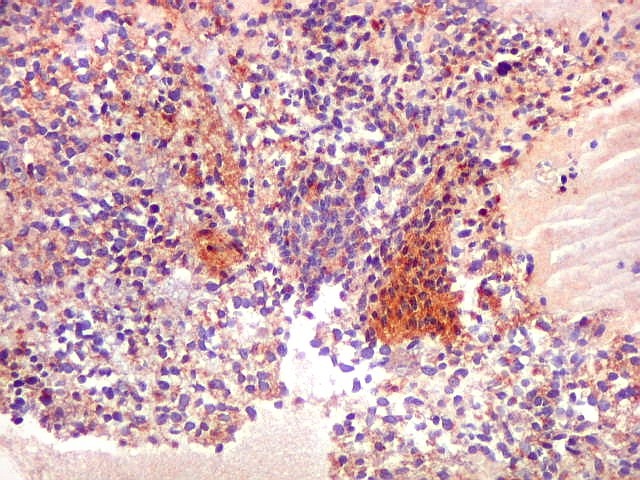
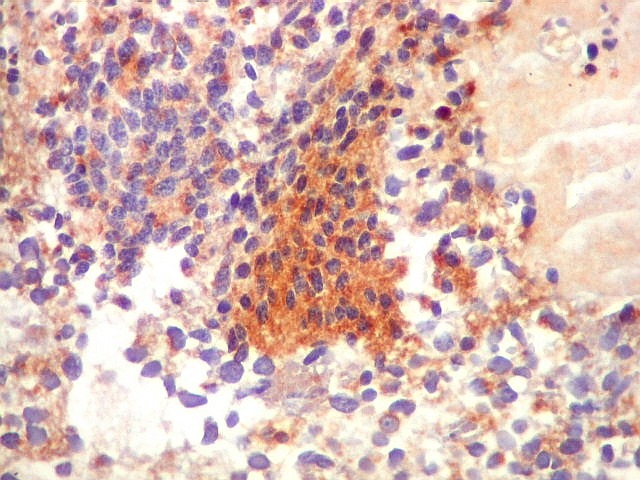
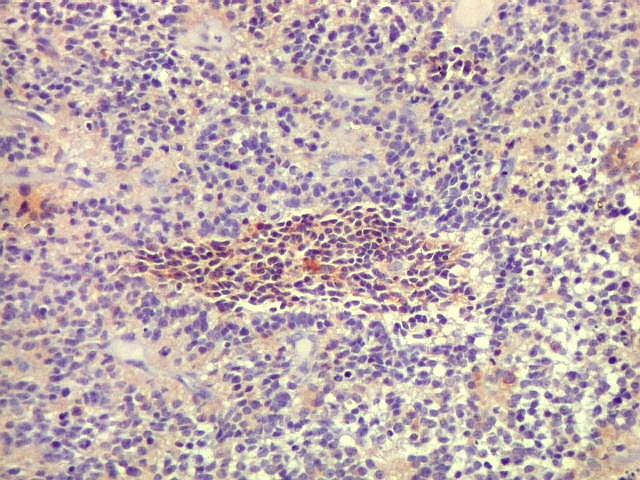
| SNF. Positividade em áreas. Áreas focais de positividade para sinaptofisina indicam diferenciação para linhagem neuronal. Geralmente os núcleos nestas áreas eram menores que nas áreas negativas. O aspecto guarda semelhança com os meduloblastomas desmoplásicos, que apresentam focos de positividade para marcadores neuronais no centro das ilhotas. Para exemplos, clique (1) (2). | |
 |
 |
 |
|
| Comparação entre áreas marcadas por GFAP e SNF, mostrando que áreas negativas para GFAP podem ser positivas para SNF. As fotos não foram feitas na mesma região dos cortes. | |
| GFAP. | SNF. |
 |
|
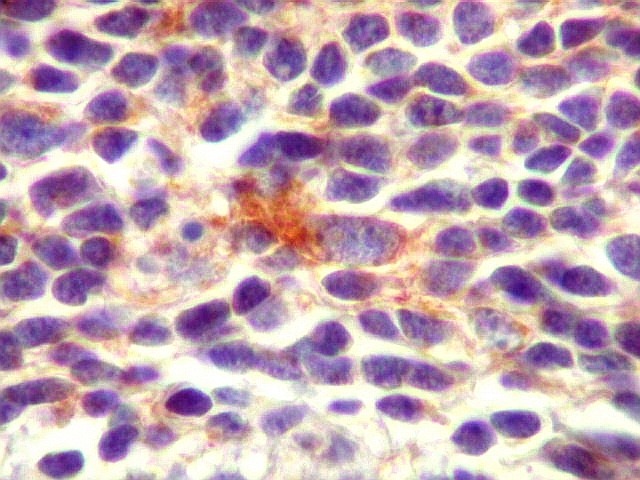
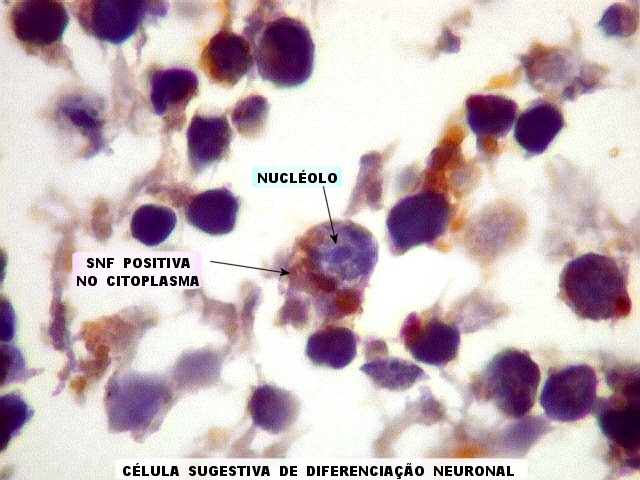
| SNF. Positividade em células individuais. Algumas células mostram positividade para SNF no citoplasma e apresentam também nucléolo, o que pode também ser tomado com indício de diferenciação neuronal neste tumor neuroectodérmico primitivo. | |
 |
|
 |
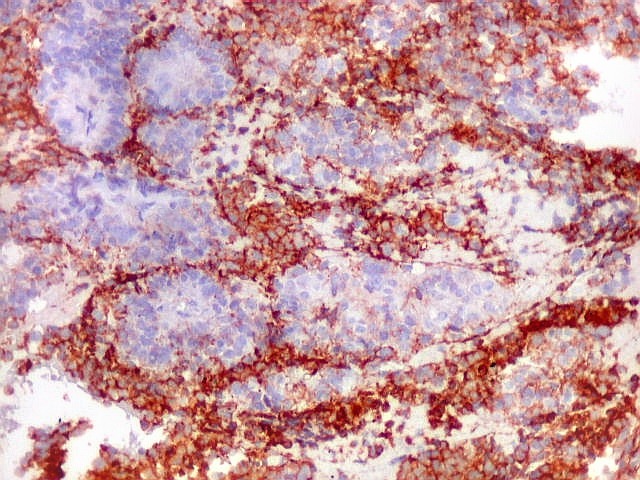
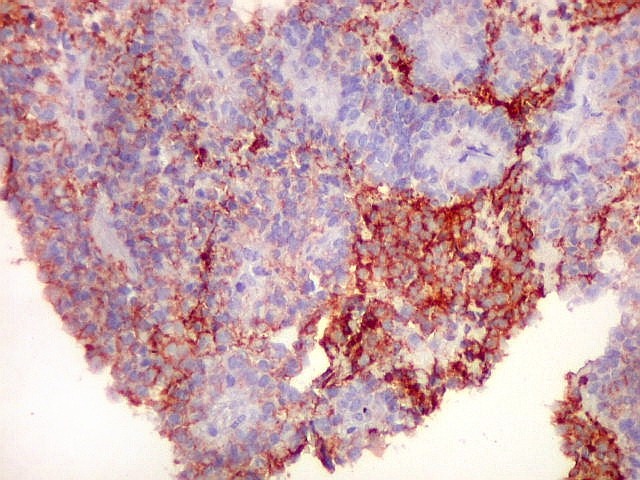
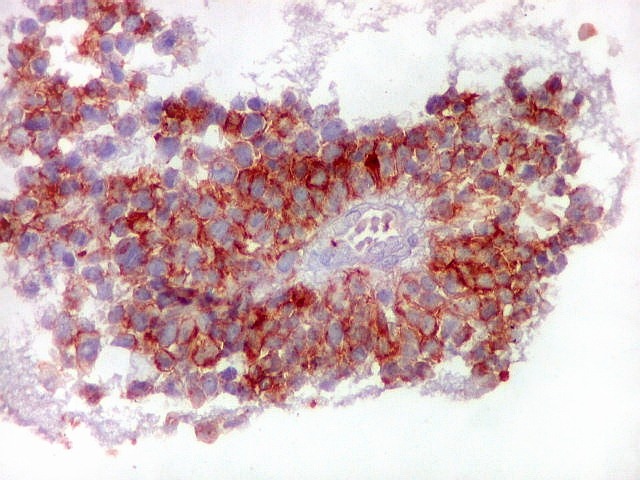
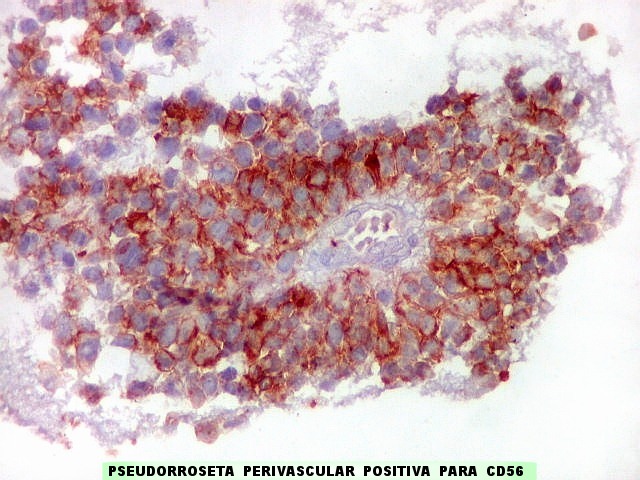
| CD56._CD56 ou NCAM (clique para breve texto) foi também variavelmente positivo neste PNET central, sugerindo uma estrutura organóide, ou focos de diferenciação divergente das células tumorais. As pseudorrosetas perivasculares demonstradas com GFAP e VIM podem ser positivas ou negativas para CD56. | |
 |
 |
 |
|
 |
|
 |
 |
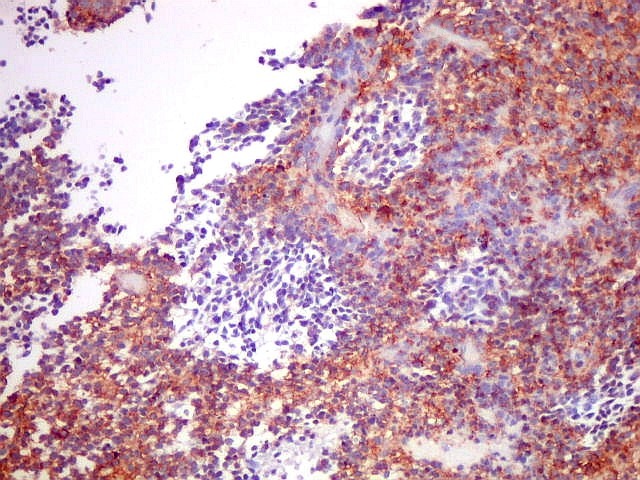
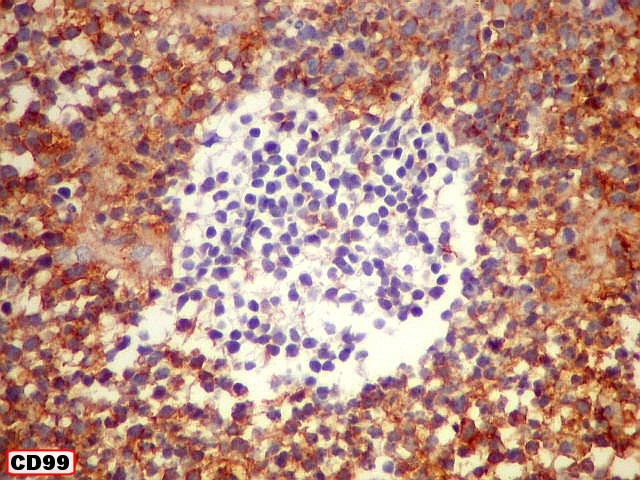
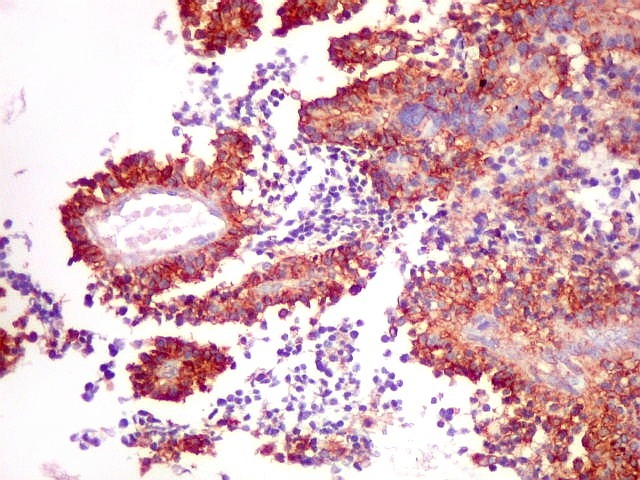
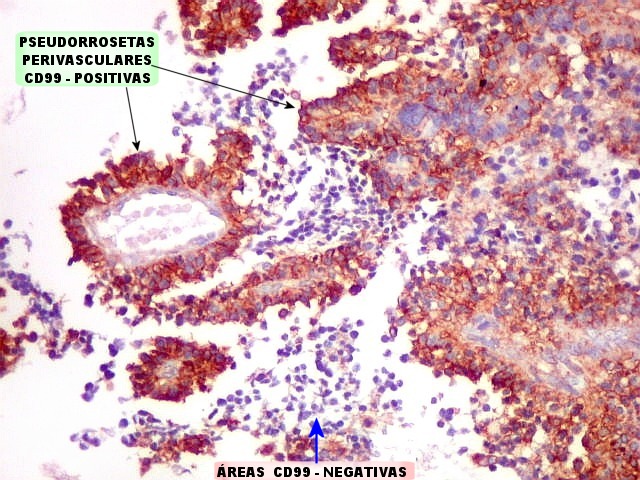
| CD99 (proteína MIC-2; proteína p30/32). É uma proteína membrano-citoplasmática de função incerta (clique para breve texto), expressada em virtualmente todos os PNETs periféricos e sarcomas de Ewing. A especificidade para linhagem neuroectodérmica não é absoluta, pois pode marcar 90% dos linfomas linfoblásticos e < 15% dos rabdomiossarcomas alveolares. Ocorre também em até 20% dos carcinomas neuroendócrinos. Os PNETs centrais não costumam expressar CD99, com ocasionais exceções, reconhecidas na literatura. Contudo, aqui, vemos positividade variável em diferentes seções do tumor, à maneira do já demonstrado com outros marcadores, sugerindo diferenciação divergente. |
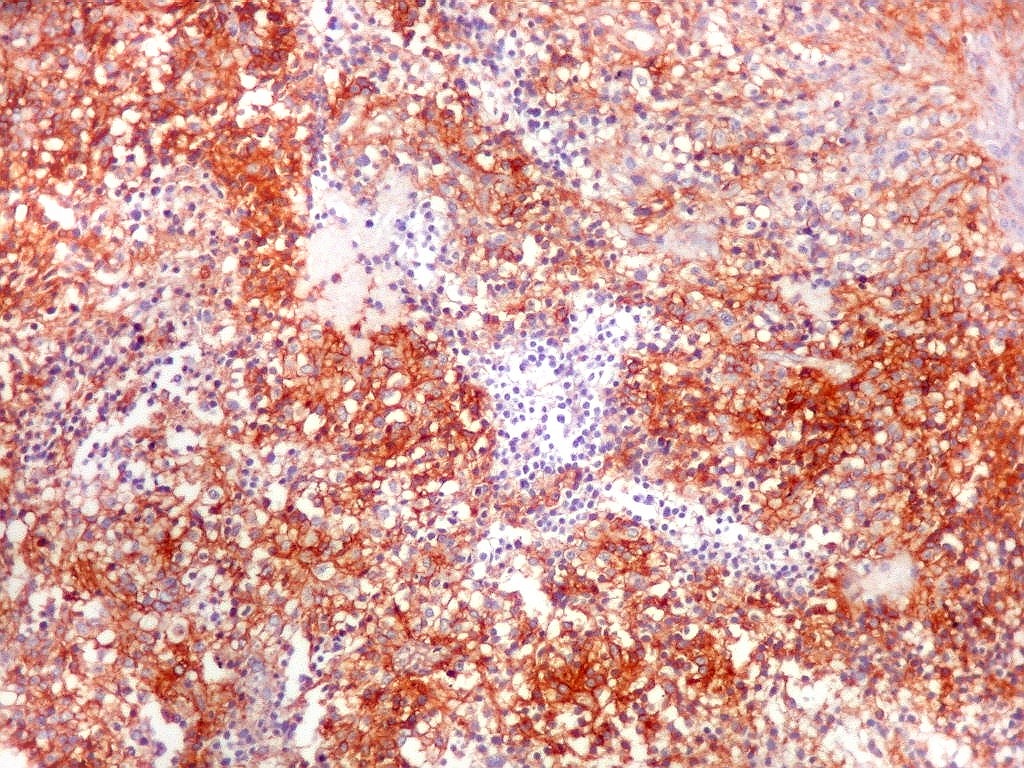 |
| CD99. Alternância entre áreas positivas e negativas. | |
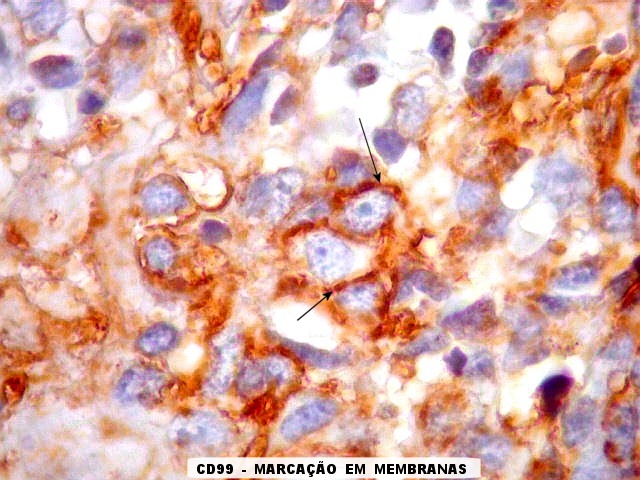
| Áreas CD99 positivas. A marcação é notada predominantemente nas membranas celulares. | |
 |
|
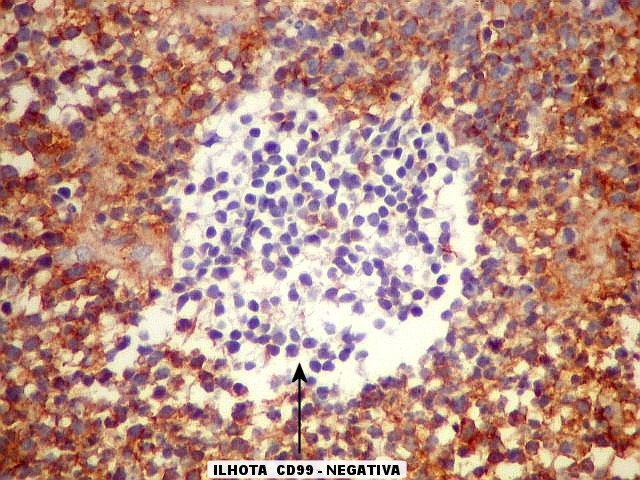
| Áreas CD99 negativas. Parecem coincidir com as ilhotas positivas para SNF e negativas para GFAP e VIM já notadas acima. | |
 |
|
 |
|
| Comparação das ilhotas com quatro anticorpos | |
 |
 |
 |
 |
| CD99 - Pseudorrosetas perivasculares. São geralmente CD99 positivas, como também são para GFAP e VIM (sugere que as células CD99 positivas estão sofrendo diferenciação glial ou ependimária). | |
 |
|
 |
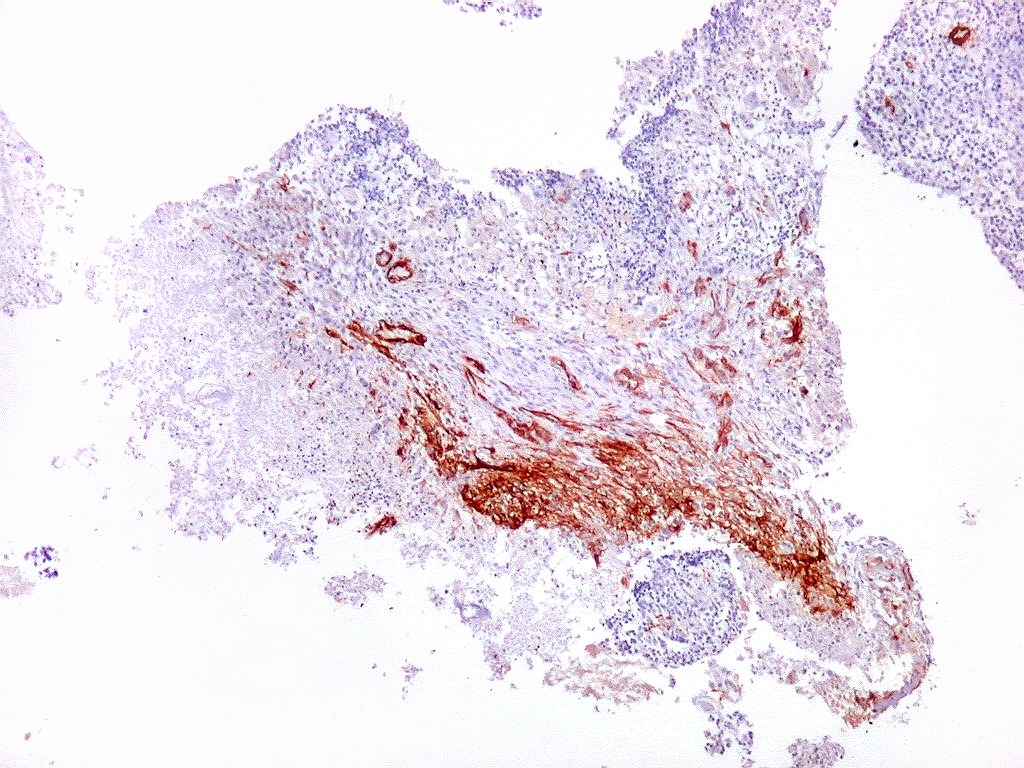
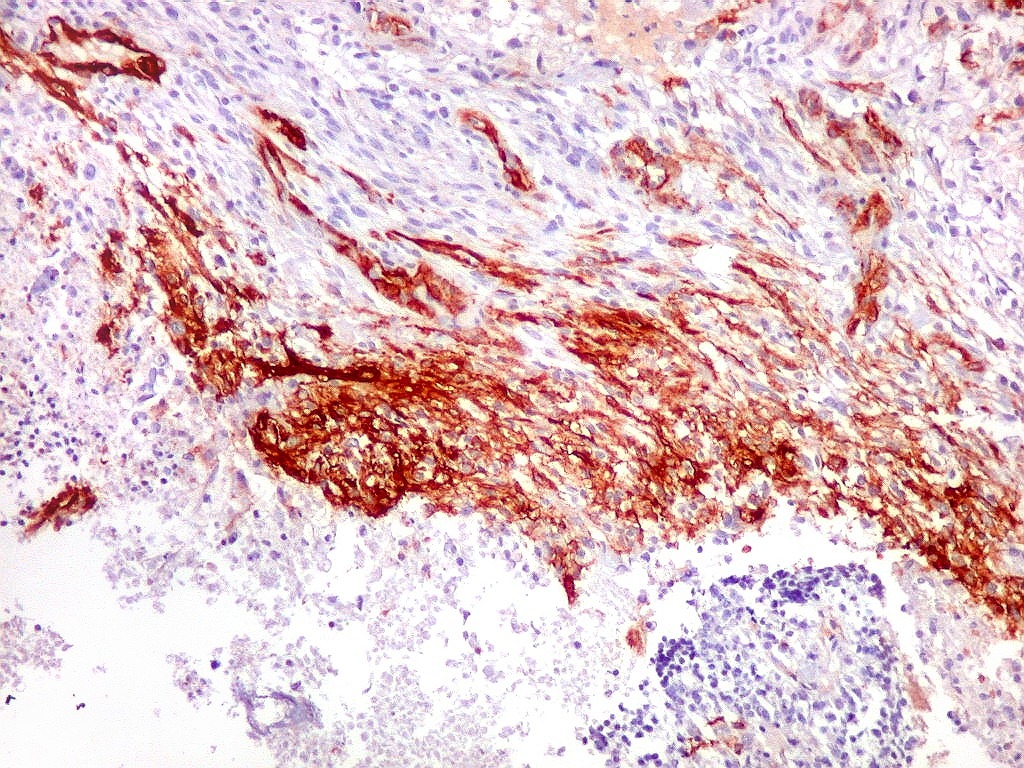
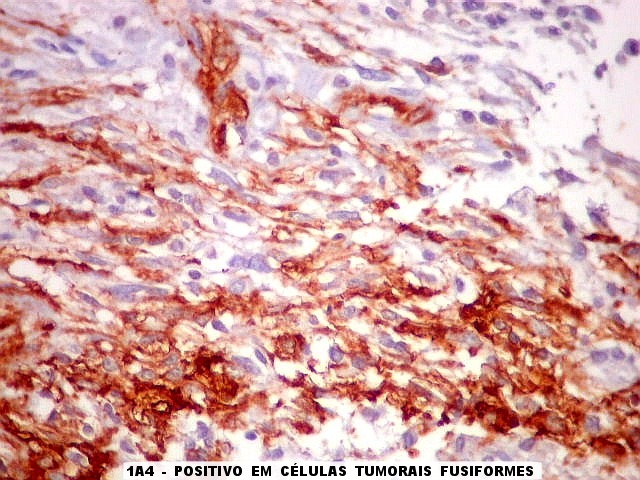
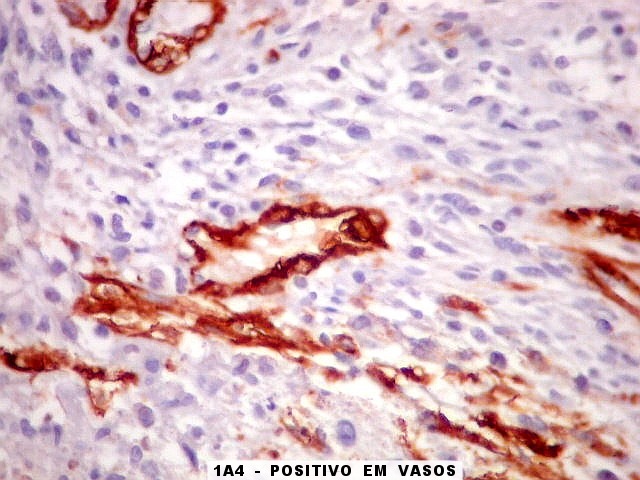
| 1A4.
Foi encontrado um único foco de positividade para este marcador de actina de músculo liso em uma área de células fusiformes. Havia também a já esperada positividade em vasos. Para mais sobre 1A4, clique. Sobre o significado da diferenciação muscular na literatura, clique. |
 |
 |
 |
 |
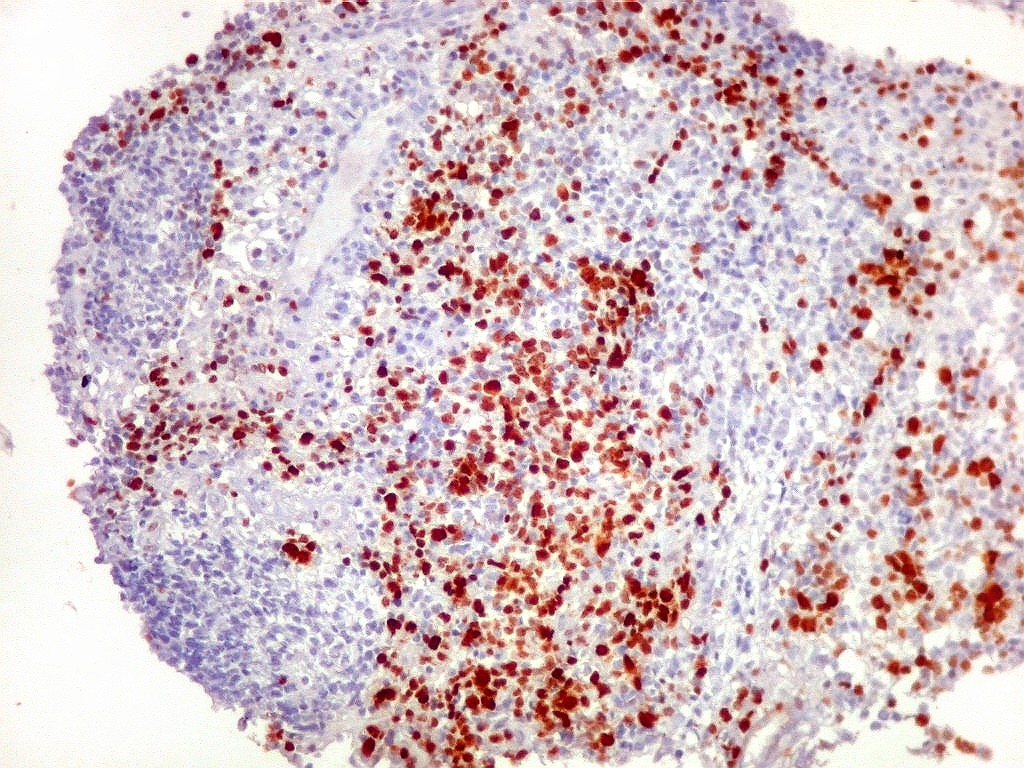
| Ki-67._A exemplo de marcadores anteriores, a positividade para o indicador de proliferação celular Ki-67 foi variável, alternando áreas fortemente positivas, acima de 50%, e outras praticamente negativas. Assim, parece haver áreas de rápida proliferação, ao lado de outras onde as células caminham para diferenciação e estabilidade. Mais uma vez, este aspecto lembra o que pode ocorrer nos meduloblastomas desmoplásicos (1) (2) (3). |
 |
 |
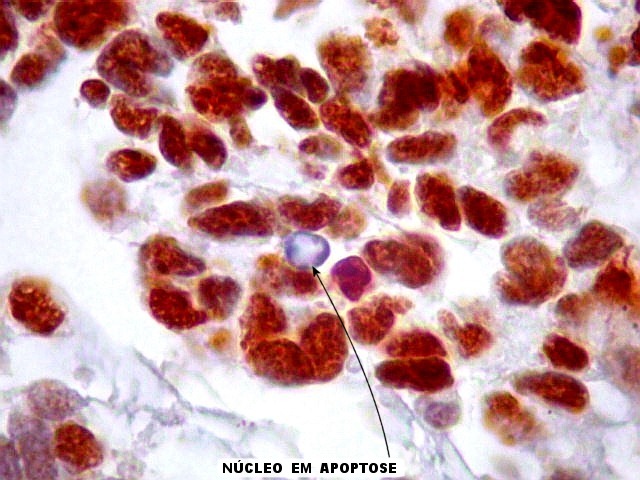 |
| p53._A positividade para esta proteína foi variável, perfazendo em média cerca de 50% dos núcleos tumorais, sugerindo que inativação do gene p53 pode ter tido papel na gênese ou progressão deste tumor. | |
| Obs. Reações positivas não documentadas aqui: proteína S-100 (positividade difusa) e CD57 (padrão semelhante a CD56 e CD99). Negativo para desmina, HHF-35, AE1AE3, CD34 (este positivo só em vasos), NF, cromogranina, LCA. |
| Tumores
neuroectodérmicos primitivos do sistema
nervoso central
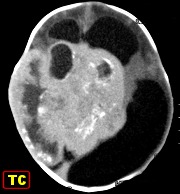
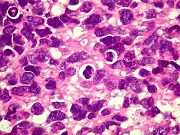
Definição. Tumores neuroectodérmicos primitivos do sistema nervoso central (PNETs do SNC) são um grupo heterogêneo de tumores que predominam em crianças e adolescentes. Podem iniciar-se no cérebro, tronco cerebral ou medula espinal e são compostos por células neuroepiteliais indiferenciadas, pouco diferenciadas, ou que podem apresentar diferenciação divergente ao longo de linhagens neuronal, glial, ependimária, muscular ou melanocítica. Se houver só diferenciação neuronal o tumor é classificado como neuroblastoma. Se houver neurônios maduros (células ganglionares), fala-se em ganglioneuroblastoma. Tumores que recapitulam as feições do tubo neural primitivo são chamados meduloepiteliomas. Tumores com rosetas ependimoblásticas são os ependimoblastomas. Todas as variantes de PNET central se caracterizam por início em idade precoce e crescimento agressivo. Como outros tumores embrionários do SNC, PNETs são considerados grau IV da OMS. Para tumores semelhantes, mas não idênticos, em sítios extracerebrais, usa-se o termo tumor neuroectodérmico primitivo periférico (pPNET) que são considerados sinônimos do, ou intimamente relacionados ao, sarcoma de Ewing. Para exemplos, clique (imagem, patologia). Incidência. É difícil de avaliar, devido à raridade e divergências quanto à classificação. A idade varia de 4 semanas a 20 anos, com média de 5,5 anos. Há discreto predomínio no sexo masculino. Clínica. Os PNETs cerebrais inauguram o quadro com convulsões, hipertensão intracraniana, distúrbios da consciência ou sinais de localização, como déficits motores. Em crianças pequenas pode haver aumento acelerado do perímetro cefálico. Imagem. Formações tumorais iso- ou hiperdensas em TC, com captação de contraste. Podem ser sólidas, com áreas císticas ou necróticas e calcificações. Edema peritumoral geralmente não é imponente. Em RM, são hipo- ou isointensos em T1, hiper- ou isointensos em T2 e impregnam-se por contraste. Macro. Massas volumosas, acinzentadas, moles, mas podem ser firmes se houver um componente desmoplásico. Sua delimitação com o cérebro pode ser nítida ou borrada. Micro.
O PNET clássico é pouco diferenciado, composto por células
com núcleos redondos regulares e escasso citoplasma (relação
núcleo-citoplasma alta). Apesar da densa celularidade, o pleomorfismo
nuclear é escasso. Há pouco fundo fibrilar. Proliferação
microvascular e necroses em pseudopaliçada são geralmente
ausentes.
Imunohistoquímica. Neuroblastomas centrais podem expressar antígenos neuronais como sinaptofisina e neurofilamento. Também expressam proteína S-100, NSE (enolase neurônio-específica) e CD57 (Leu-7). GFAP pode ser positivo em parte das células, indicando diferenciação divergente para astrócitos. Tumores de pequenas células com diferenciação divergente neuronal e astrocitária preenchem um critério essencial para PNET e justificam este diagnóstico. A expressão destes e outros antígenos é extremamente variável de tumor para tumor. O marcador de proliferação celular Ki-67 é alto (até 85% dos núcleos, variando conforme o campo), condizente com o rápido crescimento do tumor. Tumores de pequenas células extracerebelares com diferenciação muscular podem ser considerados: a) como tumores embrionários apresentando diferenciação mesenquimal, à semelhança dos medulomioblastomas (do cerebelo); ou b) como miossarcomas. Porém, se houver reatividade para sinaptofisina e/ou GFAP, a natureza neuroectodérmica do tumor fica estabelecida, ficando justificado o diagnóstico de um tumor embrionário (PNET), em vez de sarcoma (Burger et al., 2002). Raros PNETs centrais (ou tumores intracranianos de pequenas células da infância) podem mostrar imunorreatividade para CD99, nisto se assemelhando aos PNETs periféricos (Burger et al., 2002). Habitualmente são negativos. Microscopia eletrônica. As células são muito indiferenciadas, com poucas organelas. O encontro de vesículas de centro denso (vesículas secretoras) permite o diagnóstico de neuroblastoma, mas sinapses são excepcionais. Genética. Por enquanto não foi identificada uma anormalidade cromossômica ou gênica característica do grupo, mas há indicações de que os eventos genéticos associados aos PNETs supratentoriais são diferentes dos dos meduloblastomas. Tratamento. PNETs são tratados com radioterapia de todo o neuroeixo (quando a idade do paciente permite). Já nos gliomas malignos a RT é feita só no cérebro. Prognóstico. É pior que nos meduloblastomas e ainda mais em crianças menores do que 2 anos. Fontes.
|
| Para mais imagens deste caso: | TC | HE |
 |
 |
| Sobre PNETs do SNC | Características de imagem dos PNETs |
| Neuropatologia
- Graduação |
Neuropatologia -
Casos Complementares |
Neuroimagem
- Graduação |
Neuroimagem -
Casos Complementares |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Patologia - outros aparelhos | Pages in English |
|
|
|
|