|
|
3. Imunohistoquímica. |
|
|
|
3. Imunohistoquímica. |
|
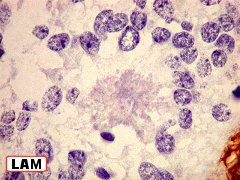
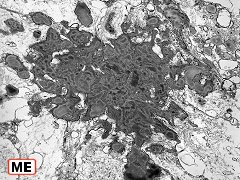
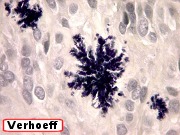
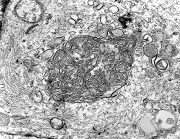
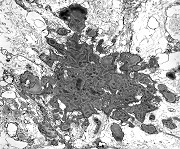
| Quadro comparativo. Imunohistoquímica, microscopia eletrônica. Em imunohistoquímica, o centro das rosetas é positivo para CD57 e colágeno IV, negativo para GFAP, vimentina, CD56, EMA e laminina. Em ME, é eletrodenso e amorfo, com textura compatível com fibras elásticas. Detalhes da ultraestrutura em outras páginas (1) (2). | |||
 |
 |
 |
 |
 |
 |
 |
 |
|
|
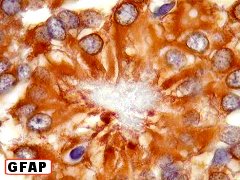
| GFAP. Há forte positividade difusa para GFAP no citoplasma das células neoplásicas, indicando riqueza neste filamento intermediário próprio de astrócitos. As pseudorosetas perivasculares ficam bem evidentes. Vasos não se marcam. |
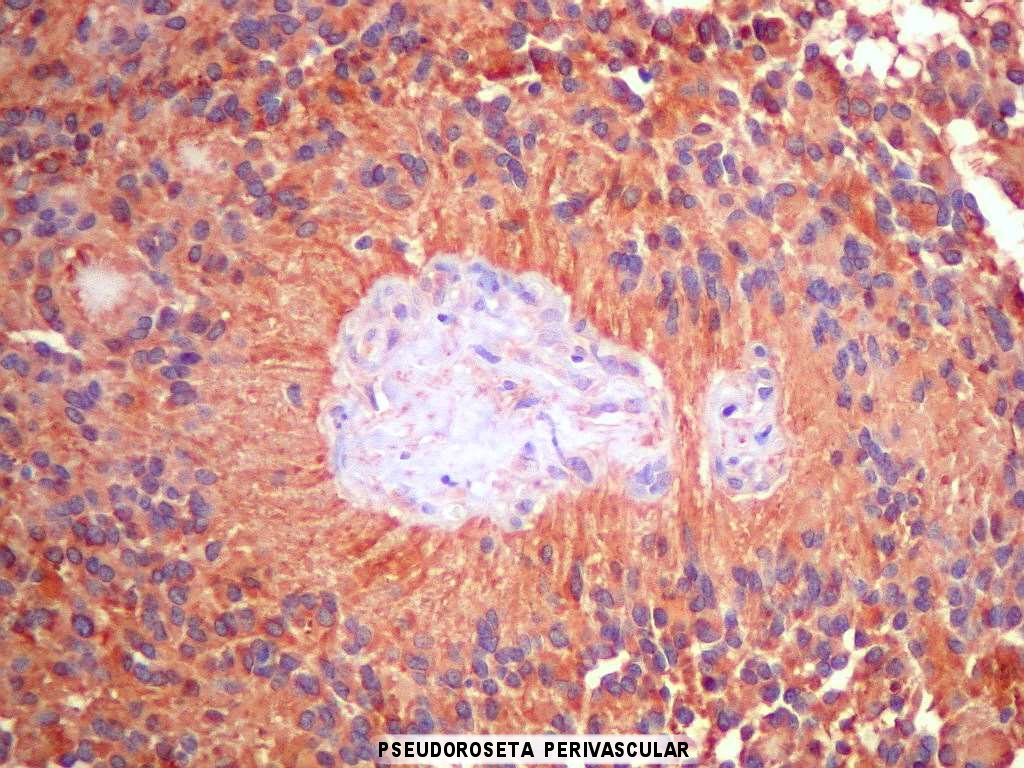 |
| GFAP. Rosetas de centro hialino. O centro hialino das rosetas é negativo para GFAP. As células neoplásicas dirigem seus prolongamentos para estes centros de forma semelhante à observada nos vasos. O resultado sugere que o material no interior das rosetas é extracelular, pois o citoplasma das células ependimárias é fortemente positivo para GFAP. |
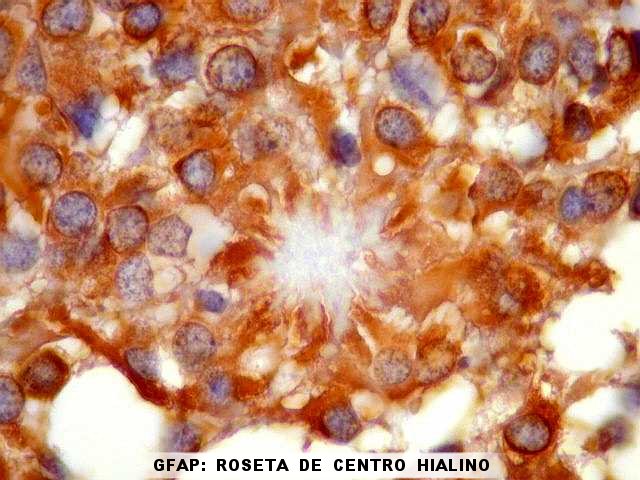 |
|
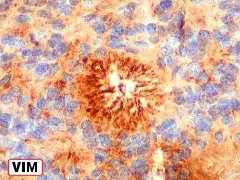
| VIM. As células neoplásicas deste ependimoma mostram menos marcação para vimentina que para GFAP (acima). O centro das rosetas de centro hialino é negativo, mas a periferia é freqüentemente muito positiva. Algumas rosetas em que a positividade é maior podem representar cortes tangenciais. O aspecto sugere que a expressão de vimentina é maior na parte do citoplasma das células adjacente ao material hialino. | |
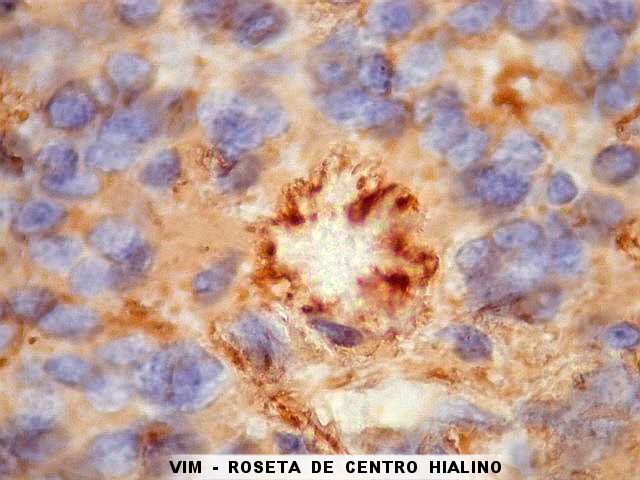 |
|
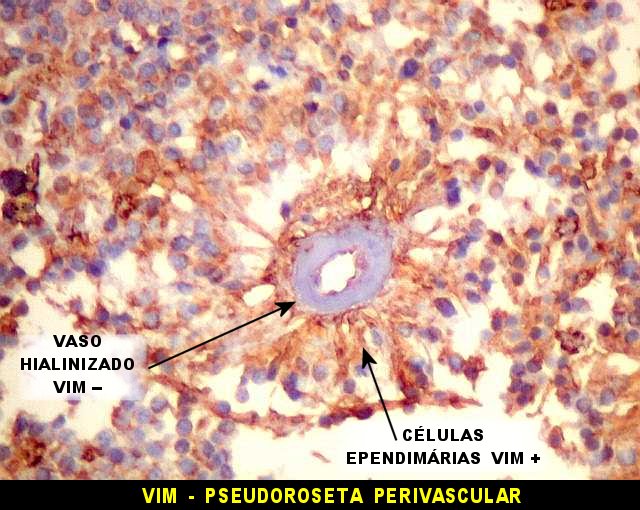 |
|
| AE1AE3. Há positividade para este anticorpo contra queratinas principalmente nos prolongamentos das células que formam as pseudorosetas perivasculares. As rosetas de centro hialino foram negativas. |
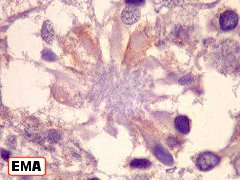
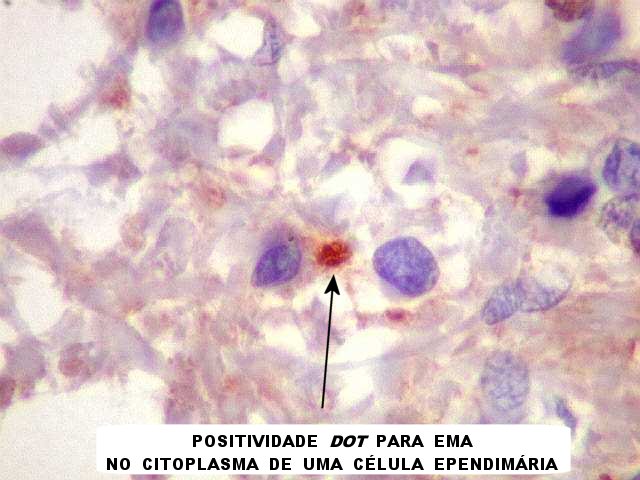
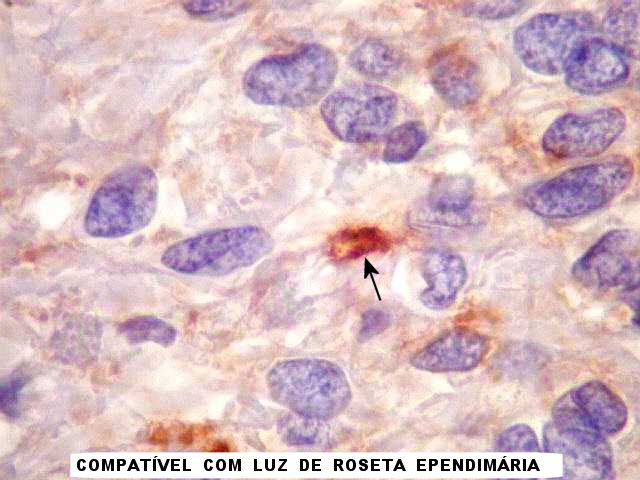
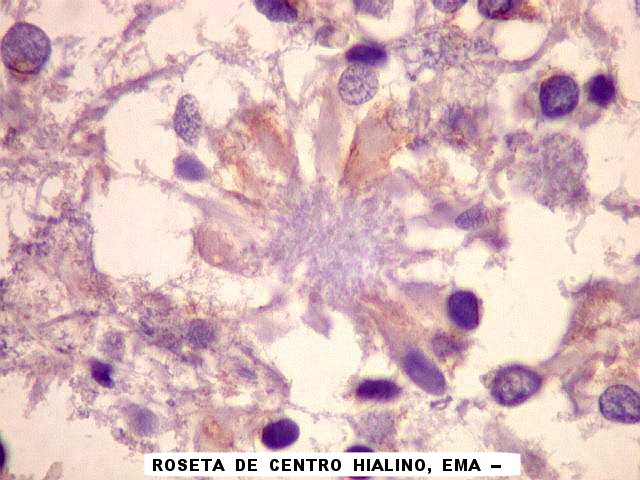
| EMA. Antígeno epitelial de membrana é freqüentemente positivo em ependimomas em padrão dot (um ponto no citoplasma) ou em luzes de pequenas rosetas ependimárias. Aqui há exemplos dos dois tipos. A positividade está situada na membrana de cílios ou microvilos, que são especializações de superfície das células ependimárias. Para ver exemplos destas organelas em microscopia eletrônica neste e em outro caso, clique. As rosetas de centro hialino foram negativas. | |
 |
|
 |
|
 |
|
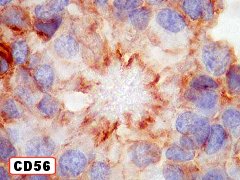
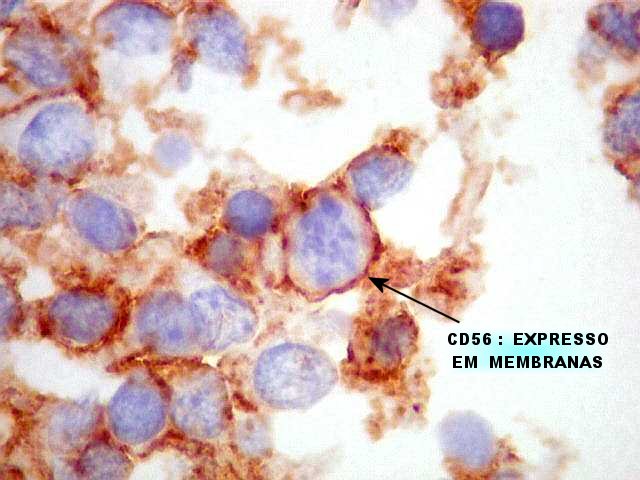
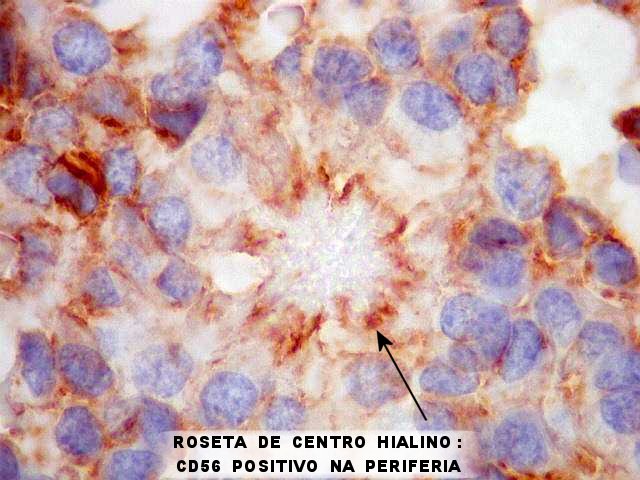
| CD56 (NCAM). Esta molécula de adesão de células neurais é expressada nas membranas das células ependimárias neoplásicas, como geralmente é em gliomas. Os vasos e o centro das rosetas de centro hialino, formado por fibras elásticas, são negativos. Contudo, há positividade na periferia dos centros hialinos, num padrão sinuoso ou radiado, que poderia indicar membranas celulares nesta localização. Observar aspectos ultraestruturais correspondentes nas páginas para microscopia eletrônica (1) (2). Para breve texto teórico sobre CD56, ver fim da página. | |
 |
|
 |
|
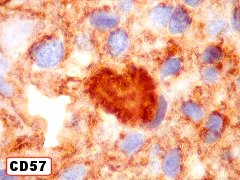
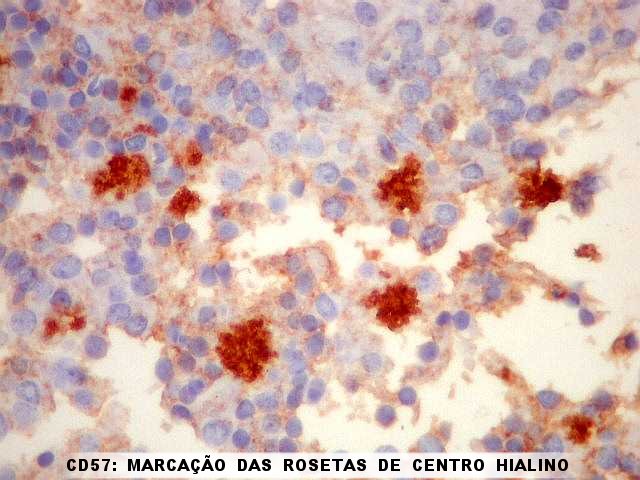
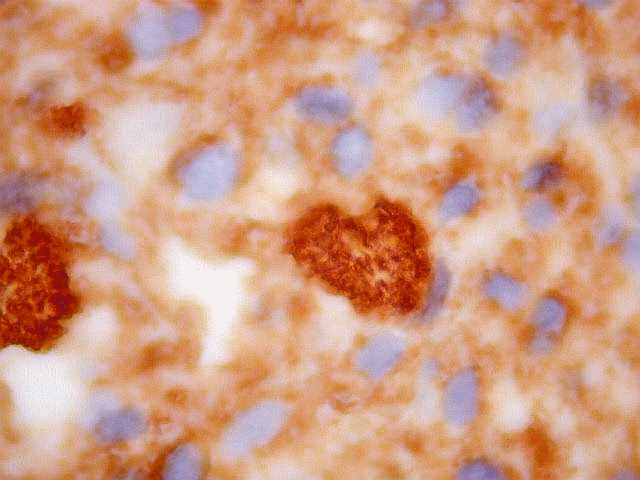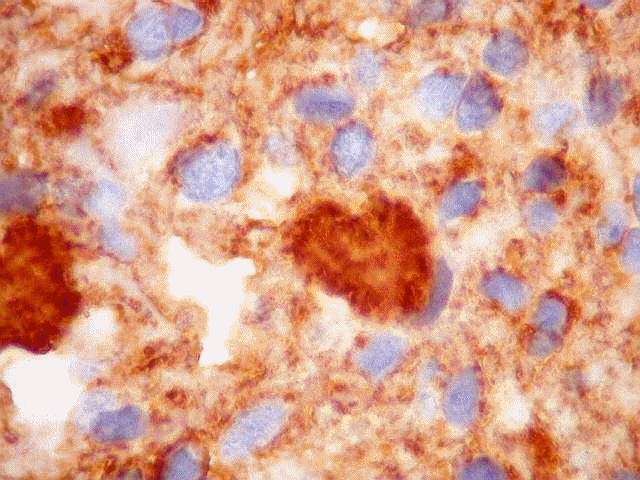
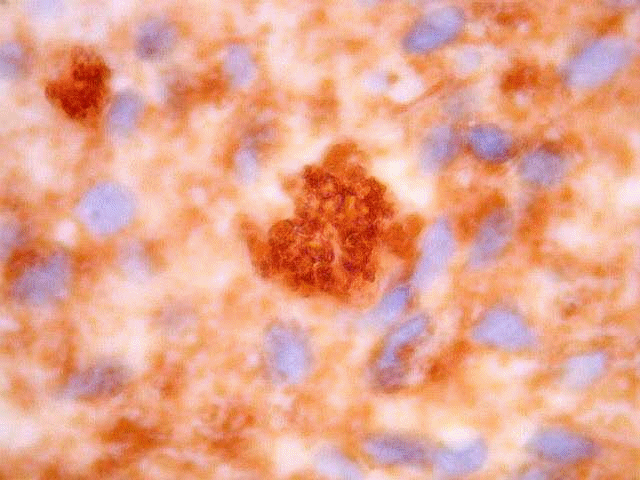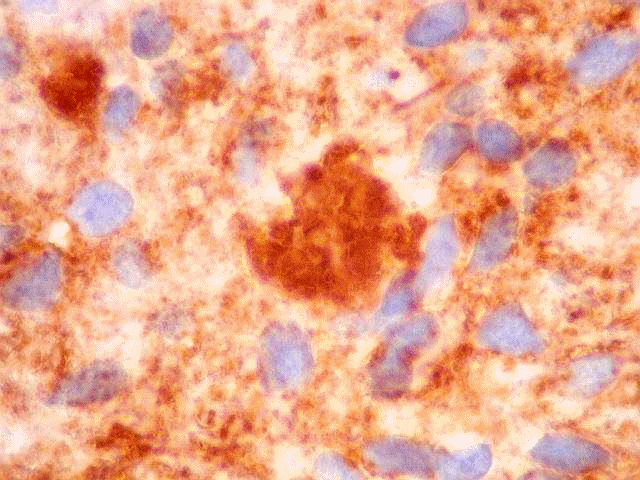
| CD57. Esta molécula de adesão de células neurais é também expressada em diversos tecidos (para breve texto, ver fim da página. Foi positiva de forma variável nas membranas celulares do tumor, e, curiosamente, marcou com constância o centro das rosetas hialinas. O significado do achado nos escapa. Poderia representar restos de membranas no seio do material hialino. | |
 |
|
 |
 |
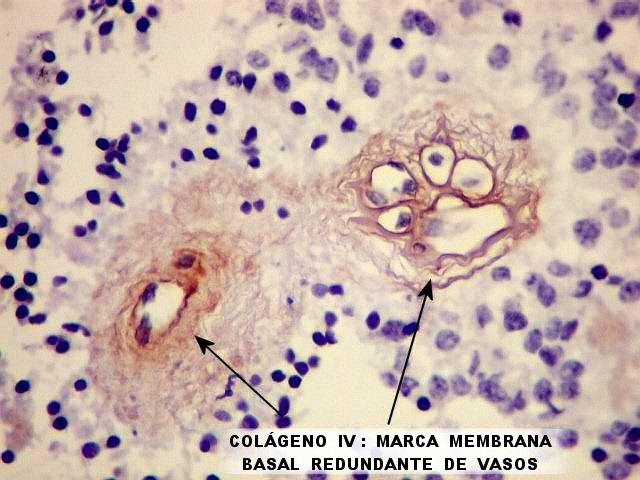
| CD34. Marcando as células endoteliais, destaca os vasos do tumor. Todos outros elementos são negativos, inclusive as rosetas de centro hialino (sugere ausência de restos de células endoteliais nas mesmas). As pseudorosetas perivasculares são salientadas pelos halos anucleados em torno dos vasos, delineados por CD34. |
| Colágeno IV, e laminina (quadro abaixo) são componentes da membrana basal e, por isso, também marcam os vasos tumorais, mas de maneira diferente do CD34 que é positivo especificamente nas células endoteliais. | |
 |
|
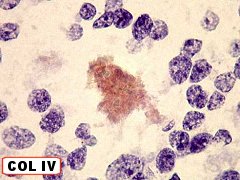
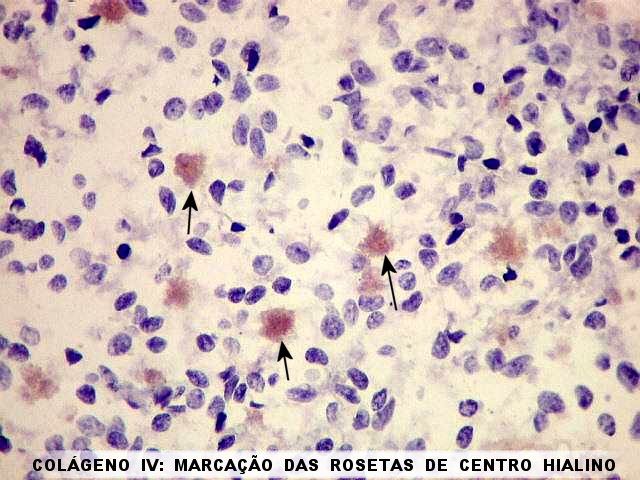
| COL IV, Rosetas de centro hialino. O centro hialino das rosetas é consistentemente positivo para colágeno IV, sugerindo que o material hialino no centro da roseta tenha um componente de membrana basal, possivelmente de vasos que posteriormente degeneraram. | |
 |
|
| Laminina, como colágeno IV, é um componente de membranas basais. Foi positiva nos vasos tumorais de maneira análoga à deste, e demonstra em alguns várias camadas de membrana basal, aparentemente depositada em vários ciclos pelas células endoteliais. | |
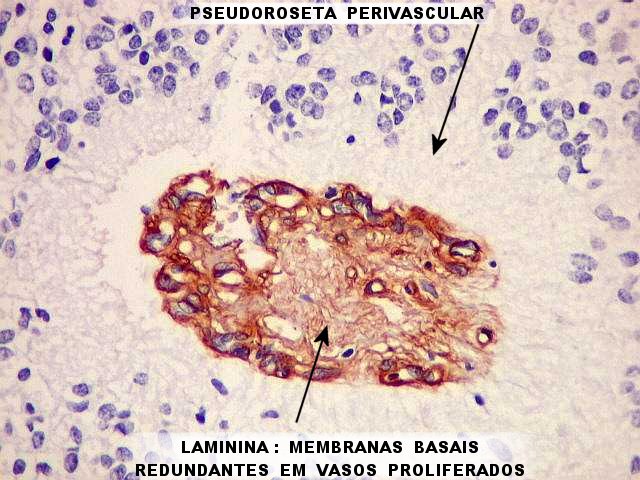 |
|
| Laminina, rosetas de centro hialino. Ao contrário do esperado, contudo, o centro hialino das rosetas foi persistentemente negativo para laminina, mesmo em campos próximos a vasos marcados. A causa desta discrepância nos escapa. | |
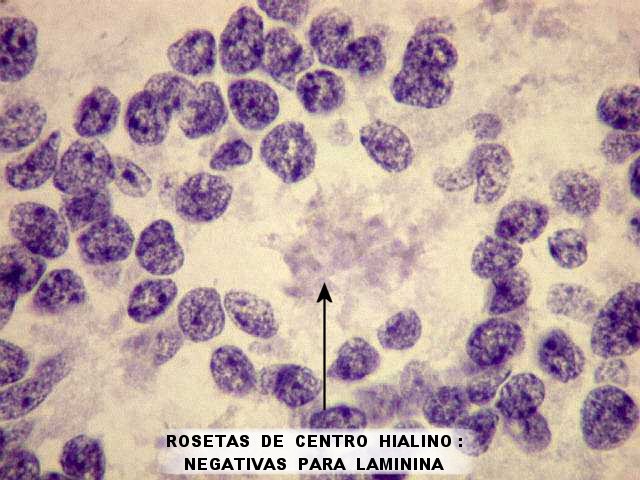 |
|
| Ki-67. Há proporção não desprezível de núcleos marcados, da ordem de 3 - 5% (estimativa sem contagem), indicando crescimento tumoral. |
| CD56 (NCAM).
Também conhecido como NCAM (neural cell adhesion molecule), foi descoberto em pesquisas sobre moléculas de superfície celular que contribuem para interações celulares durante o desenvolvimento do sistema nervoso. Há pelo menos 3 isoformas geradas por splicing diferencial do transcrito do RNA de um único gene no cromossomo 11. O polipeptídeo central de CD56 é a isoforma de 140 kD. Esta é glicosilada e sialilizada de várias formas para produzir espécies maduras com pesos moleculares de 175 a 220 kD. NCAM é amplamente expressado em tecidos neurais e neuroendócrinos, nervos periféricos, zona glomerulosa e camada medular da adrenal e sinapses no córtex cerebral. Glioblastomas, oligodendrogliomas, ganglioglioma, neuroblastoma, retinoblastoma e outros tumores neurais marcam-se fortemente para CD56. A maior aplicação corrente de CD56 é o diagnóstico de linfomas T/NK, pois CD56 é o marcador prototípico de células NK.
Além do sistema nervoso, NCAMs também estão presentes na medula adrenal, camada glomerulosa do córtex adrenal, músculo cardíaco (ver), epitélio folicular da tiróide, túbulos renais proximais, hepatócitos, células parietais gástricas e ilhotas de Langerhans. Entre os tumores, carcinomas papilíferos e foliculares da tiróide, carcinomas de células renais e hepatocarcinomas são NCAM+. O antígeno Leu7, reconhecido pelo anticorpo monoclonal HNK-1, foi identificado como um epítopo carboidrato presente em NCAM e várias outras moléculas de adesão.
CD57 (Leu7, HNK-1) Anticorpos para CD57 detectam uma proteína de 110 kD codificada por um gene no cromossomo 11. Leu7 é a denominação de um clone de células produtoras (laboratório Becton Dickinson). A proteína está presente em alguns linfócitos periféricos, mas não em monócitos, granulócitos, plaquetas ou hemácias. Linfócitos CD57+ aumentam numericamente com a idade e representam 10-20% dos linfócitos em adultos. Incluem um subgrupo de linfócitos T CD8+ e células NK. Além
disso, anticorpos para CD57 reagem com um antígeno presente na mielina
do sistema nervoso central e do periférico, em oligodendrócitos
e células de Schwann. Algumas moléculas de adesão
neural contêm um epítopo carboidrato que é reconhecido
pelos anticorpos para CD57. A reatividade é devida em parte ao fato
de uma glicoproteína associada a mielina ter massa molecular semelhante
à do antígeno CD57 dos linfócitos.
Além das células neurais os anticorpos para CD57 reagem com epitélio prostático, ilhotas pancreáticas e vários outros tecidos e tumores de diversas origens. Devido à sua inespecificidade, CD57 não deve ser empregado isoladamente, mas como parte de painéis de anticorpos para propósitos diagnósticos.
Algumas são glicoproteínas associadas à mielina (MAGs). A maior das MAGs (MAG-72) é relacionada estruturalmente a produtos dos genes da superfamília das imunoglobulinas e a moléculas de adesão neurais. MAGs são proteínas integrais de membrana encontradas normalmente na oligodendroglia. Acredita-se que sua função seja de mediar relações entre axônios, e entre estes e células da glia durante a mielinização. Assim, associação de CD57 com células de Schwann e neoplasias neurais não é de estranhar. CD57 é usado como marcador para tumores de bainhas de nervos periféricos, sarcoma de Ewing e PNETs periféricos. Contudo, CD57 não está restrito a tumores neuroectodérmicos, apenas é mais comumente expressado nestes. Entre outros, sarcomas sinoviais, leiomiosarcomas e alguns carcinomas podem também marcar-se. Em tumores de partes moles, CD57 é valioso na separação de fibrossarcoma contra MPNST (malignant peripheral nerve sheath tumor), fibrohistiocitoma maligno contra MPNST, e tumores mixóides de bainha nervosa, benignos ou malignos, contra tumores mixóides não neurais. Anticorpos contra CD57 reagem em proporções variáveis com tumores neurais, incluindo schwannomas, neurofibromas, neuromas e tumores de células granulosas. Dentre os tumores endócrinos, CD57 é mais usado para tumores neuroendócrinos. Está presente em 100% dos feocromocitomas, 85% dos paragangliomas extraadrenais, 50% dos carcinomas broncogênicos de pequenas células e 85% dos carcinóides de várias origens. Contudo, não está restrito a estes tumores, sendo positivo em 95% dos carcinomas papilíferos e 70% dos carcinomas foliculares da tiróide, e também em carcinomas da próstata, timomas e vários tumores de pequenas células azuis. Por isso, CD57 usado isoladamente não é confiável para identificação específica de tumores neuroendócrinos. Fontes:
|
| Obs. página revisada em abril de 2011. Ler comentário. Caso do Hospital Centro Médico de Campinas, gentilmente contribuído pelos Drs. Antonio Augusto Roth Vargas, Marcelo Senna Xavier de Lima e Paulo Roland Kaleff. |
| Para mais imagens deste caso: | ||||
| RM | HE | colorações especiais | ME geral | ME rosetas |
 |
 |
 |
 |
 |
|
|
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|