|
|
2. Imunohistoquímica |
|
|
|
2. Imunohistoquímica |
|
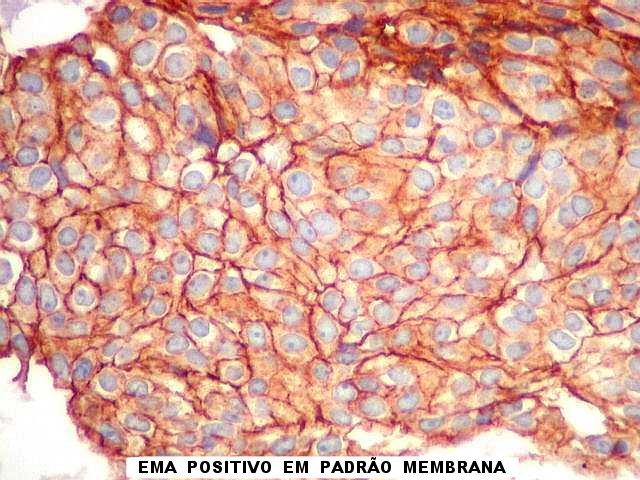
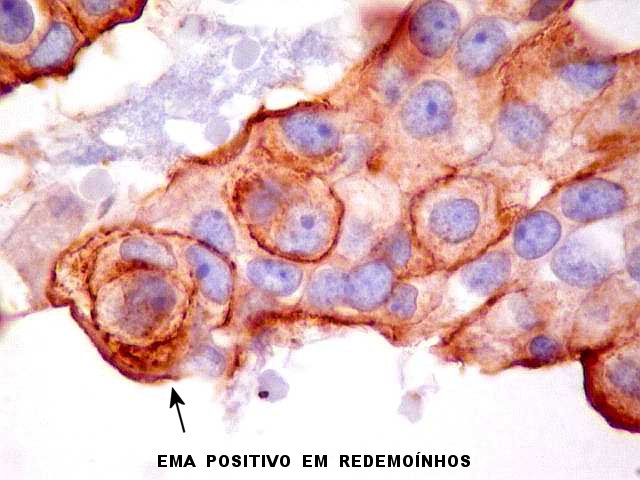
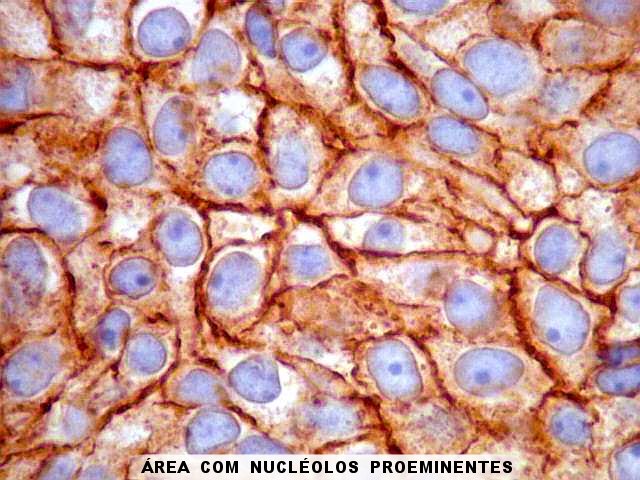
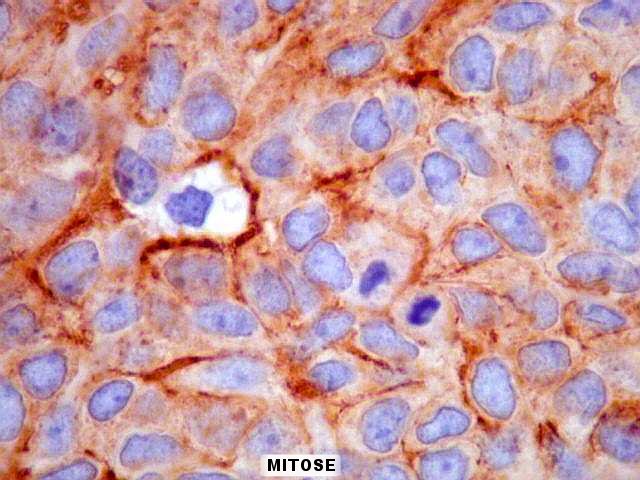
| EMA. Antígeno epitelial de membrana, o principal antígeno pesquisado em meningiomas, foi nitidamente positivo, confirmando o diagnóstico de meningioma neste espécime. A distribuição foi predominante nas membranas celulares, realçando os limites entre as células, inclusive em áreas com redemoínhos. Muitas mitoses foram observadas. | |
 |
|
 |
|
 |
 |
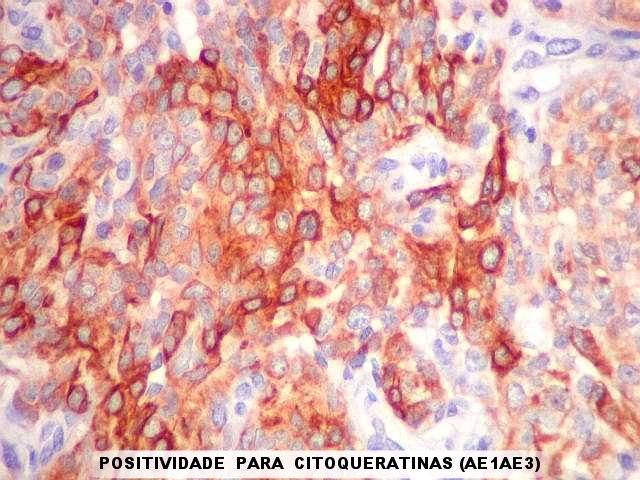
| AE1AE3.
Este
anticorpo reconhece queratinas de alto e baixo peso molecular, e foi aqui
positivo forte em vários focos no tecido neoplásico. Liu
et al. (2004) observaram expressão de citoqueratinas em 75% dos
meningiomas considerados malignos, embora estivesse sempre negativa
nos meningiomas benignos. Em nossa experiência, AE1AE3 também
foi positiva em meningiomas malignos (1)
(2) ou com infiltração
cerebral (3). O mesmo foi observado
em células com diferenciação glandular dos meningiomas
secretores (4) (5).
* Liu Y et al. Expression of cytokeratin by malignant meningiomas: diagnostic pitfall of cytokeratin to separate malignant meningiomas from metastatic carcinoma. Mod Pathol 17: 1129-33, 2004. |
|
 |
|
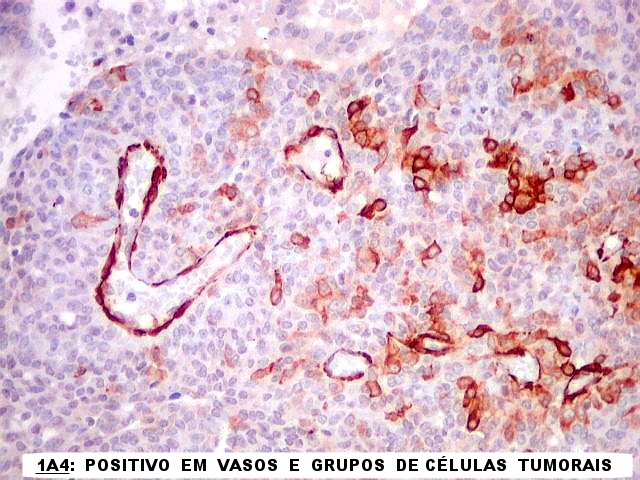
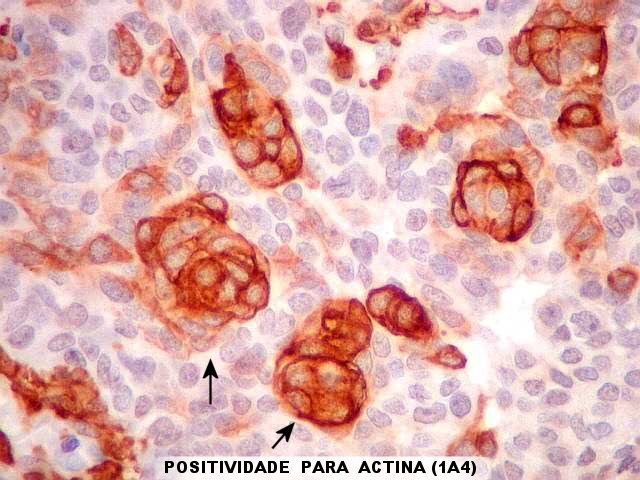
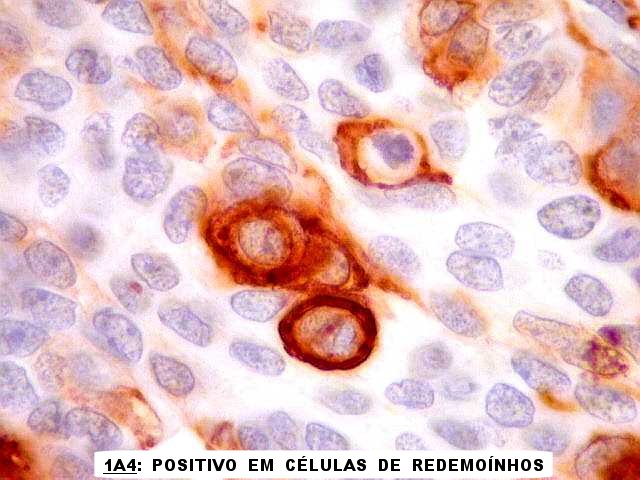
| 1A4.
Este anticorpo para actina de músculo liso foi positivo em grupos
de células neoplásicas, além da esperada positividade
em vasos. Não havíamos antecipado marcação
de células tumorais, mas este achado já foi relatado na literatura.
Tsuchida T et al. (1996) encontraram positividade para actina em 17 de
65 meningiomas. Em 11 a marcação era em células isoladas
e, em 6 casos, em grupos de células que tinham propensão
a formar redemoínhos (tal como no presente exemplo).
Sugita Y
et al. Primary meningeal sarcomas with leiomyoblastic differentiation:
a proposal for a new subtype of primary meningeal sarcomas. Am J
Surg Pathol. 24: 1273-8, 2000.
|
|
 |
|
 |
|
 |
|
 |
|
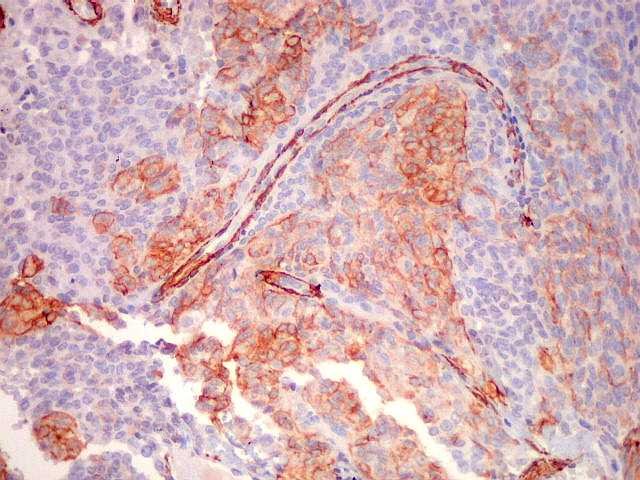
| 1A4. Na maior parte do tumor, a marcação limitava-se a vasos, sendo as células neoplásicas negativas. | 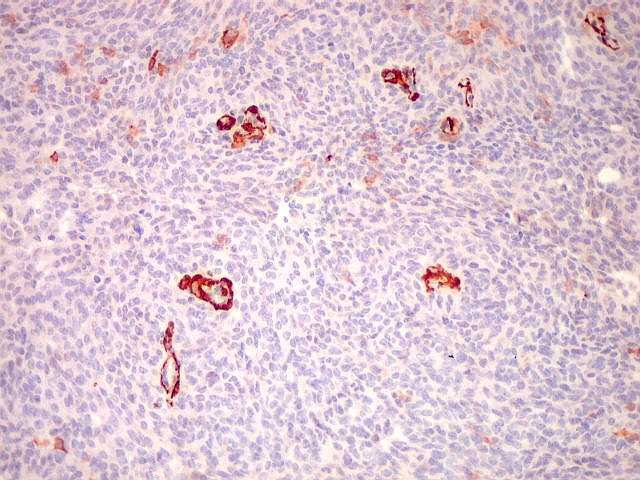 |
 |
|
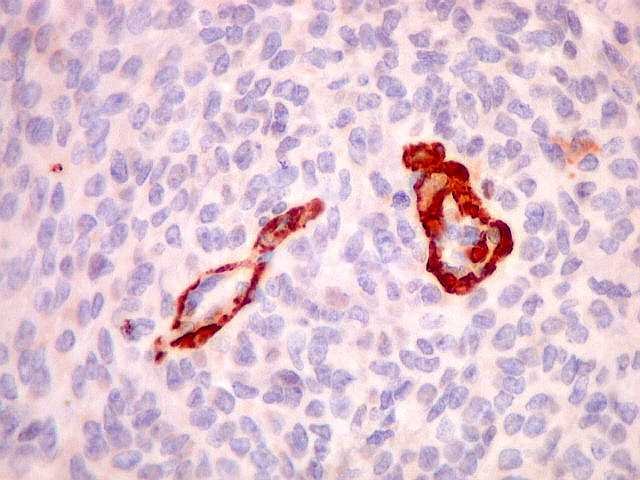
| CD34. Foi positivo apenas em vasos. Mostra que a vascularização do tumor é irregular, com áreas ricas e outras pobres em vasos. Não houve marcação de células neoplásicas, ao contrário do tumor fibroso solitário. | |
| CD99. Foi positivo em membranas e no citoplasma das células neoplásicas em extensas áreas. Já tivemos marcação para CD99 em outros casos de meningioma (1) (2). Como este marcador é freqüentemente usado como critério para diagnóstico de tumor fibroso solitário , recomendamos cuidado na interpretação. | |
| Ki-67. Marcação de elevada proporção dos núcleos, da ordem de 10 a 15%, de acordo com a natureza agressiva da neoplasia. | |
| CEA. Comumente positivo em meningiomas, mas foi negativo em todo o espécime. | |
| RP. Receptor de progesterona, negativo em todo o espécime. | |
| Obs. O tumor foi também negativo para S-100, desmina, BCL-2 e RE (receptor de estrógeno). |
| Classificação
e graduação de meningiomas
A atual classificação da OMS (Louis et al, 2000) para meningiomas contempla três graus de malignidade. A grande maioria dos meningiomas, da ordem de 80 a 90% dos casos, corresponde a OMS grau I, ou seja, são tumores de bom prognóstico com baixo índice de recidivas. Os tipos histológicos mais comuns, ou seja, meningotelial ou sincicial, transicional ou misto e fibroblástico ou fibroso, são habitualmente grau I, assim como vários dos tipos menos comuns ou raros: psamomatoso, angiomatoso, microcístico, secretor, rico em linfócitos e plasmócitos e metaplásico. Os meningiomas
com maior risco de recidiva são classificados como
Critérios para meningioma atípico Os critérios para meningioma atípico são independentes do subtipo histológico (ou seja, pode ser meningotelial ou fibroblástico e ainda assim qualificar como atípico). Esses critérios, já de utilização corrente em livros texto (ver p. ex. Robbins – Cotran, 7ª. Ed, 2005; Sternberger, 4ª. Ed., 2004), baseiam-se nos trabalhos de Perry et al. (1997 e 1999) da Clínica Mayo (Rochester, Minnesota), em mais de 2000 meningioma coletados por mais de 20 anos. Segundo Perry et al (1999), merecem ser chamados de meningioma atípico tumores que atenderem a pelo menos um dos critérios abaixo:
É recomendável que, ao fazer o diagnóstico de meningioma atípico, o patologista enumere numa nota os critérios presentes. Pleomorfismo nuclear não é um critério para agressividade, pois muitos meningiomas clássicos ou benignos mostram núcleos grandes e hipercromáticos, especialmente os microcísticos e angiomatosos. Critérios para meningioma anaplásico Os critérios para meningioma anaplásico na classificação da OMS de 2000 são
Dados adicionais dos trabalhos de Perry et al. (1997; 1999). Estes são trabalhos de grande importância, que fundamentam a atual graduação dos meningiomas segundo a OMS (2000). O primeiro trabalho de Perry et al. (1997) baseou-se em 581 meningiomas operados na Clínica Mayo entre 1978 e 1988, acompanhados até o óbito ou por um período mediano de 9 anos. Os motivos dos limites de data foram que os pacientes deveriam estar dentro da era da tomografia computadorizada e ter tempo suficiente de seguimento. Idade variou entre 5 e 93 anos (mediana 57). Sexo: 2 mulheres para 1 homem. Recidiva em meningiomas. É de concordância geral que meningiomas incompletamente ressecados tendem a recidivar. O risco de recidiva foi significativamente maior em pacientes com ressecção parcial, sendo este é o principal elemento prognóstico. Fatores anatômicos, como locais adversos (e.g. base do crânio), crescimento em placa, invasão óssea, de tecidos moles ou de seios durais, tornam ressecção total improvável e falam contra cura cirúrgica completa. Ressecção
macroscopicamente total foi obtida em 463 casos (79,5%), com índices
de recidiva de 5 anos de 12% e 10 anos de 25%.
Fatores clínicos associados com diminuição do tempo livre de doença foram: idade jovem (< 40 anos), sexo masculino e envolvimento das vias ópticas anteriores. Parâmetros macroscópicos desfavoráveis em pacientes com ressecção total foram o crescimento em placa, invasão de tecidos moles e de seios durais. Contudo, estes fatores não foram significativos nos com ressecção subtotal. Invasão
microscópica do cérebro esteve fortemente associada com
diminuição do intervalo livre de doença. Uma
vez este parâmetro estando presente, todas outras variáveis
perderam importância.
Não houve associações significativas entre variedades histológicas específicas, como meningotelial, transicional, etc., e intervalo sem recidiva. Variedades classicamente consideradas mais agressivas como meningioma papilífero e meningioma de células claras compreendiam cada uma menos de 1 % dos casos. Recidivas após 5 anos foram 12% nos meningiomas clássicos, 41% nos atípicos e 56% nos com invasão cerebral. A diferença entre estes dois últimos, porém, não foi estatisticamente significante. Isto levou à inclusão de invasão cerebral como critério adicional para meningioma atípico no segundo trabalho (Perry et al., 1999). Como meningiomas atípicos e anaplásicos são raros, Perry et al. (1999) ampliaram sua casuística com 116 pacientes com meningiomas malignos. Os critérios de inclusão foram invasão cerebral, anaplasia franca e/ou metástases extracranianas. 64 casos (55%) eram da Mayo Clinic, coletados entre 1970 e 1997, de um total de 2161 meningiomas. Outros 52 (45%) foram casos de consulta. Anaplasia foi definida como 20 ou mais mitoses por 10 CGA consecutivos ou histologia semelhante a carcinoma, sarcoma ou melanoma, focal ou difusamente. Os 116 pacientes apresentaram 119 meningiomas primários e 94 recidivas. Lâminas foram revistas em 179 tumores (84%), dos quais 149 (84%) preencheram um ou mais critérios de malignidade: invasão cerebral em 118 (79%), anaplasia em 47 (32%), metástases extracranianas em 8 (5%). Pacientes com diagnóstico de malignidade tinham idades de 10 a 88 anos (mediana 60) e 54 % eram do sexo masculino. Variantes associadas freqüentemente com comportamento agressivo incluíram a papilífera, rabdóide e de células claras. As taxas de mortalidade de 5 e 10 anos foram 38 e 53 %. A sobrevida mediana foi de 7,5 anos no geral e 1,5 anos para meningiomas francamente anaplásicos. A mortalidade aos 5 anos foi 68%, com metástases extracranianas desenvolvendo-se em 3 dos 27 pacientes. Dos meningiomas que invadiam o cérebro, 23% eram benignos (exceto pela invasão), 61% atípicos e 17% francamente anaplásicos. A mortalidade de 5 anos para estes foi de 27, 25 e 83% respectivamente e a sobrevida mediana foi 14,9, 10,4 e 1,4 anos. Com isso, na pratica, a categoria de meningiomas atípicos aumentaria para cerca de 18% dos casos (na casuística dos autores), devido à inclusão de invasão cerebral como critério. Seriam consistentes com classificação como grau II pela OMS. A categoria de anaplásicos corresponde a apenas 1% de todos meningiomas. Como têm uma sobrevida mediana de 1,5 anos e mortalidade de 5 anos de 68%, são consistentes com grau III ou IV na classificação da OMS. Referências. Frosch MP, Anthony DC, De Girolami U. The central nervous system. in Kumar V, Abbas AK, Fausto N (eds), Robbins and Cotran Pathologic Basis of Disease, 7th Ed, Elsevier Saunders, Philadelphia, 2005. pp. 1347-419. Ironside JW, Moss TH, Louis DN, Lowe JS, Weller RO. Diagnostic Pathology of Nervous System Tumours. Churchill Livingstone, London, 2002. pp. 343-82. Louis DN, Scheithauer BW, Budka H, von Deimling A, Kepes JJ. Meningiomas. in Kleihues P, Cavenee WK (eds). Tumours of the Nervous System. Pathology and Genetics. WHO Classification of Tumours. IARC Press, Lyon, 2000. p. 176-84. McKeever PE, Boyer PJ. The brain, spinal cord, and meninges. in Mills SE (ed). Sternberg’s Diagnostic Surgical Pathology. 4th Ed. Lippincott Williams & Wilkins, Philadelphia, 2004. pp 399-503. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. Meningioma grading. An analysis of histologic parameters. Am J Surg Pathol 21: 1455-65, 1997. Perry A, Scheithauer BW, Stafford SL, Lohse CM, Wollan PC. “Malignancy” in meningiomas. A clinicopathologic study of 116 patients, with grading implications. Cancer 85: 2046-56, 1999. |
| Caso gentilmente contribuído pelo Dr. Antonio Augusto Roth Vargas e equipe, Campinas, SP. |
| Para mais imagens deste caso: | TC, RM | HE, colorações |
 |
 |
| Características de imagem dos meningiomas | Neuroimagem: meningiomas por topografia | Neuropatologia dos meningiomas | Sobre meningiomas agressivos |
| Meningiomas mais raros: | Cordóide | Rico em linfócitos e plasmócitos | Secretor | Microcístico | Angiomatoso |
| Neuropatologia
- Graduação |
Neuropatologia -
Casos Complementares |
Neuroimagem
- Graduação |
Neuroimagem -
Casos Complementares |
Correlação
Neuropatologia - Neuroimagem |
|
|
|
|