|
|
3. Área de glioblastoma multiforme. Imunohistoquímica para CD34, 1A4, Ki67, p53. |
|
|
|
3. Área de glioblastoma multiforme. Imunohistoquímica para CD34, 1A4, Ki67, p53. |
|
| Masc. 63
a. Clique para dados clínicos,
RM, espécime macro.
Microscopia :
Área de glioblastoma. HE, Masson, reticulina, GFAP, NF, SNF, cromogranina, CD34, 1A4, Ki67, p53. Área de gliossarcoma. HE, Masson, reticulina, GFAP, S-100, VIM, CD34, 1A4, Ki67, p53. |
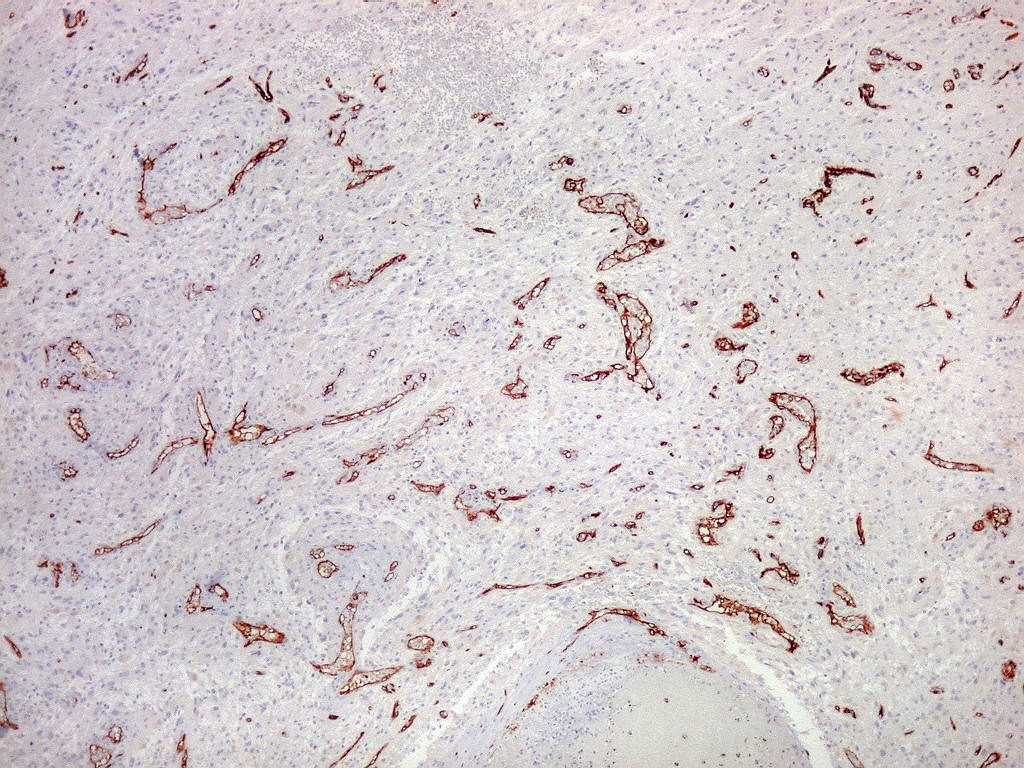
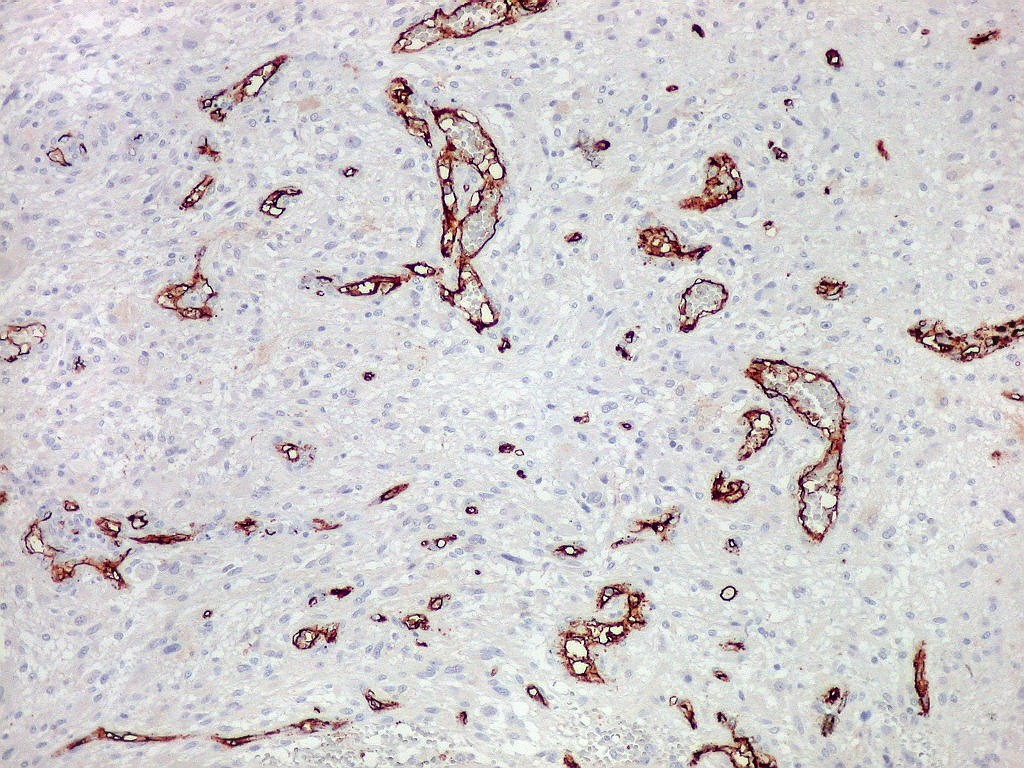
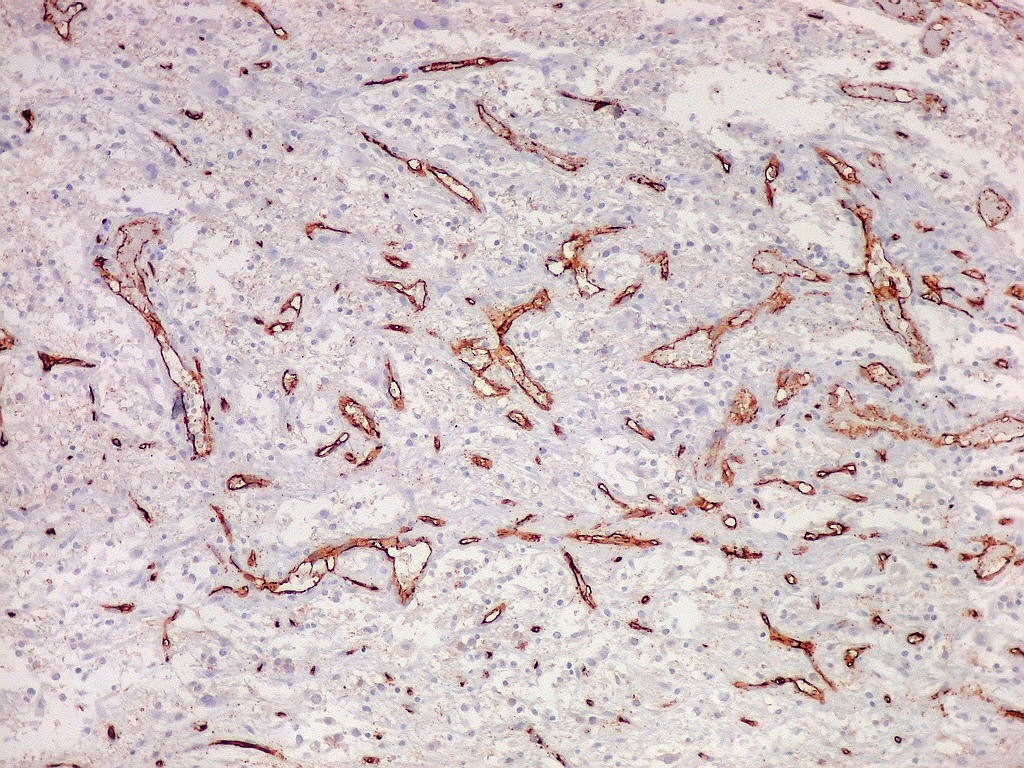
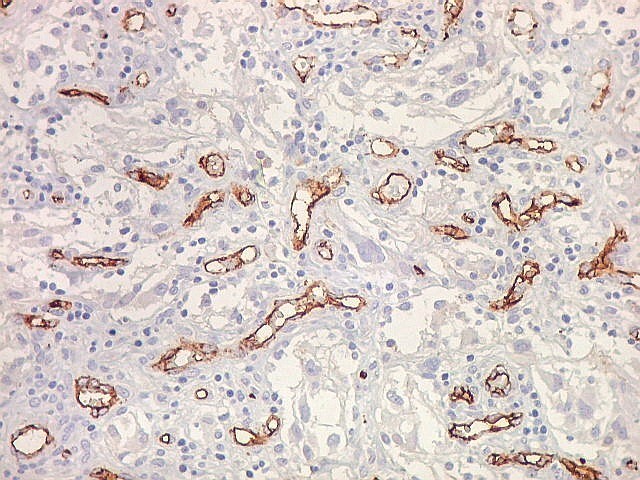
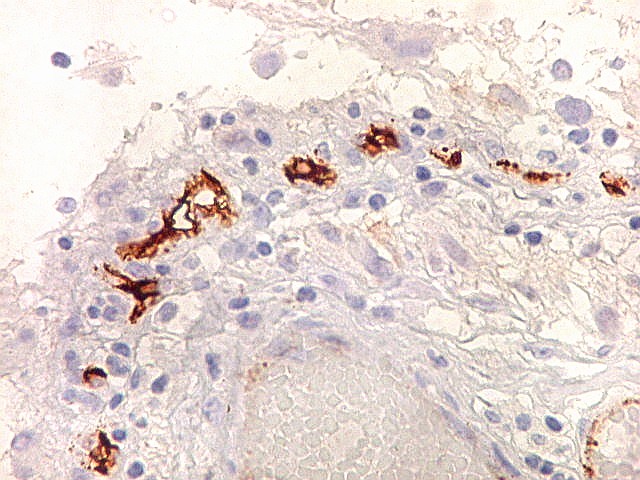
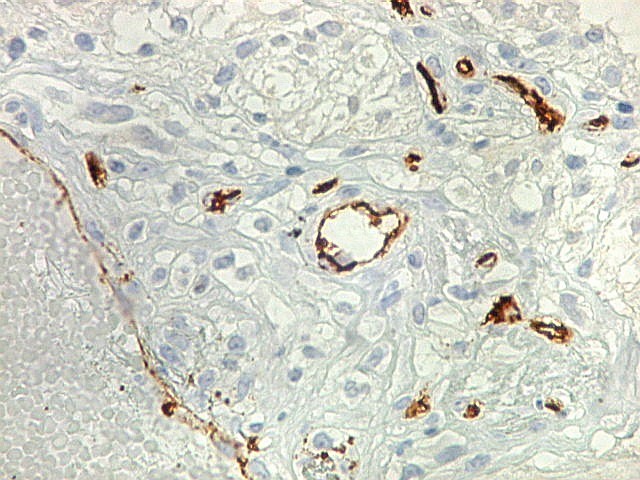
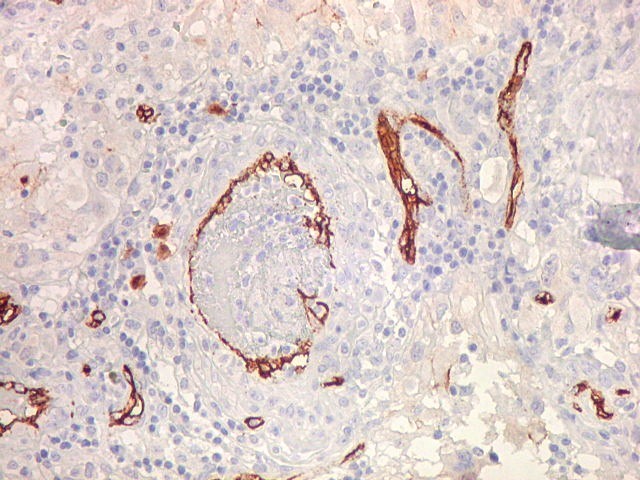
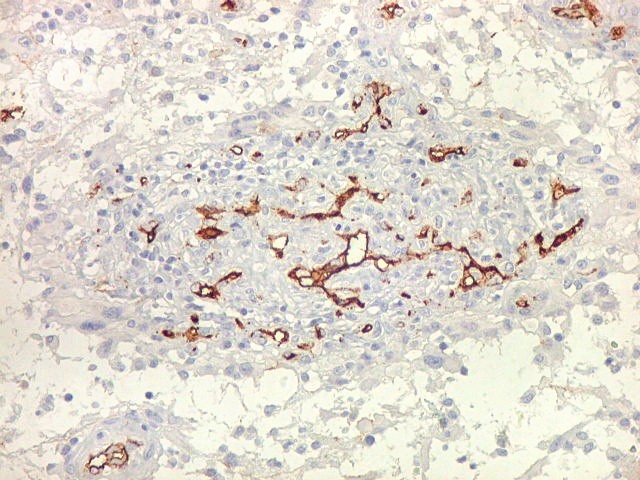
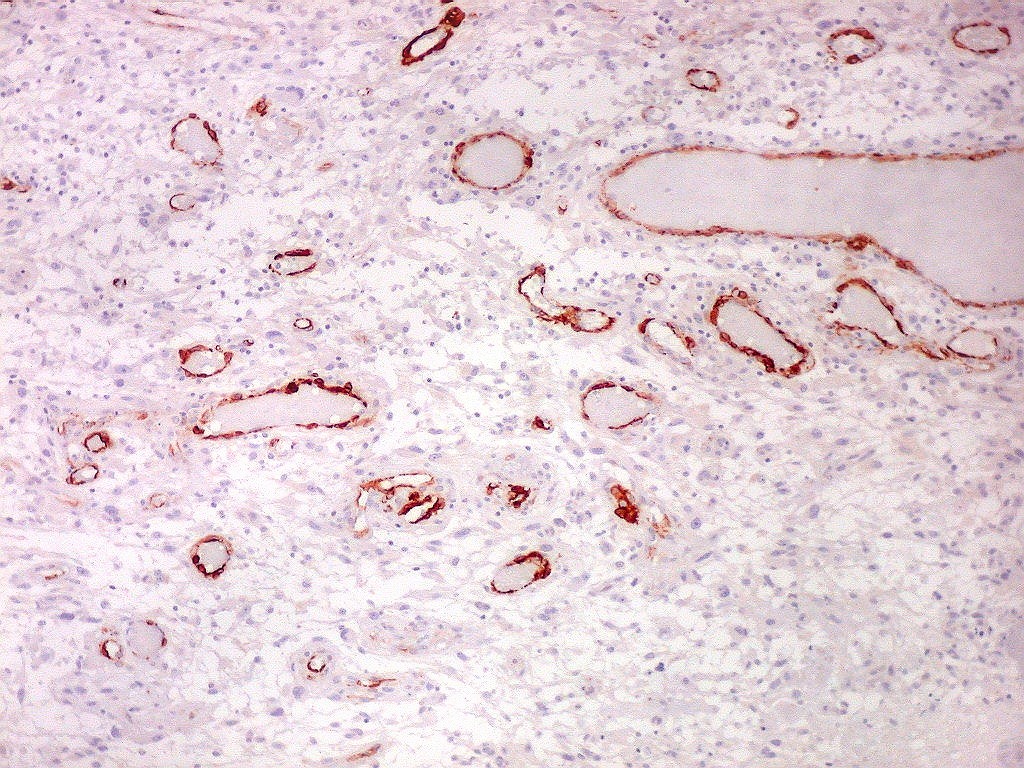
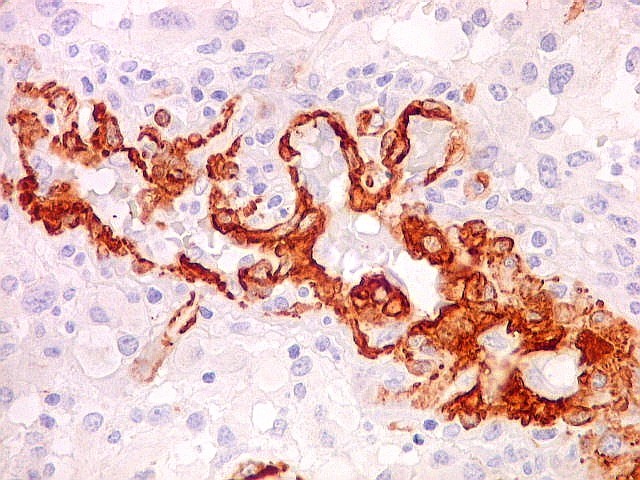
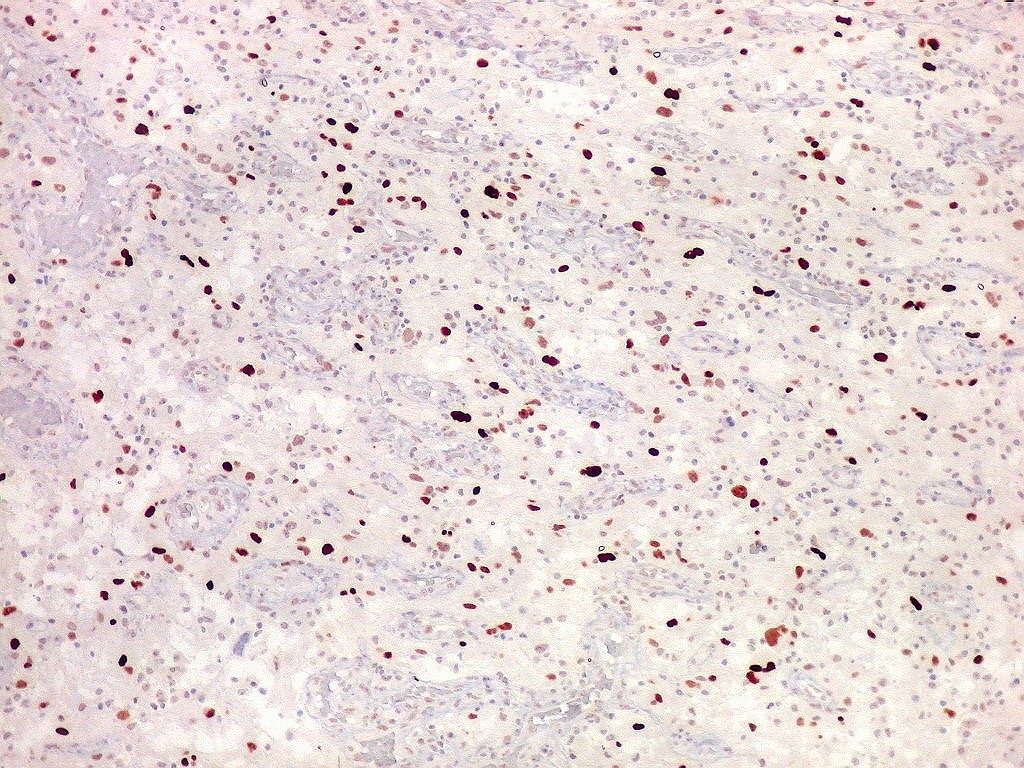
| CD34. Este antígeno (para mais informações, expressão em tumores neuroectodérmicos e outros, clique) é largamente usado como marcador do endotélio vascular, onde delineia a face luminal das células endoteliais. Marca capilares proliferados neste glioblastoma multiforme, realçando a extrema vascularização do tumor. O resultado é paralelo aos observados com tricrômico de Masson e reticulina. |
 |
 |
 |
 |
 |
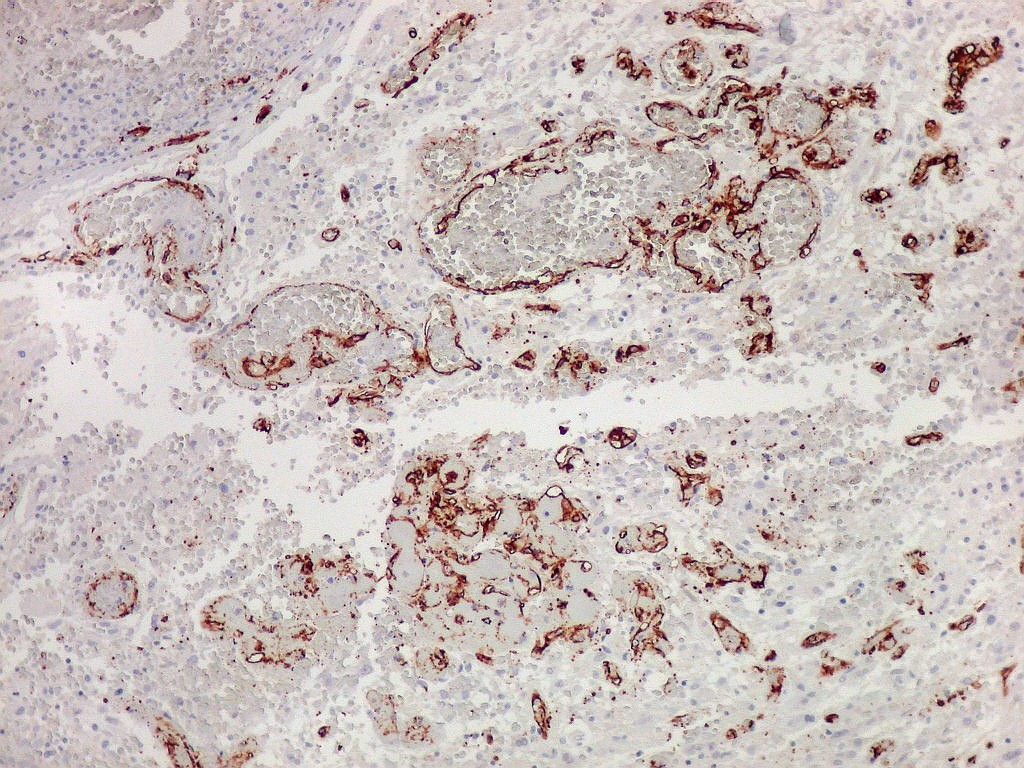
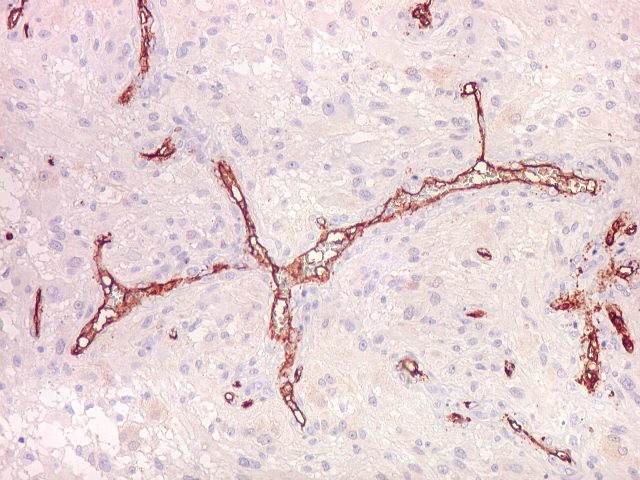
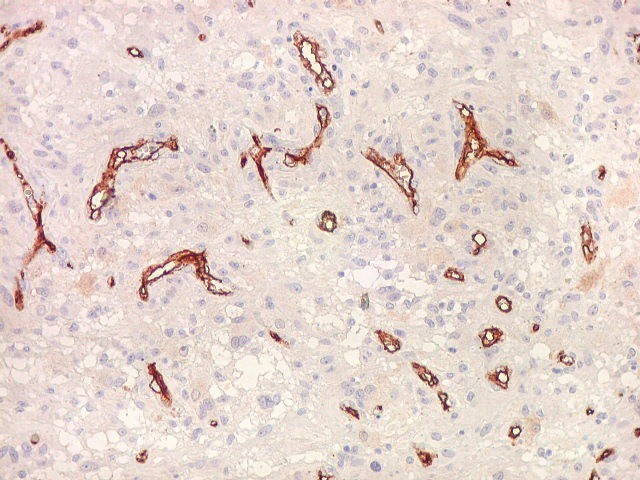
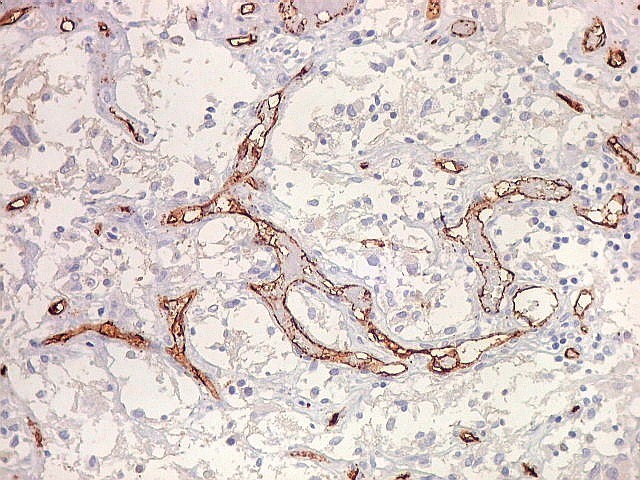
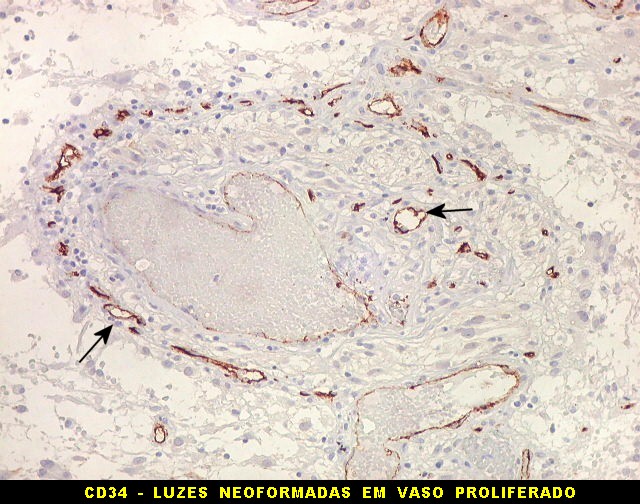
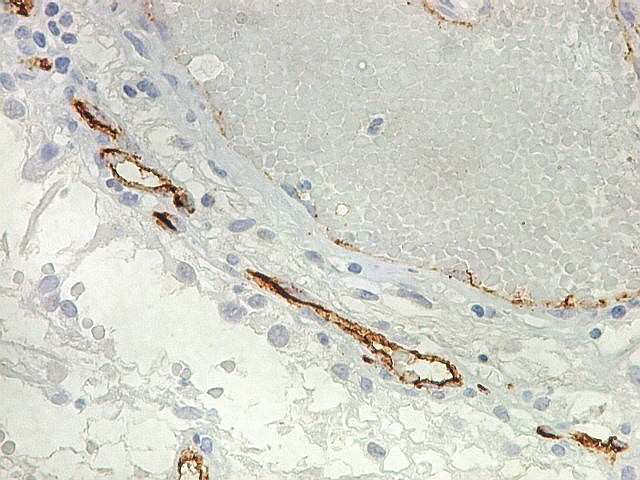
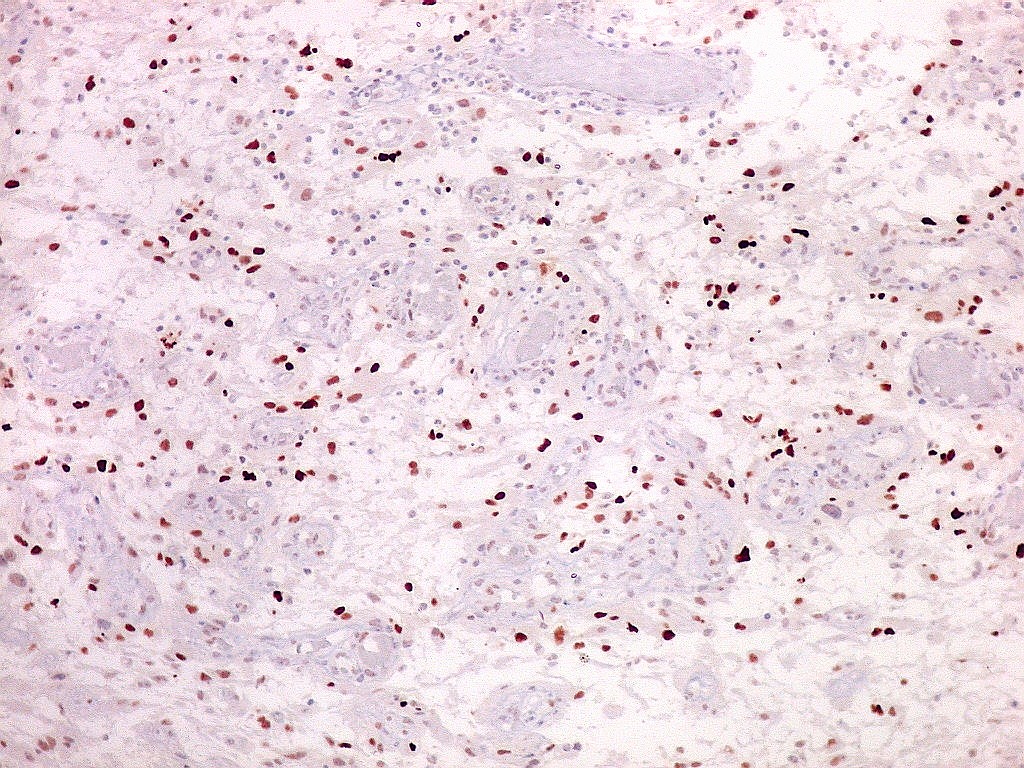
| CD34. Mostra irregularidades na luz dos capilares proliferados. Delimita a luz original destacando trombose. Demonstra luzes secundárias entre as próprias células endoteliais proliferadas, o que leva à formação de pseudoglomérulos, como já notado com tricrômico de Masson e reticulina. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
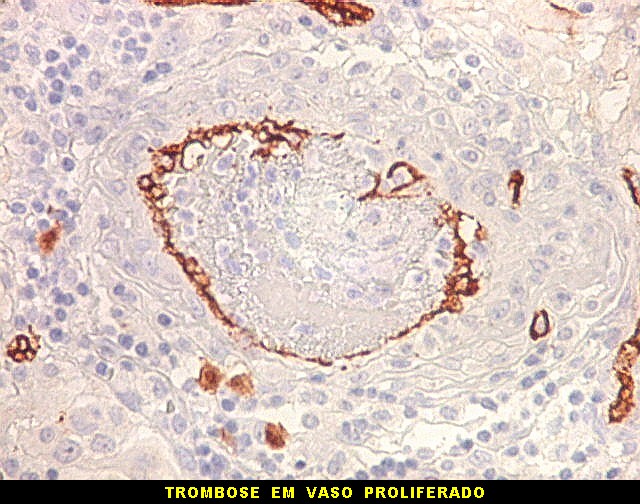 |
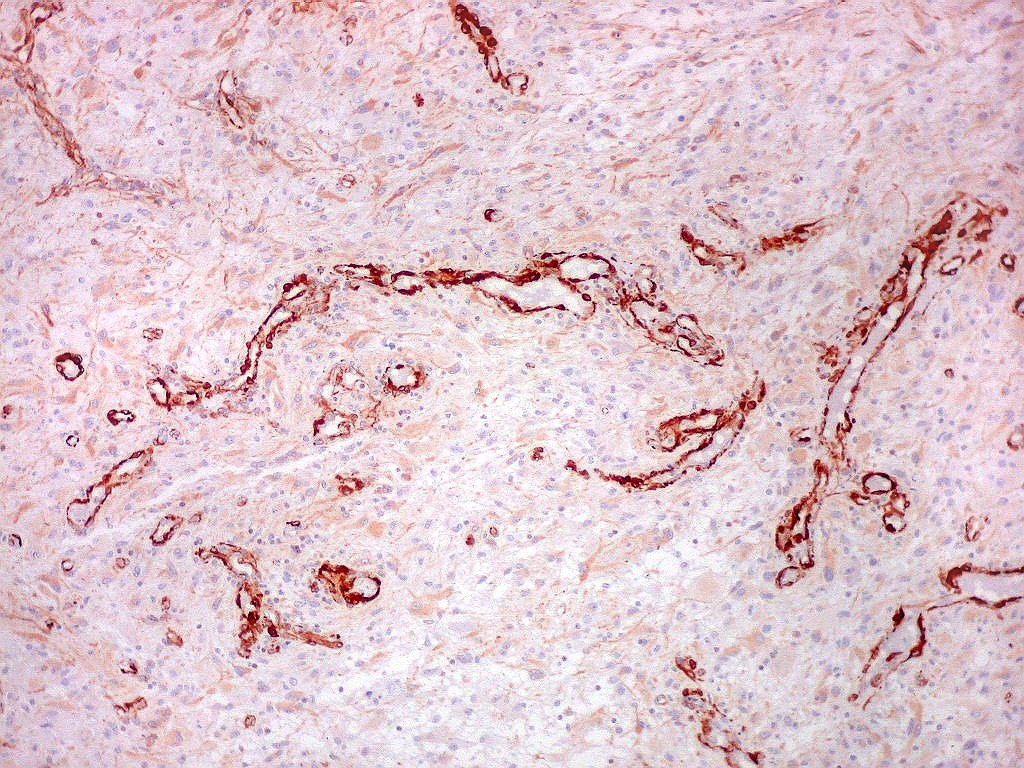
| CD34.
Luzes neoformadas em vaso com proliferação endotelial (formação de pseudoglomérulo). |
 |
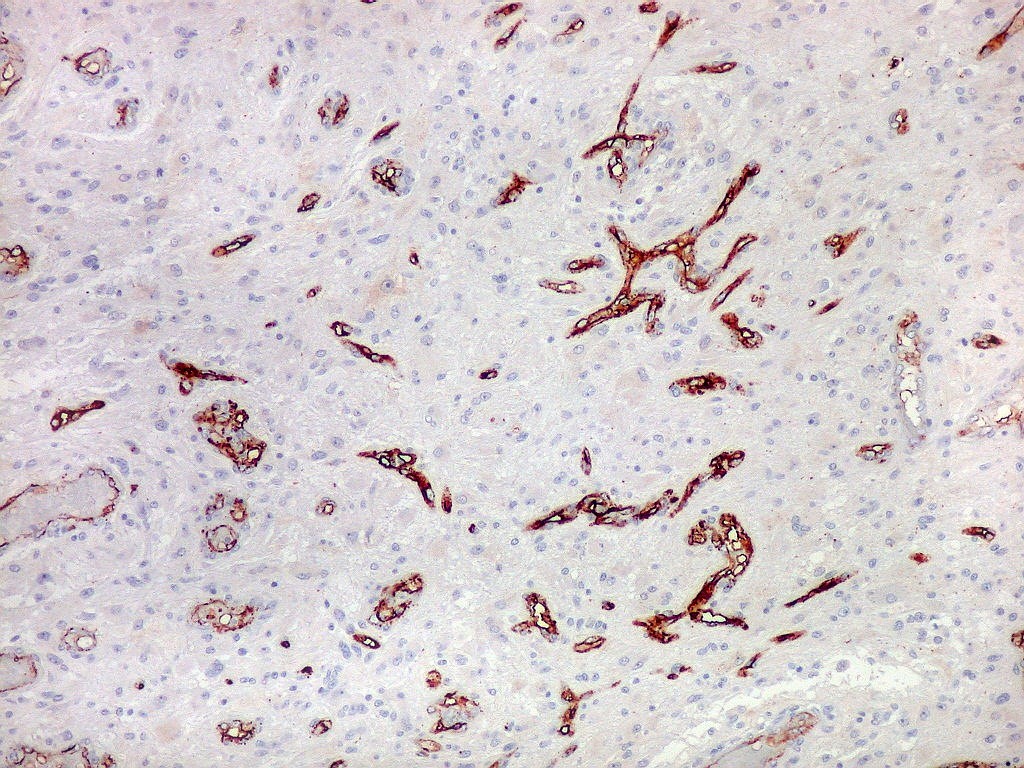
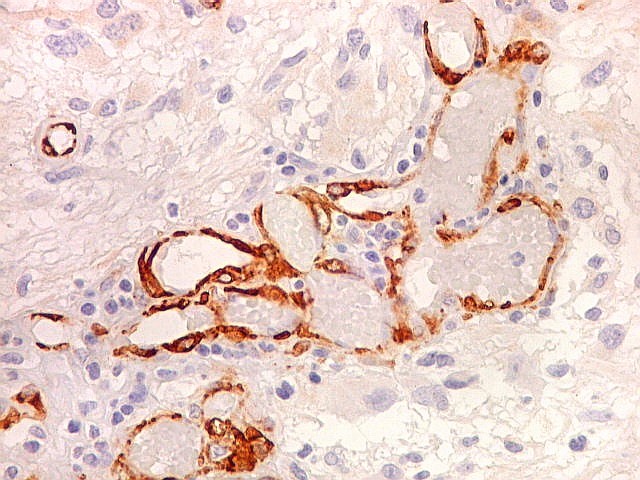
| 1A4, um antígeno que reconhece actina de músculo liso (para breve texto clique) foi usado neste caso para pesquisa de células sarcomatosas ou com diferenciação muscular no glioblastoma, em vista da presença do gliossarcoma em outra área. Em ambos componentes do tumor foram demonstradas apenas células musculares lisas de vasos. O resultado no glioblastoma assemelhou-se ao obtido com CD34. |
 |
 |
 |
 |
 |
 |
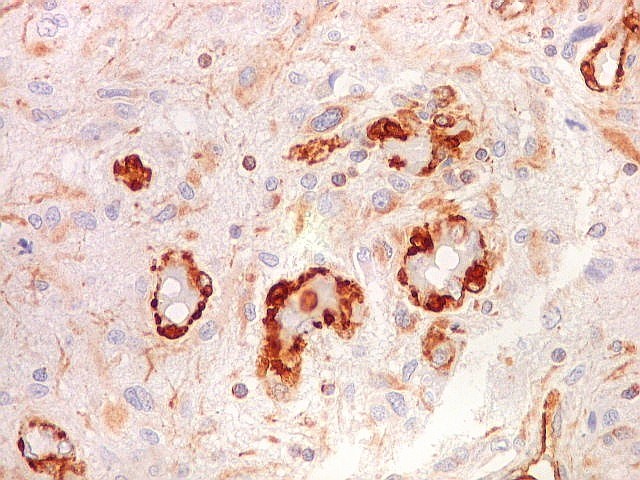
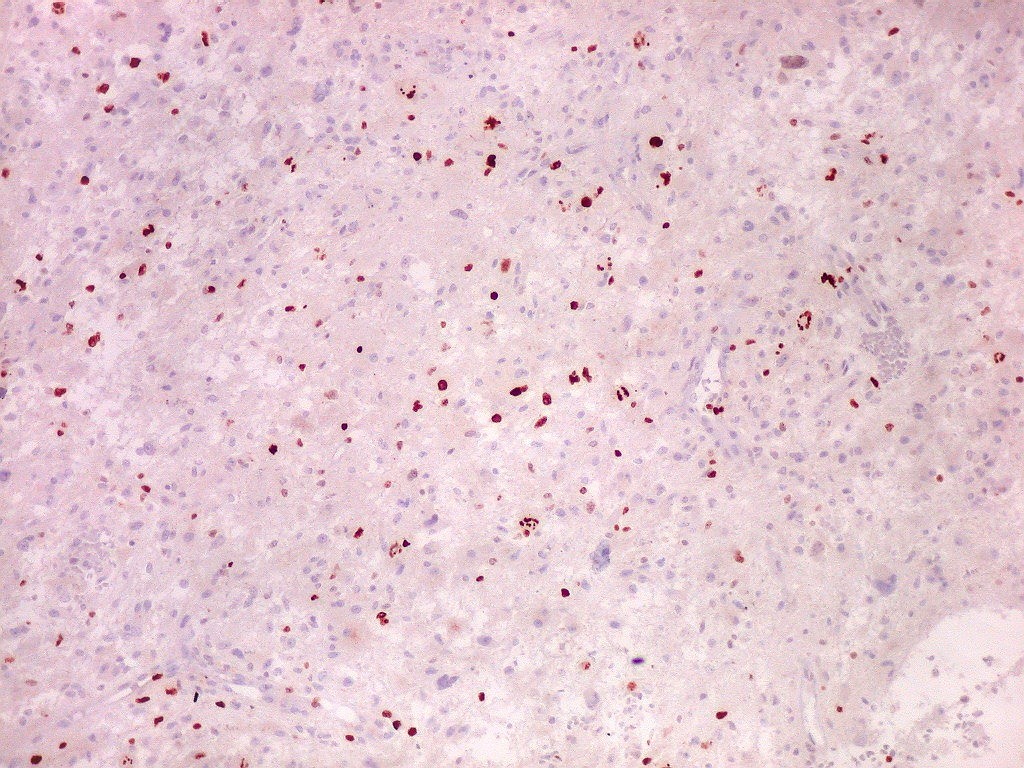
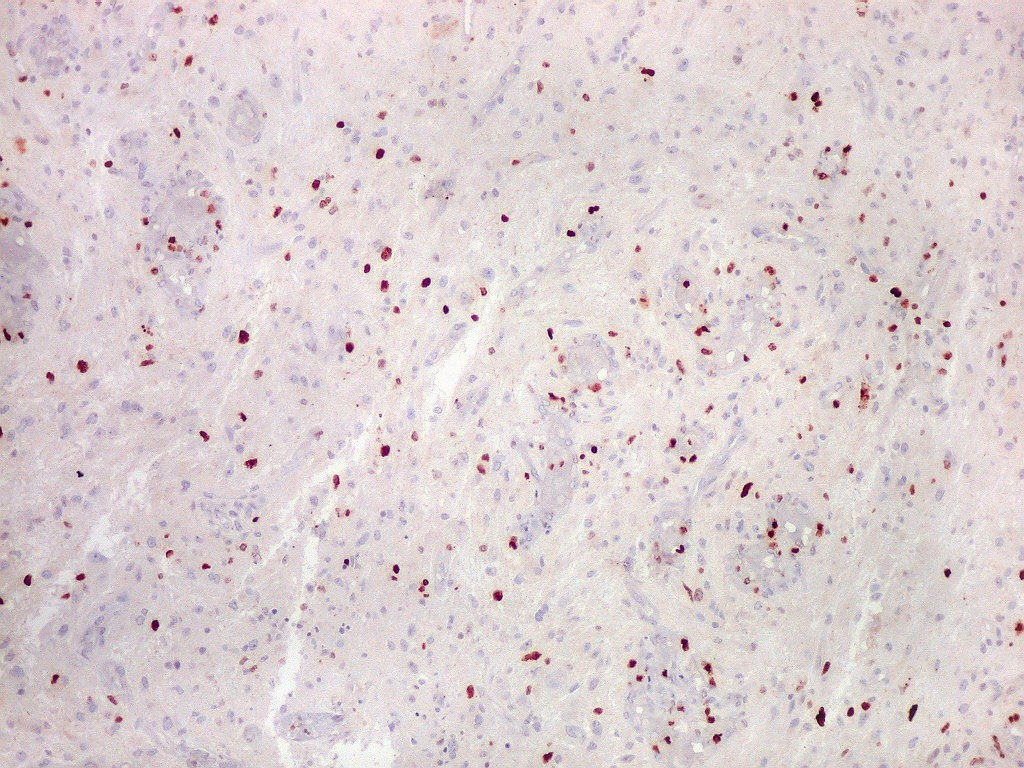
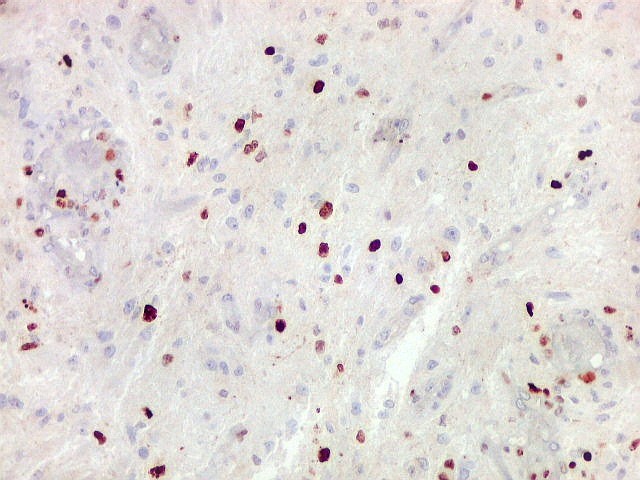
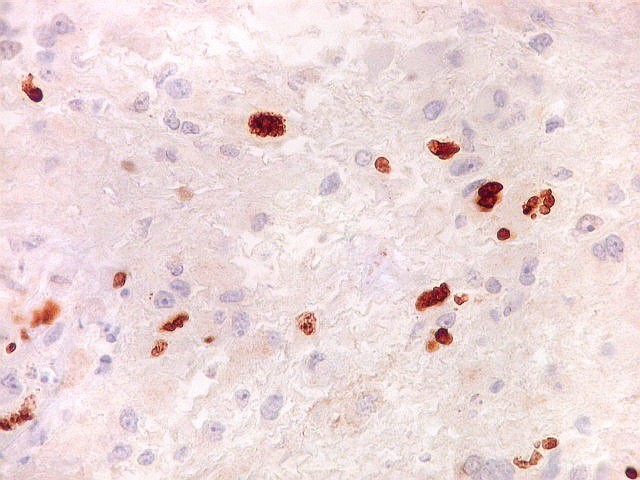
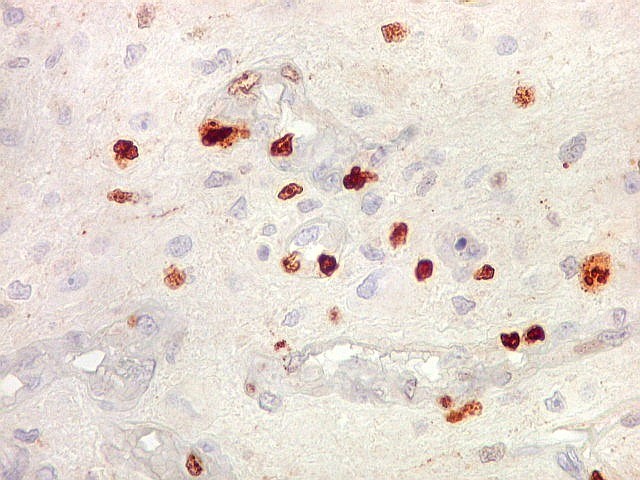
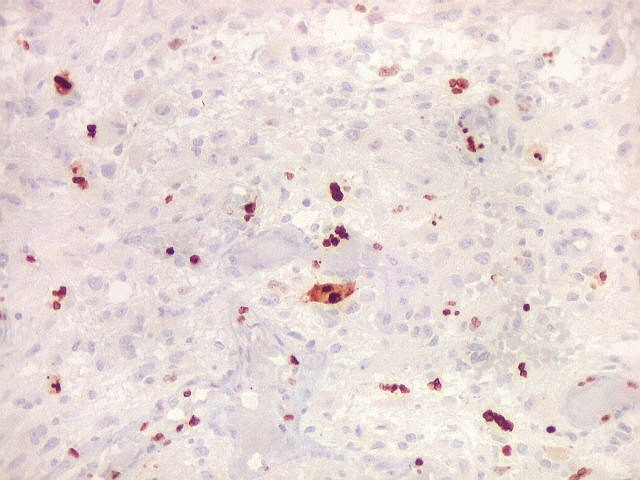
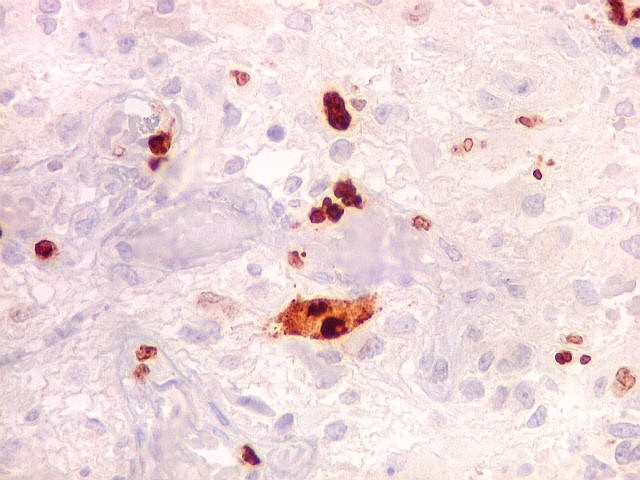
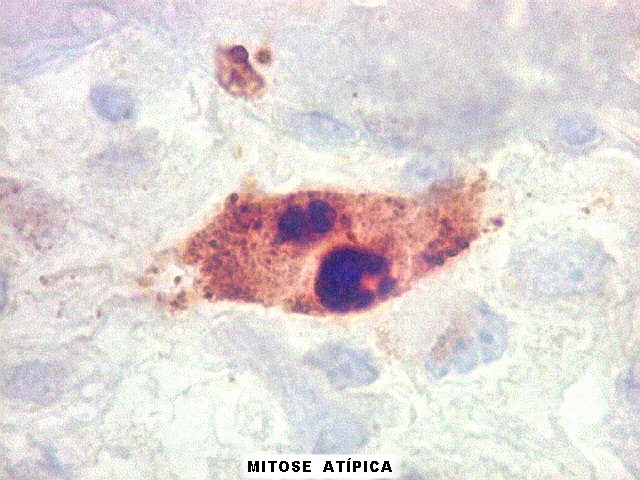
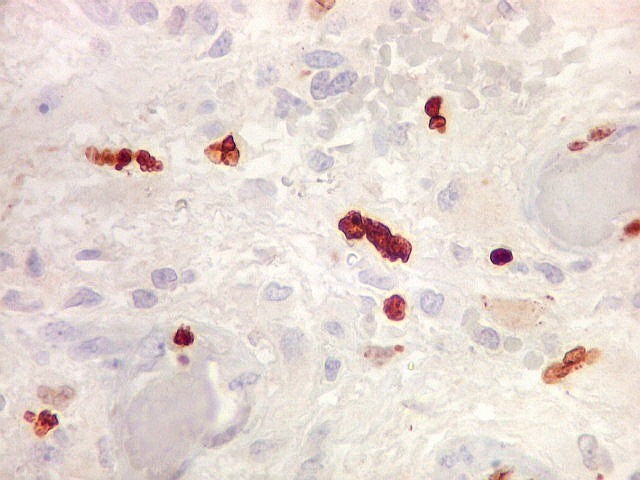
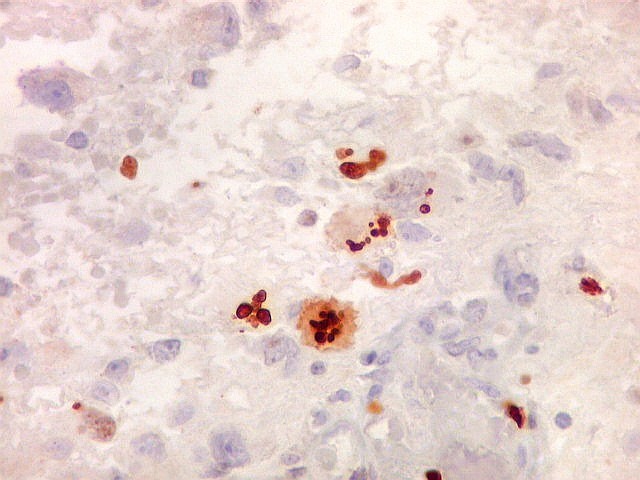
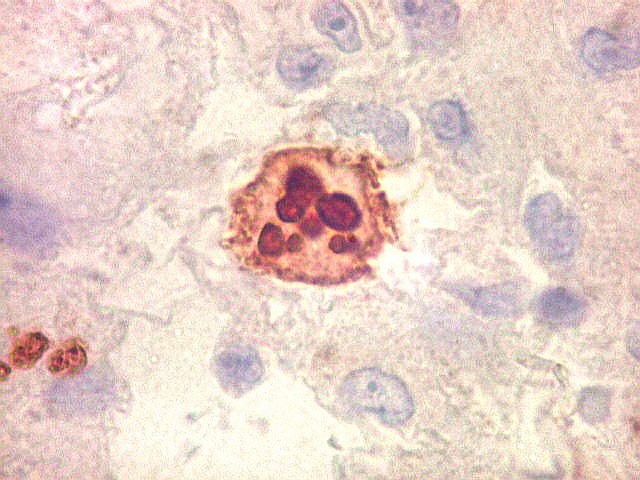
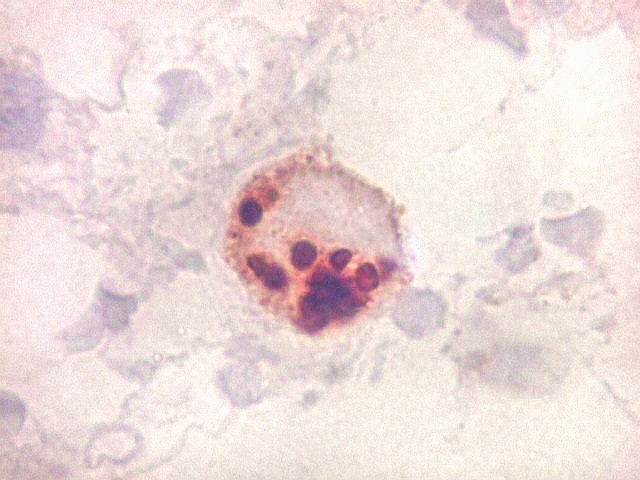
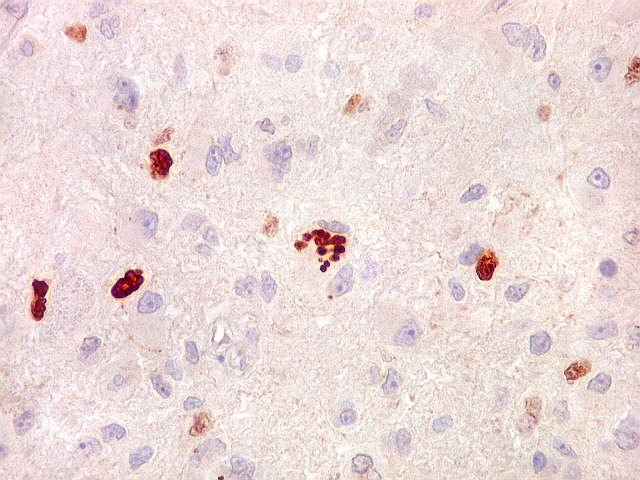
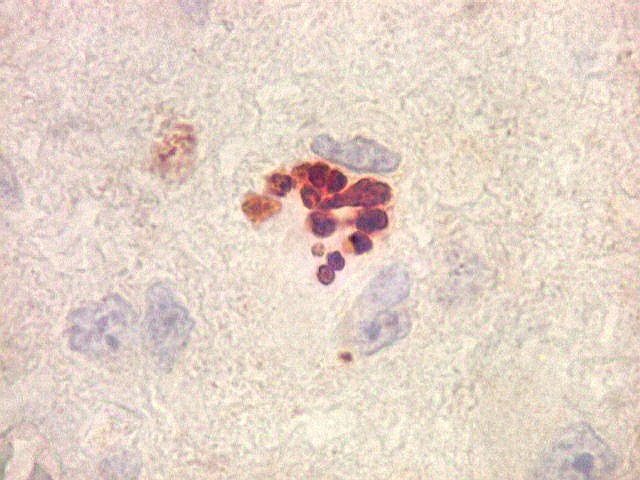
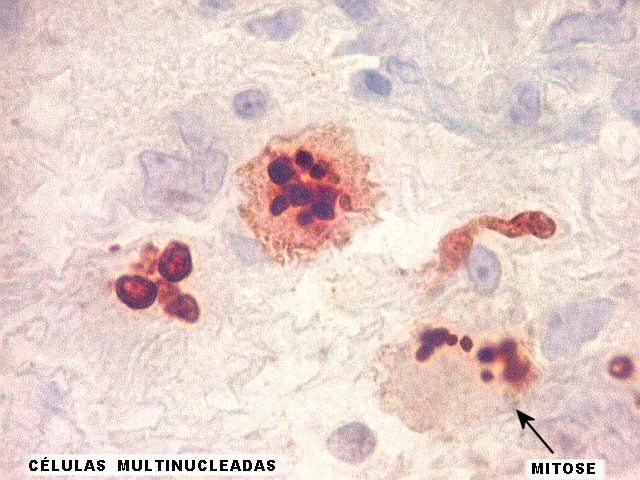
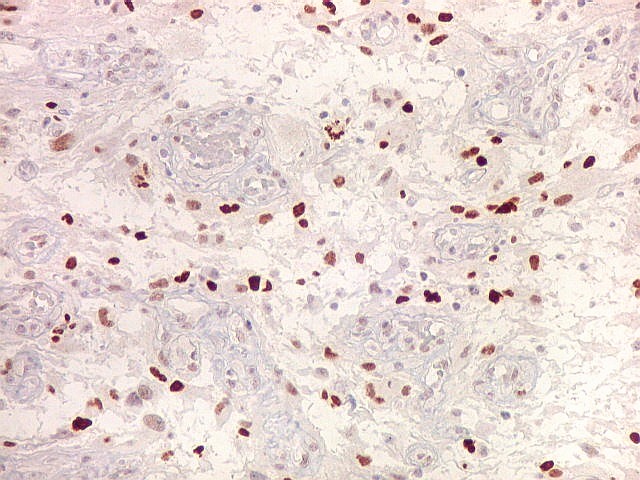
| Ki67. Este antígeno de proliferação celular, que sinaliza as células que vão entrar em mitose, foi positivo em cerca de 20% dos núcleos, indicando tumor de rápido crescimento. A reação salienta células multinucleadas e figuras de mitose. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
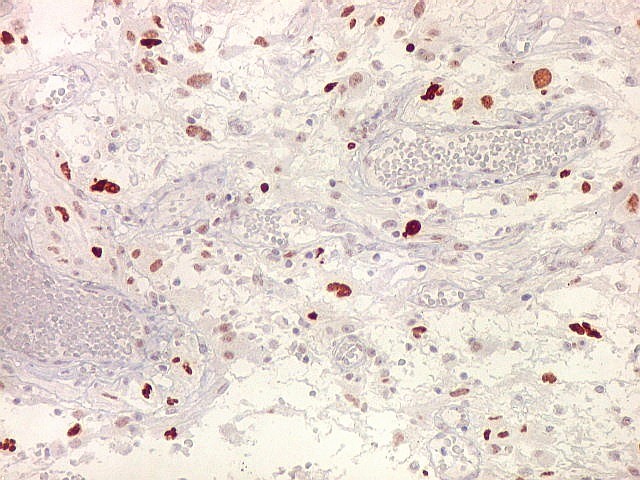
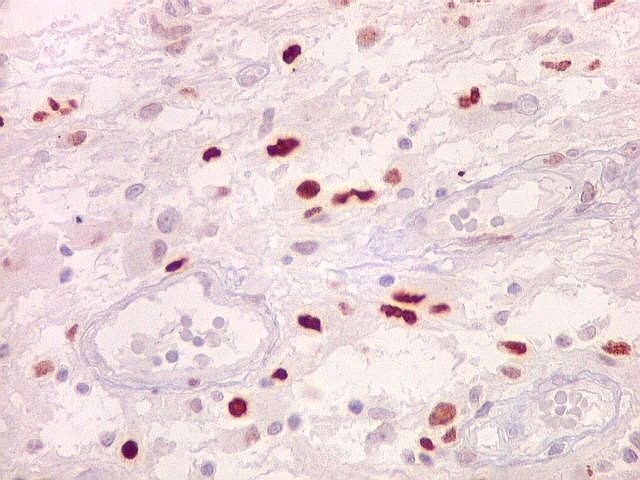
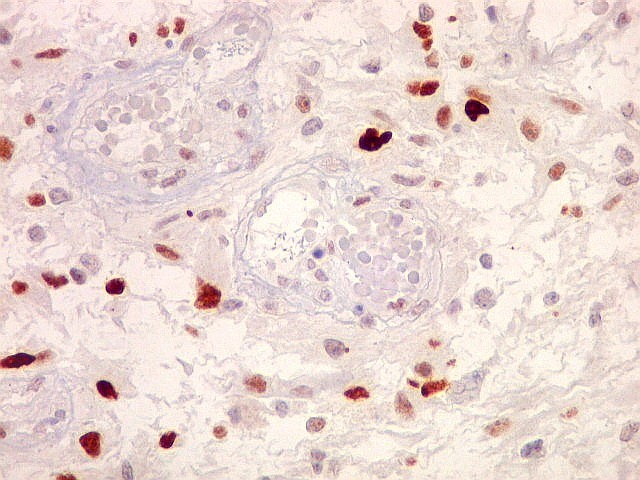
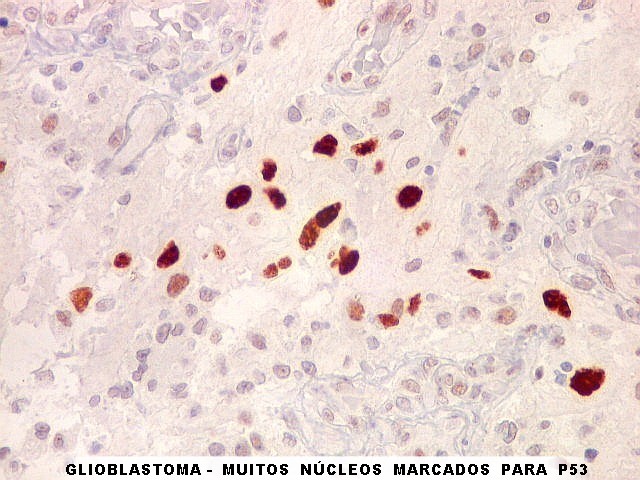
| p53.
Esta proteína acumula-se nos núcleos quando em forma mutante,
que não pode ser degradada. Habitualmente, a proteína sinaliza
a apoptose de células geneticamente lesadas, impedindo que venham
a proliferar e causar tumores. Quando há mutação
do gene TP53, a proteína sintetizada é anômala, não
exerce sua função e não é metabolizada. Esta
é uma das vias aceitas para o desenvolvimento de gliomas, especialmente
dos chamados 'glioblastomas secundários', que se originariam a partir
de um tumor primário (astrocitoma) de baixo grau. Nestes, mutações
do TP53 são detectadas em > 65% dos casos. Já nos glioblastomas
'primários' que se desenvolvem aparentemente sem um tumor precursor,
a mutação de TP53 ocorre em cerca de 25%.
Aqui, temos marcação de elevada proporção dos núcleos das células tumorais, da ordem de 50% ou mais, sugerindo que mutações deste gene tenham tido papel proeminente na gênese do mesmo. O mesmo foi observado no componente sarcomatoso da neoplasia. |
 |
 |
 |
 |
 |
 |
 |
 |
| Agradecimentos. Caso do Hospital Santa Casa de Limeira, SP, enviado e gentilmente contribuído pelos Drs. Antonio Augusto Roth Vargas, Marcelo Senna Xavier de Lima, Paulo Roland Kaleff e residentes do Serviço de Neurocirurgia. Procedimentos imunohistoquímicos pelo pessoal do Laboratório de Pesquisa - Ana Claudia Sparapani Piaza, Luzia Aparecida Magalhães Ribeiro Reis e Arethusa de Souza. Depto de Anatomia Patológica da FCM-UNICAMP, Campinas, SP. |
|
|
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|
|
|