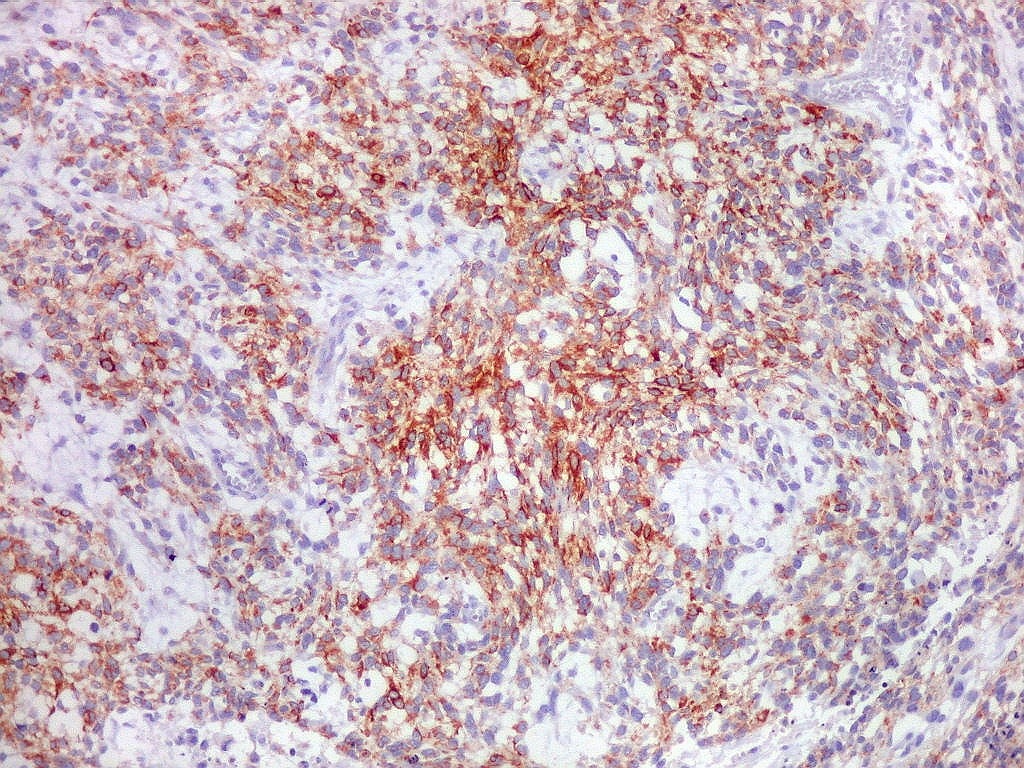
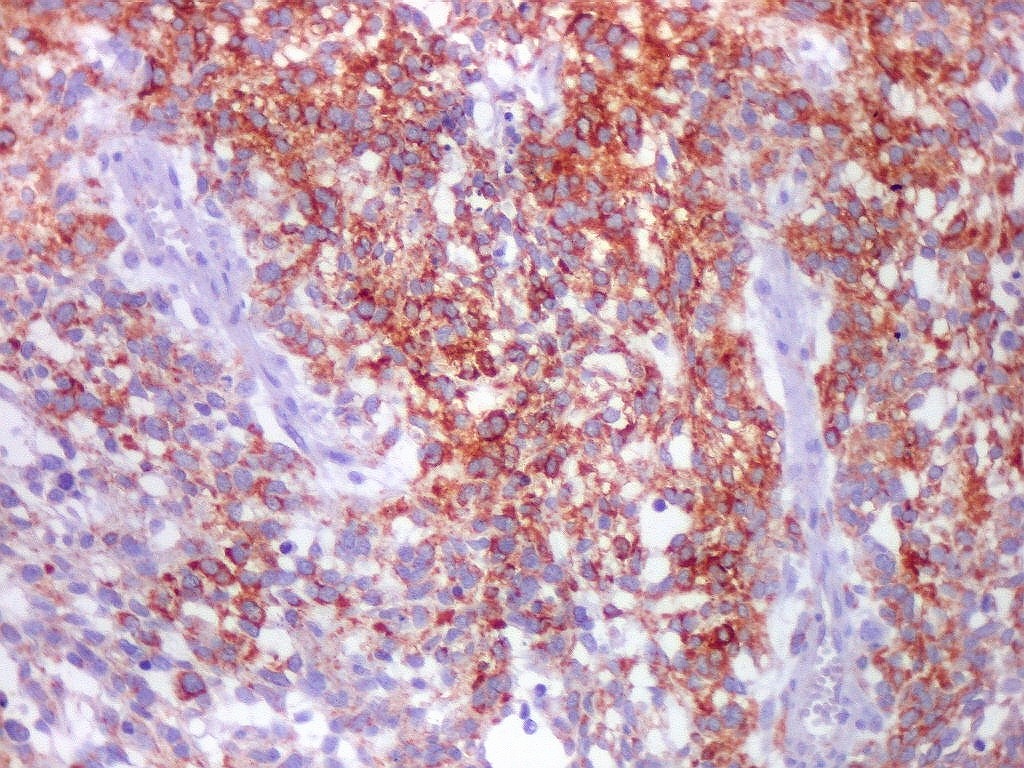
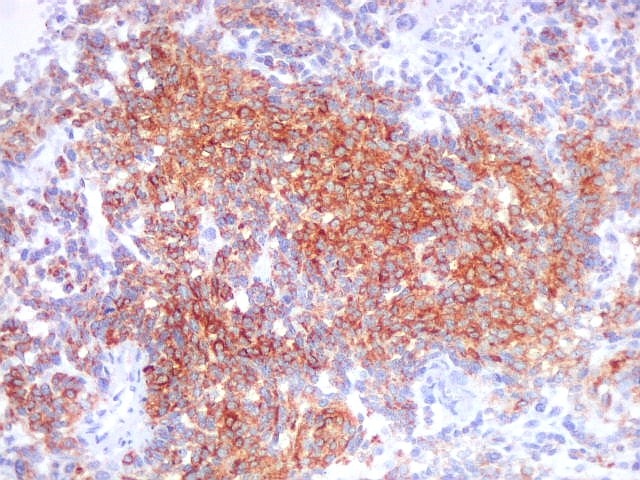
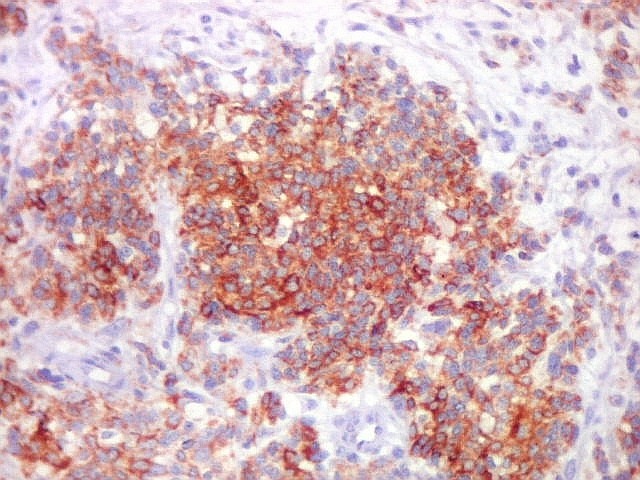
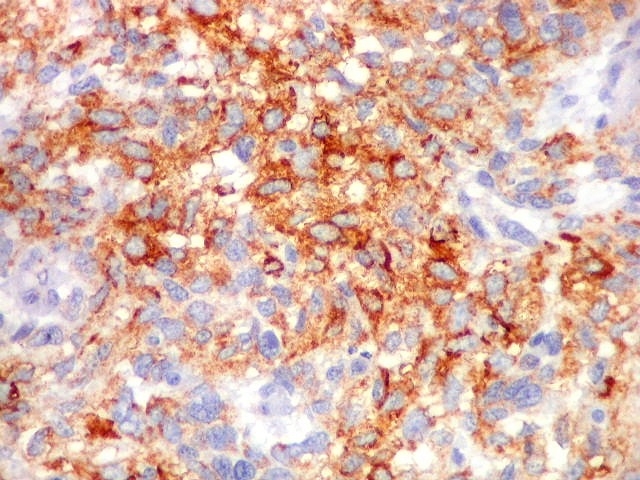
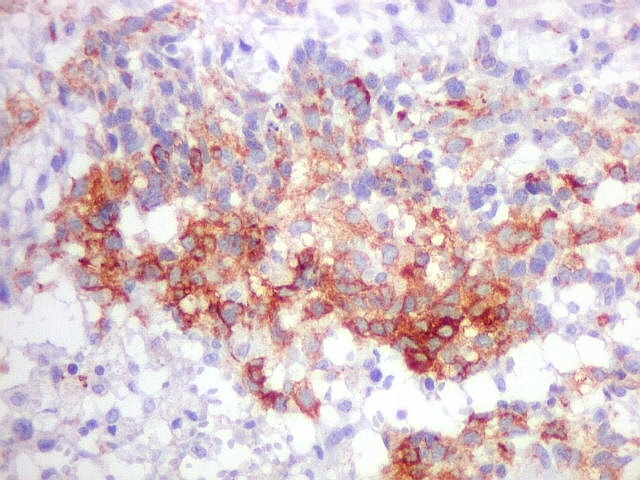
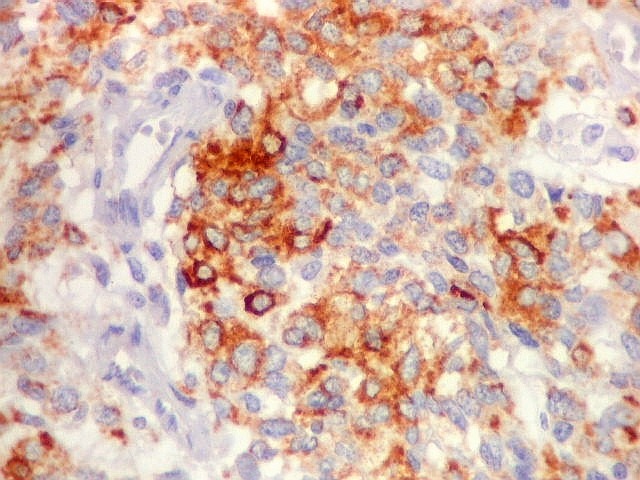
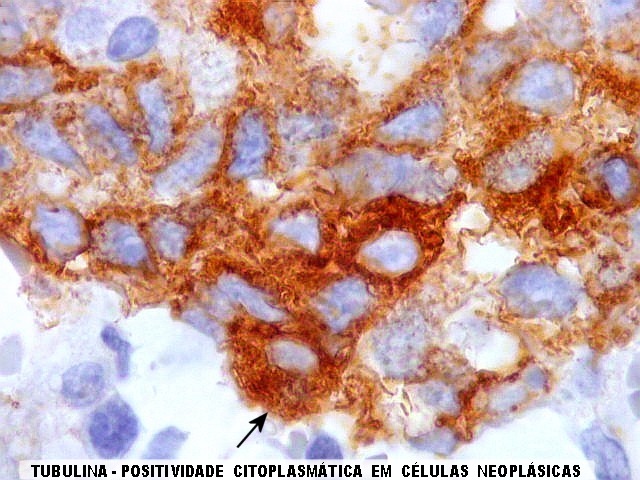
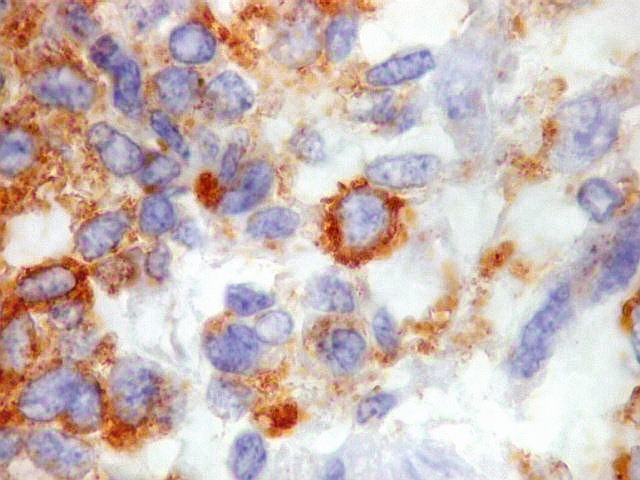
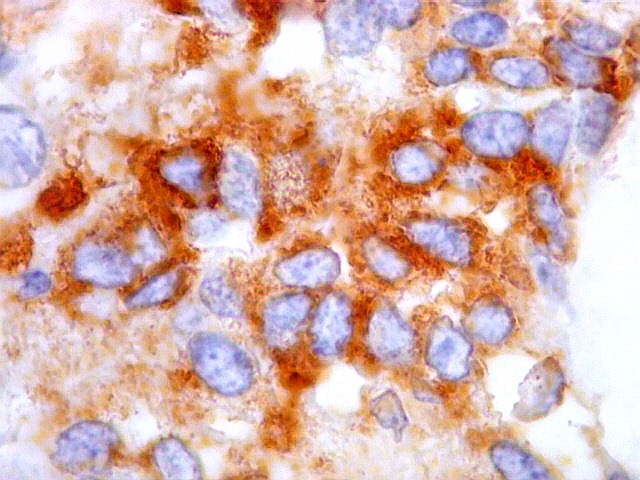
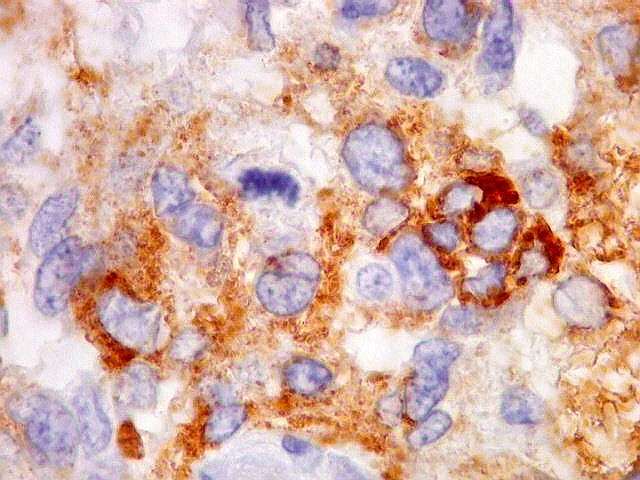
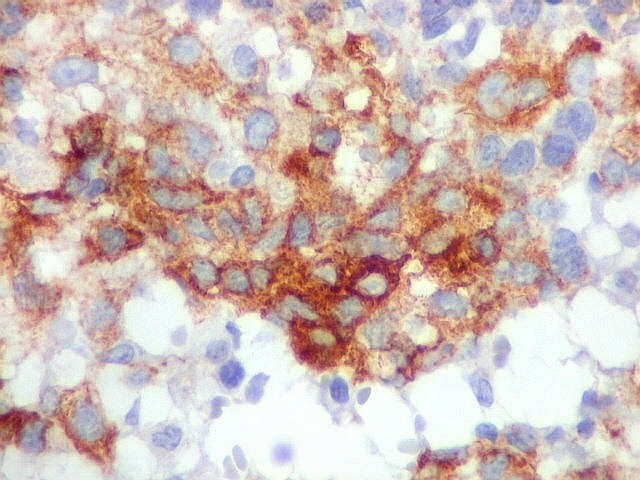
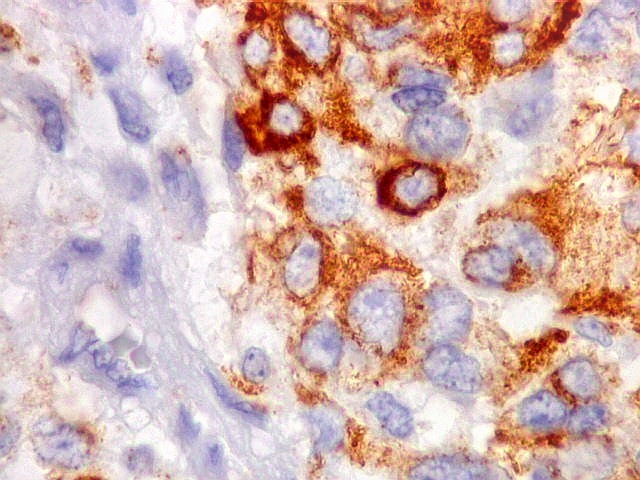
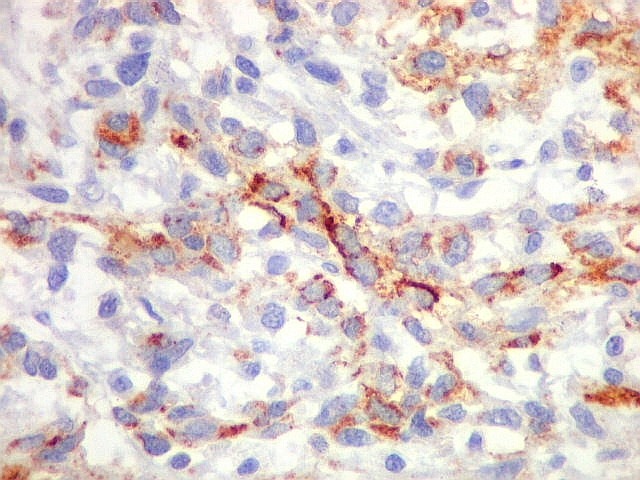
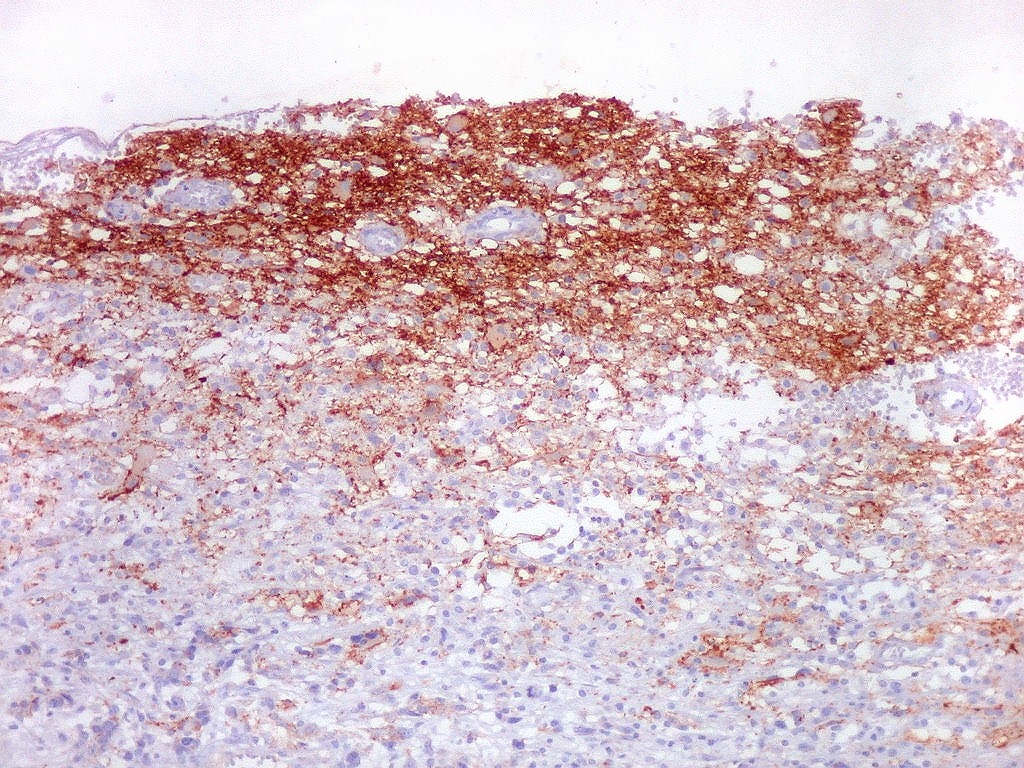
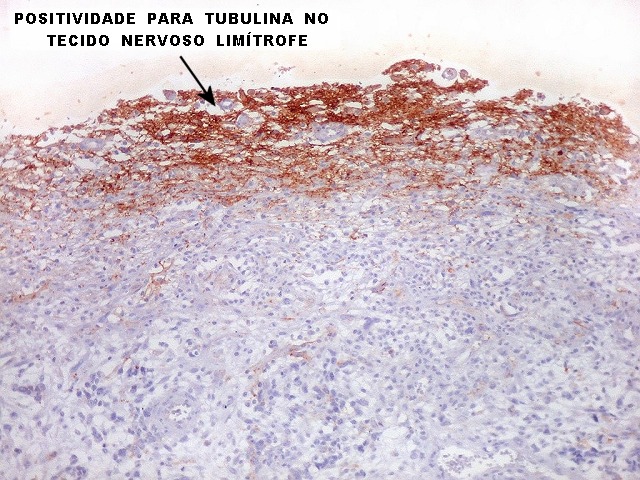
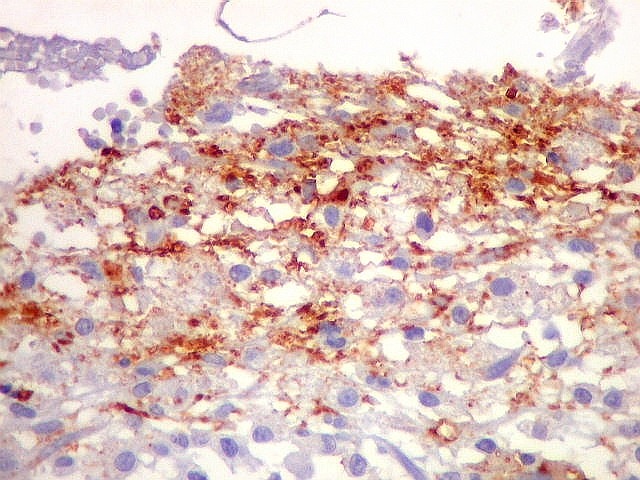
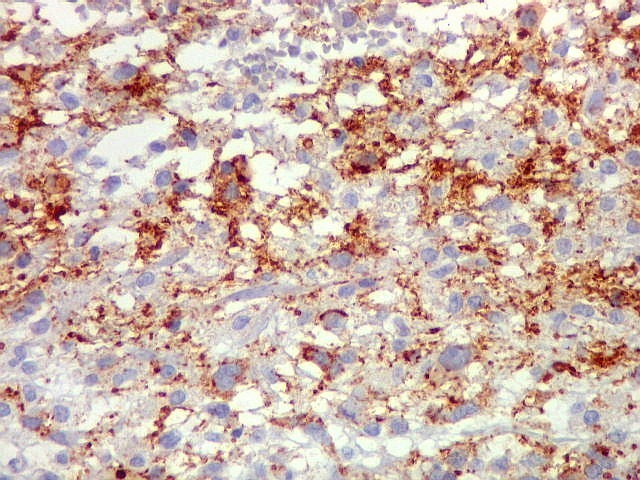
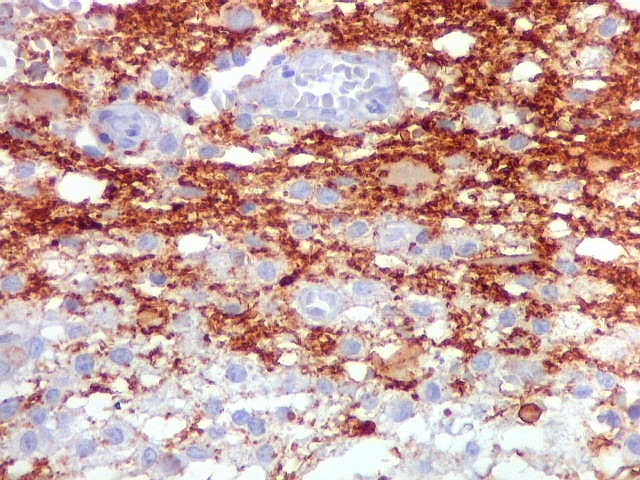
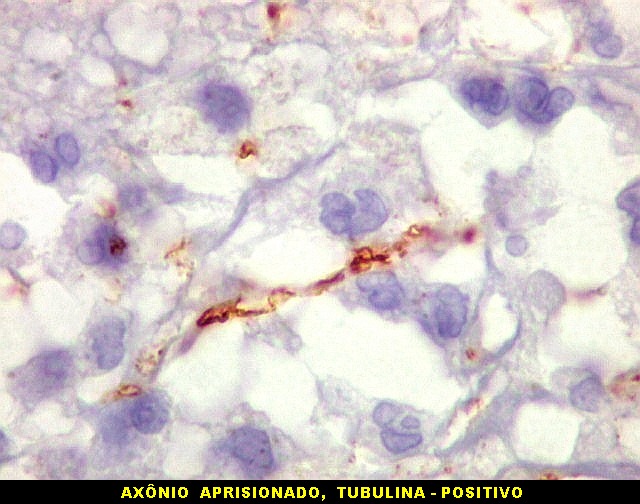
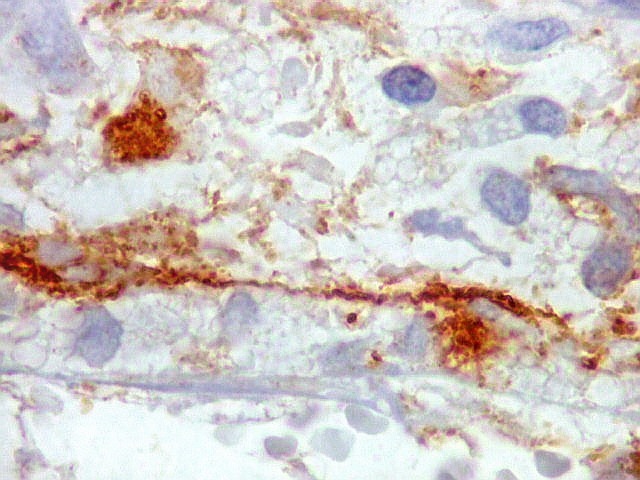
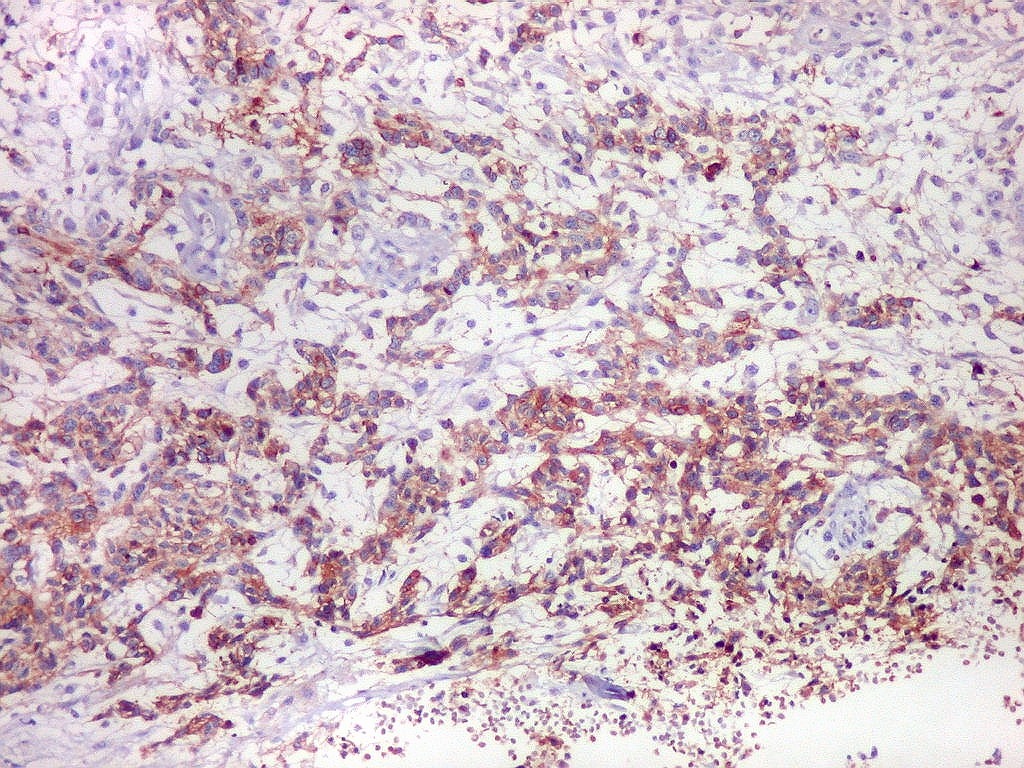
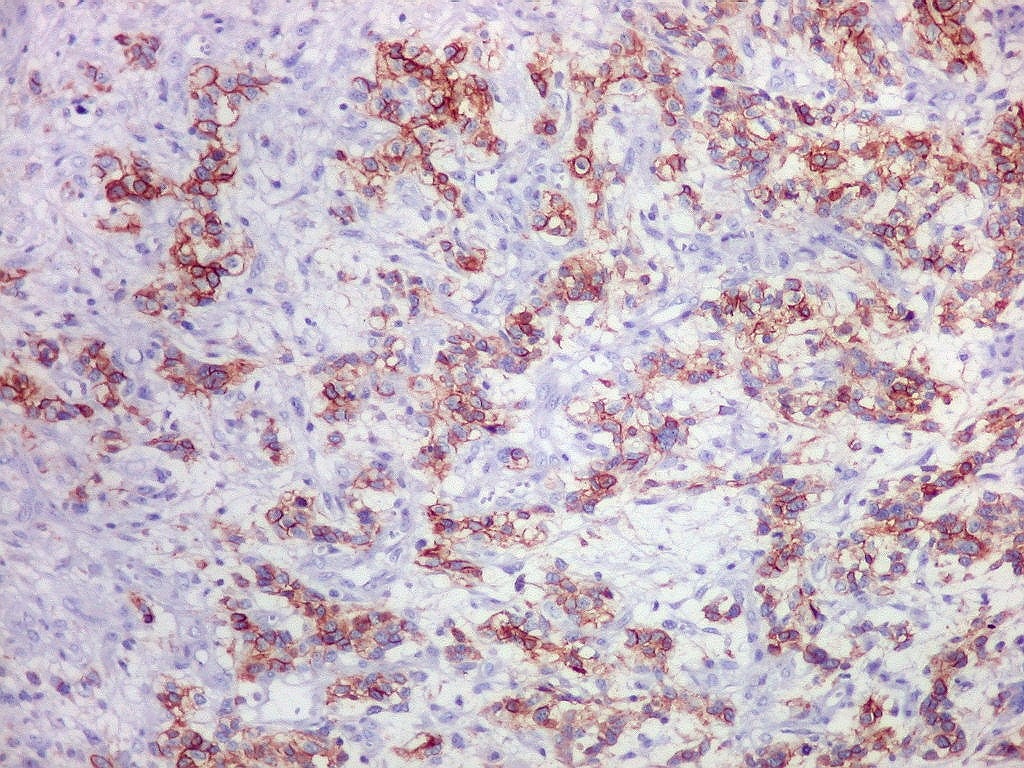
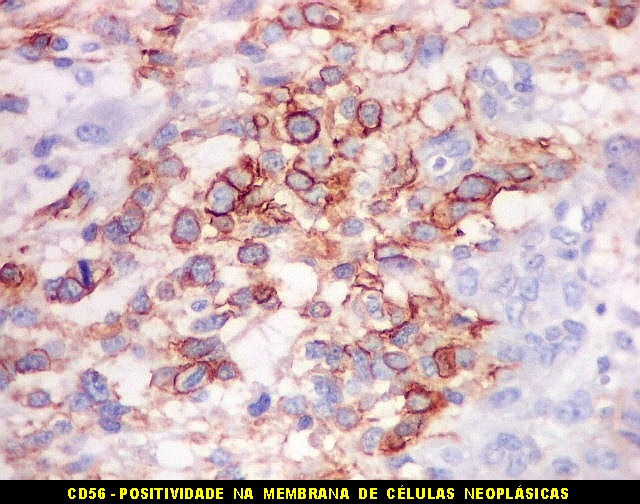
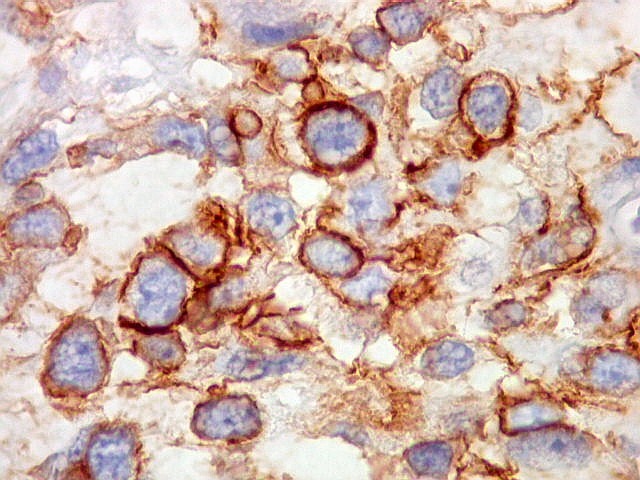
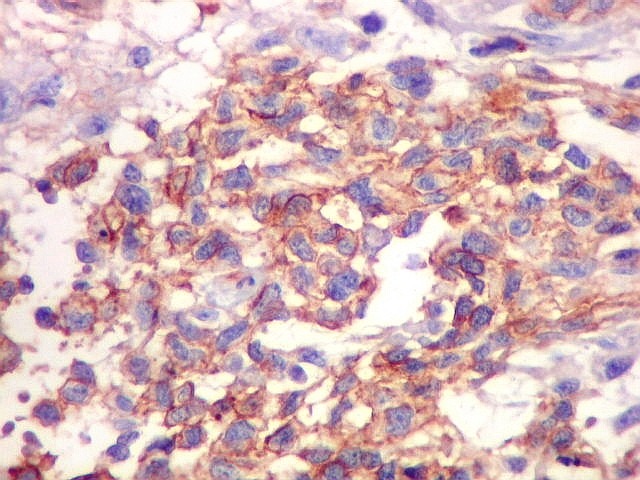
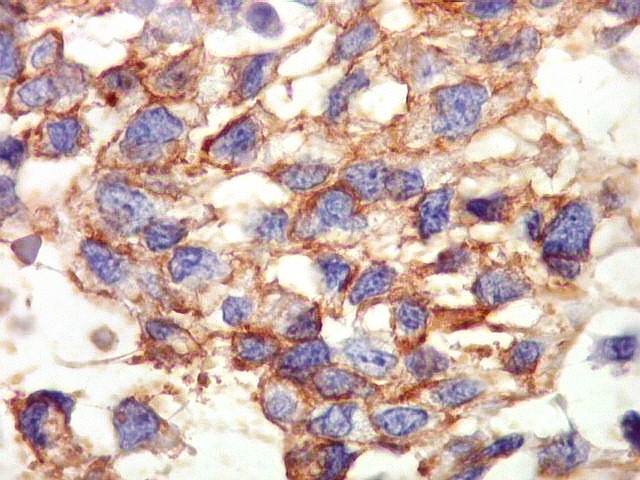
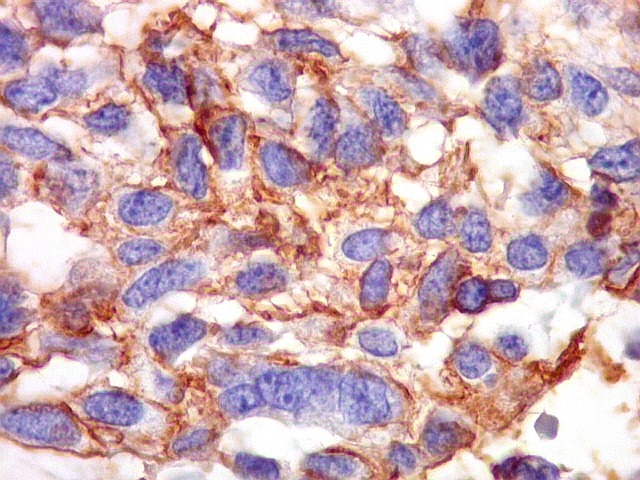
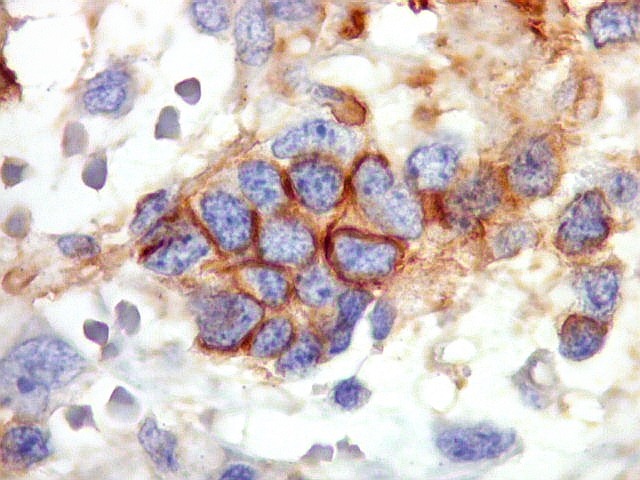
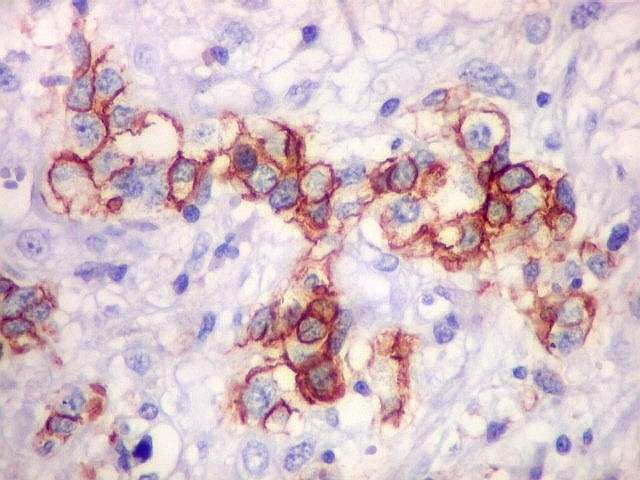
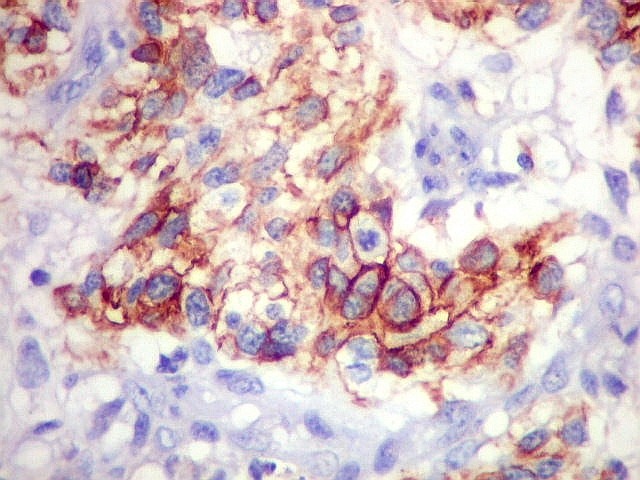
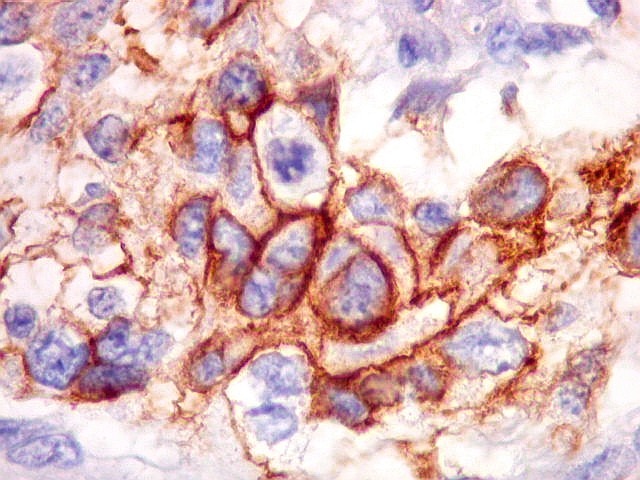
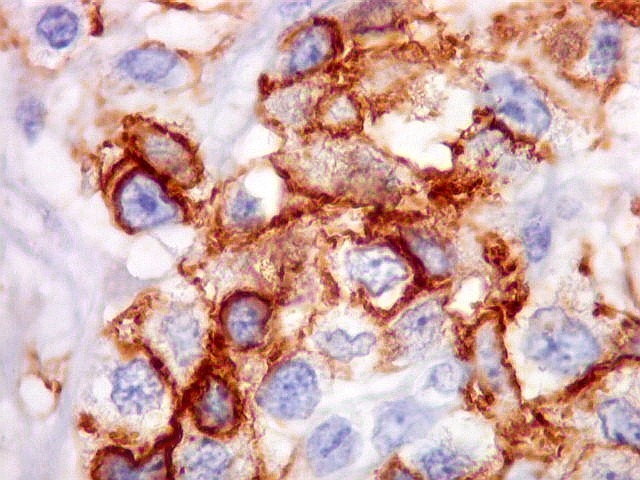
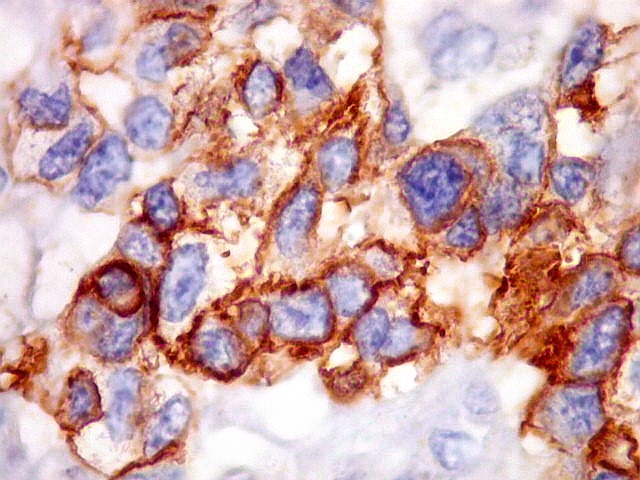
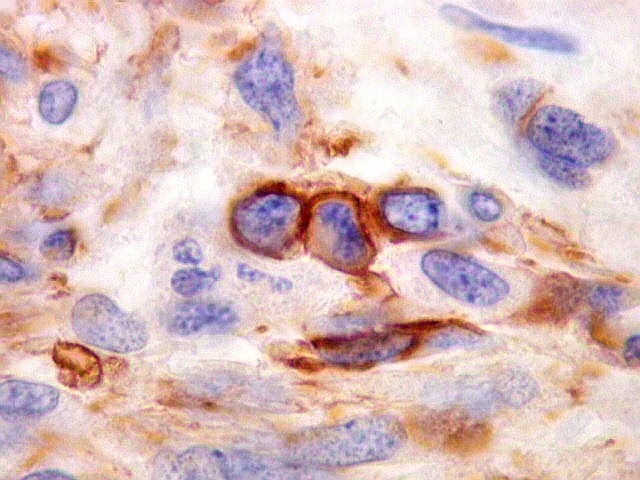
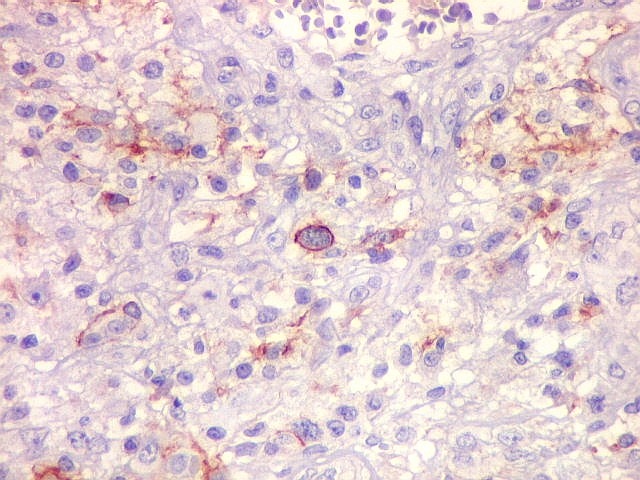
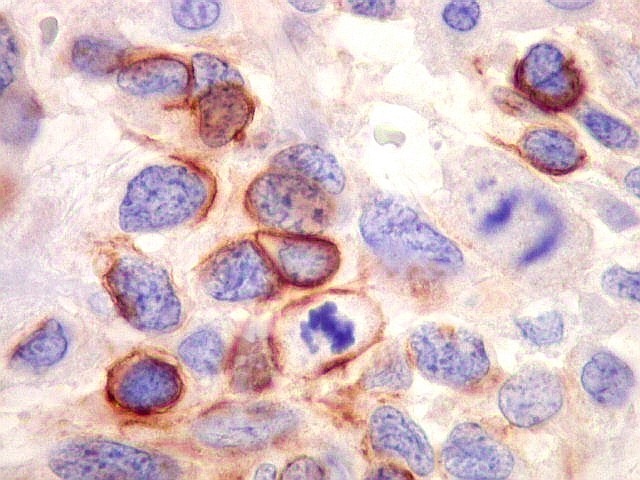
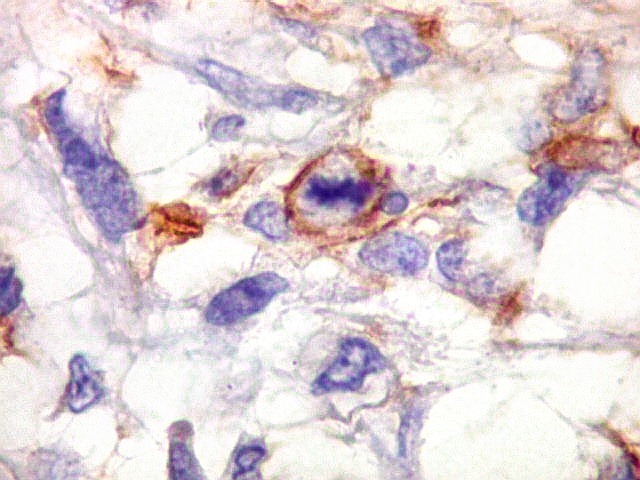
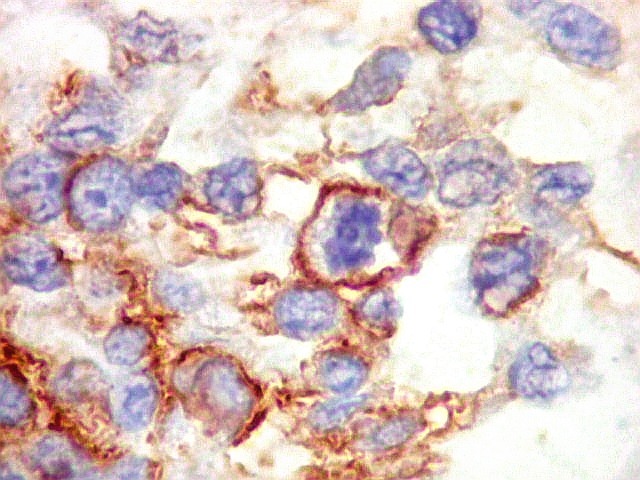
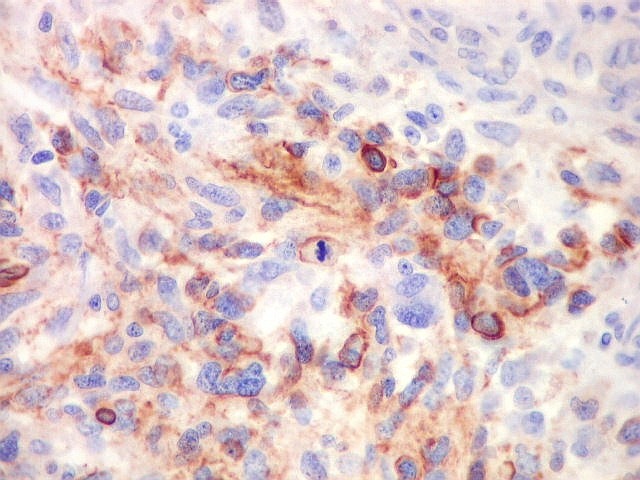
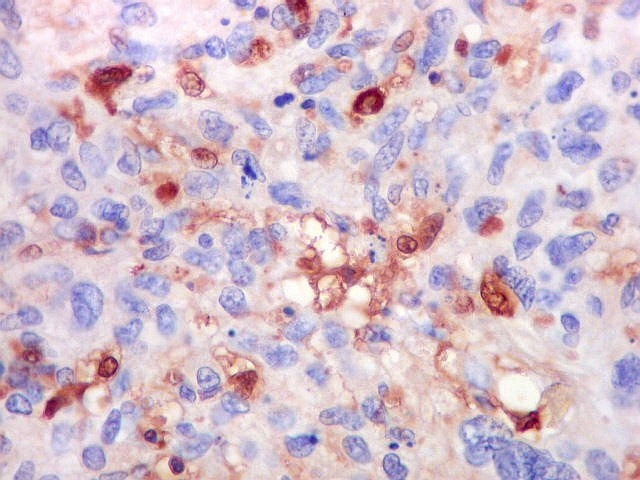
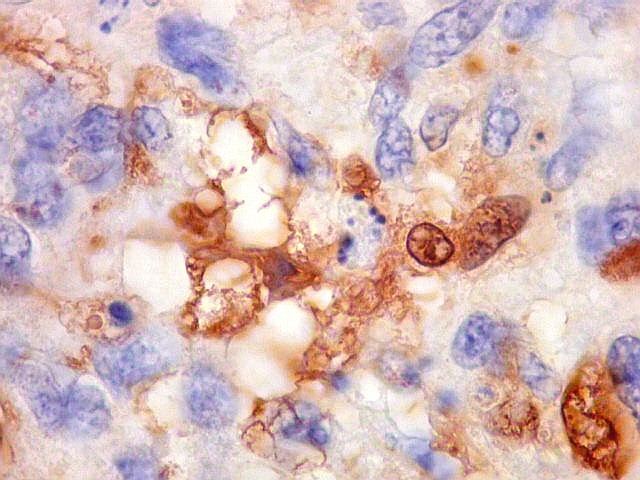
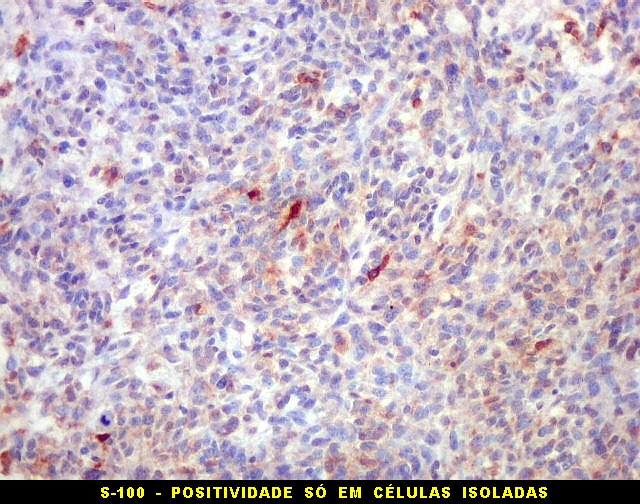
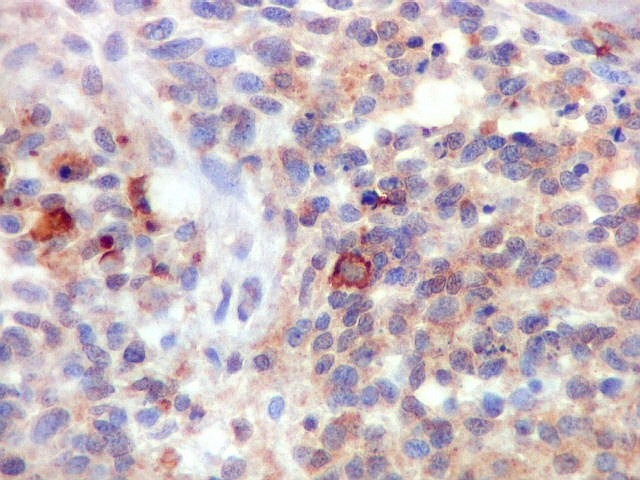
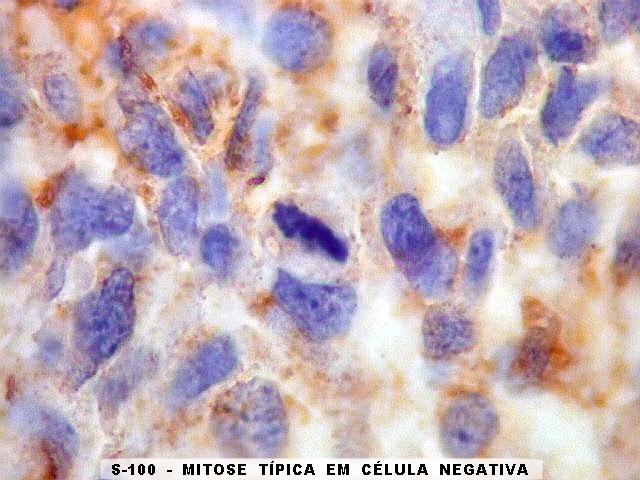
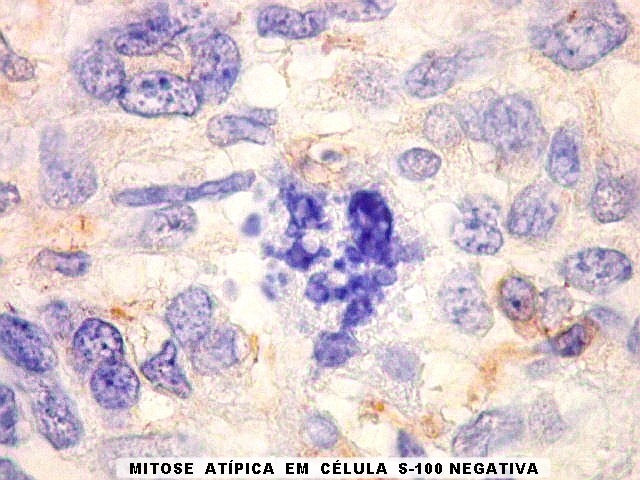
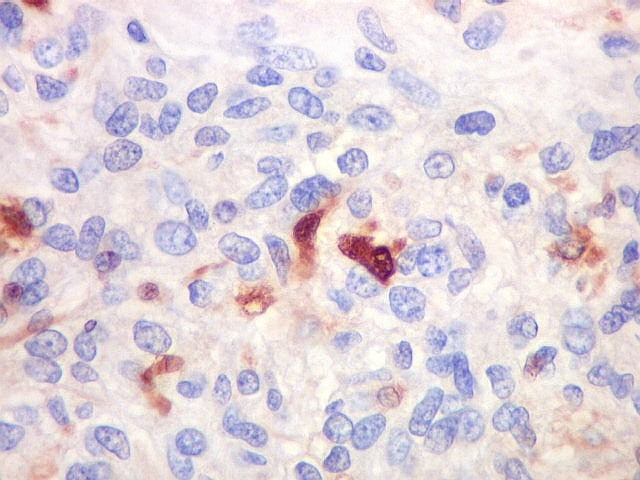
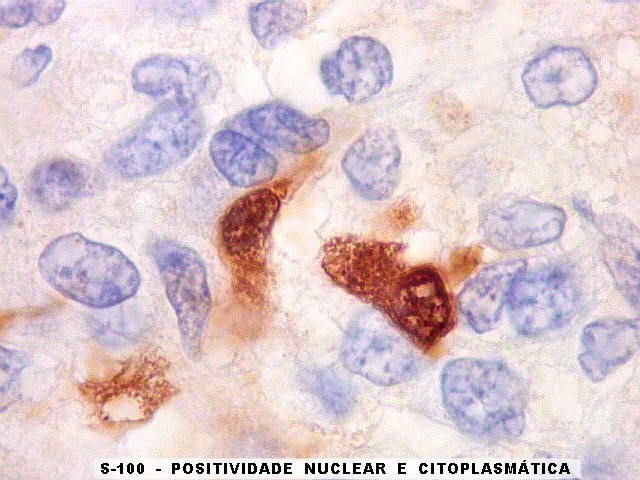
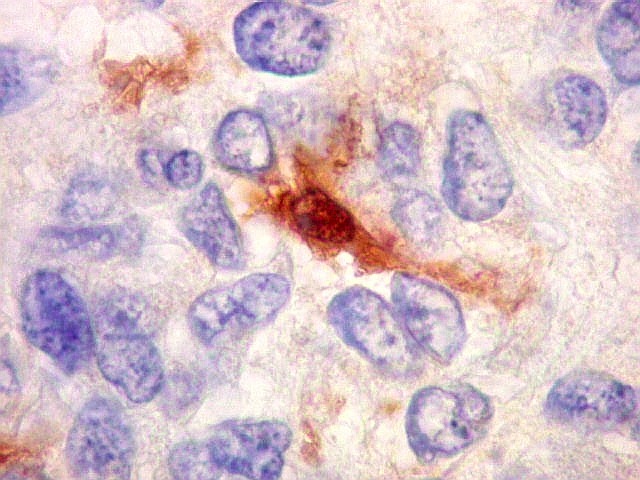
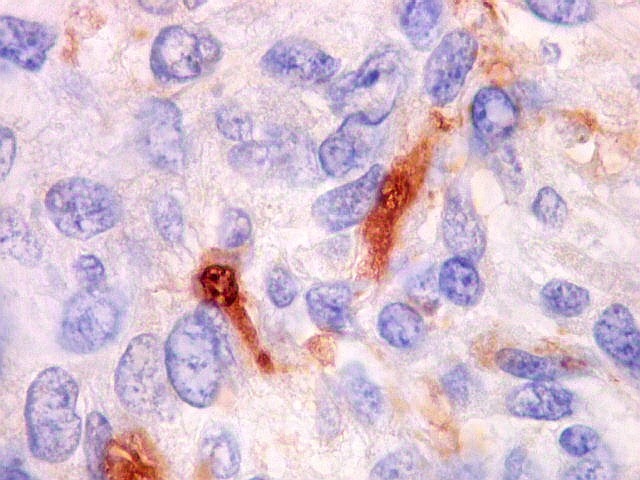
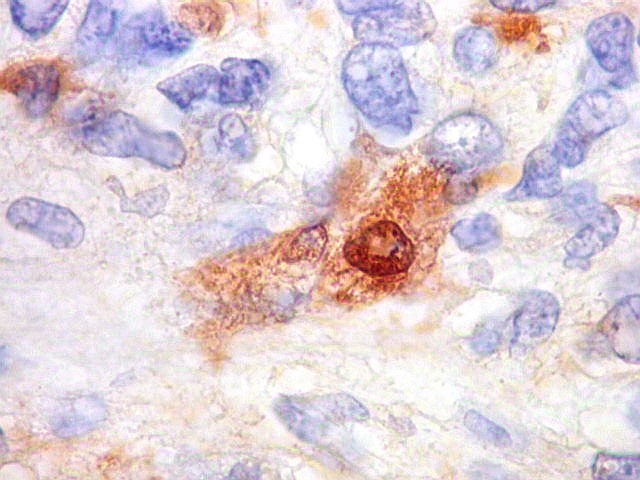
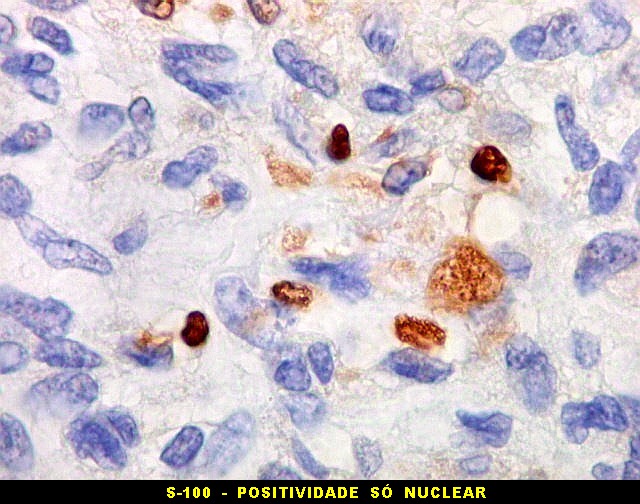
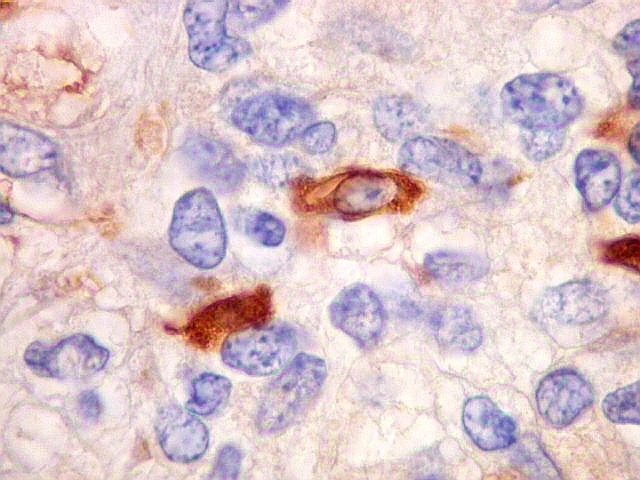
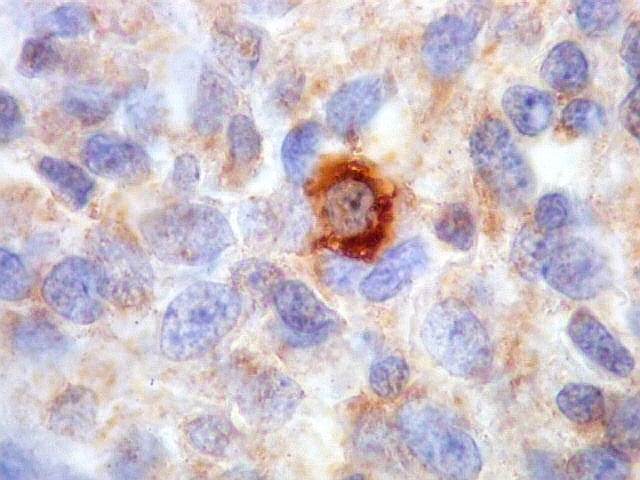
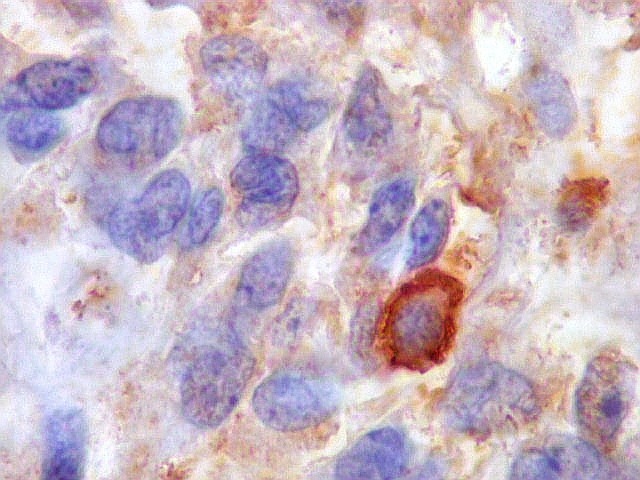
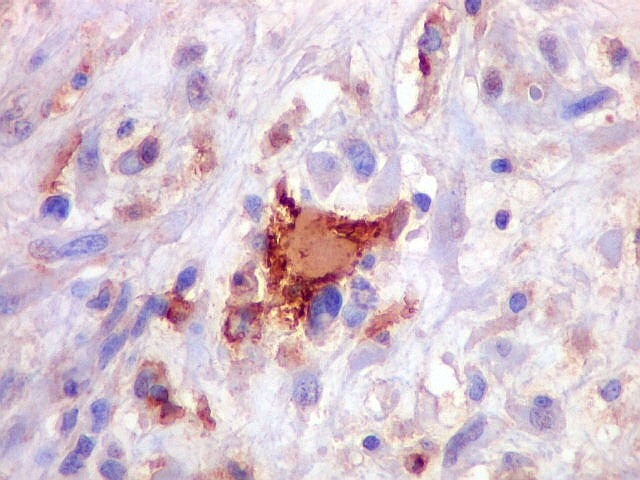
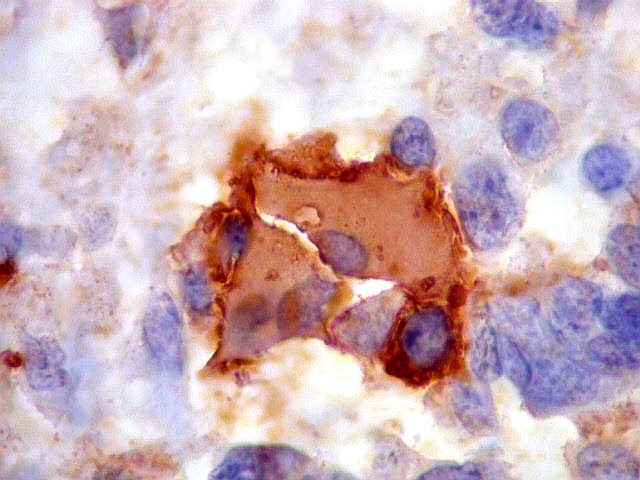
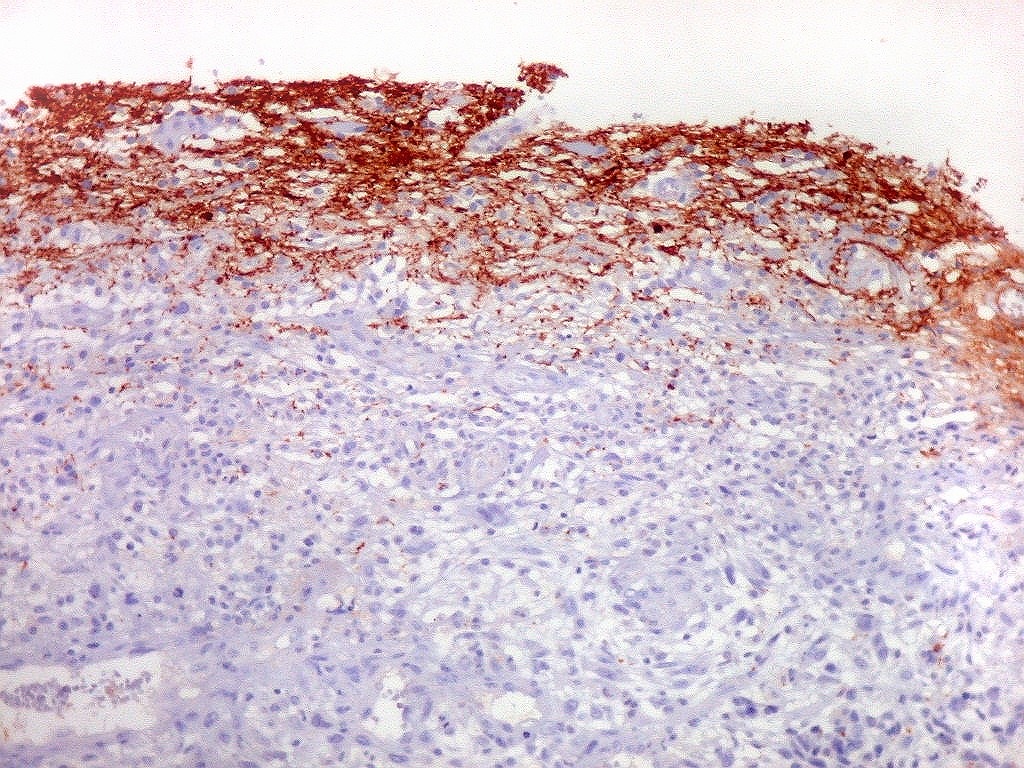
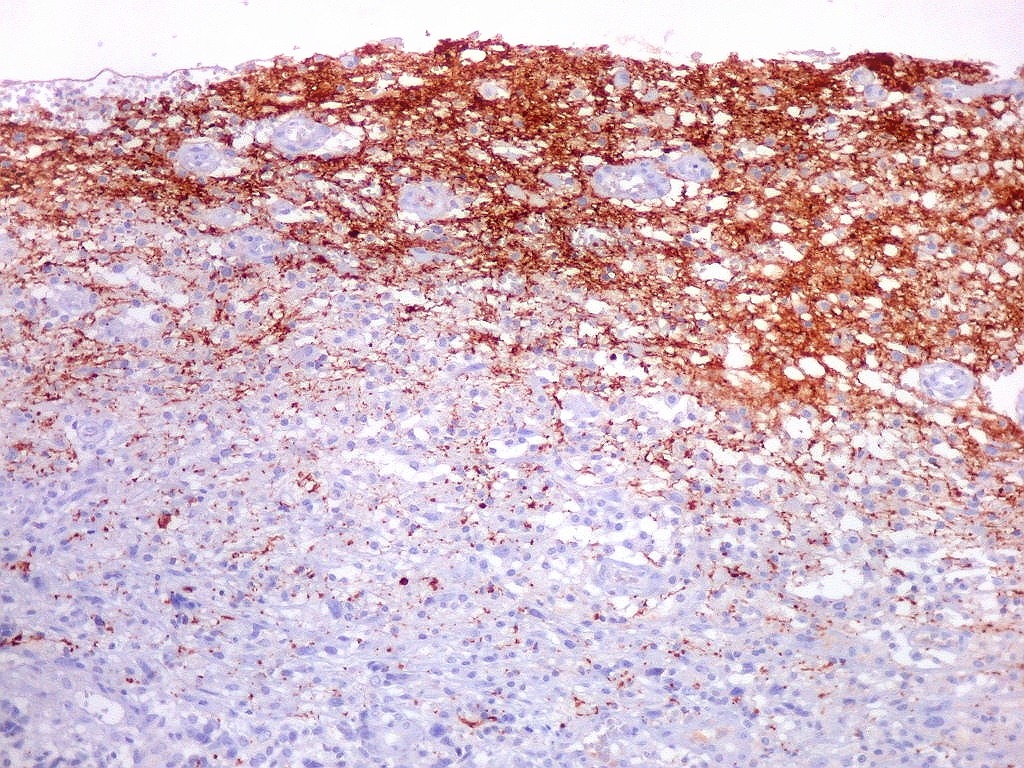
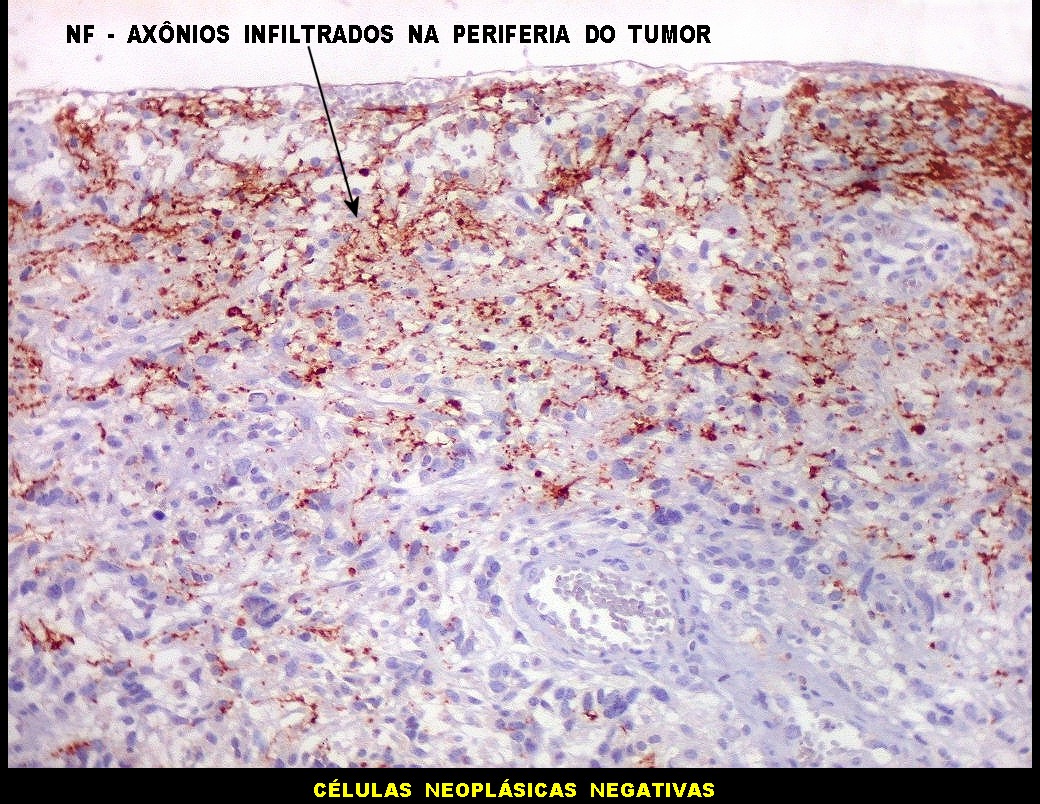
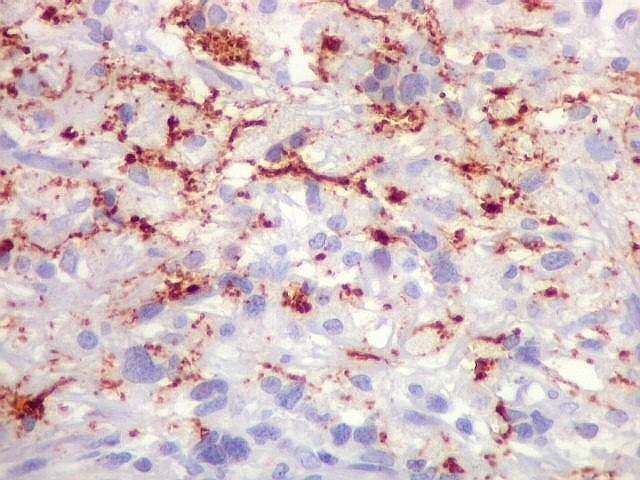
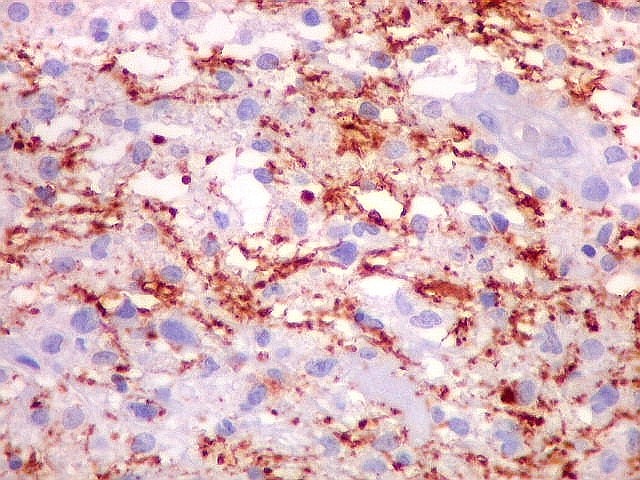
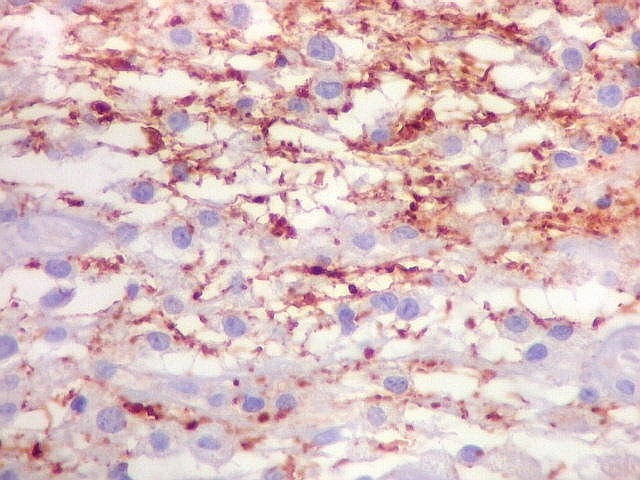
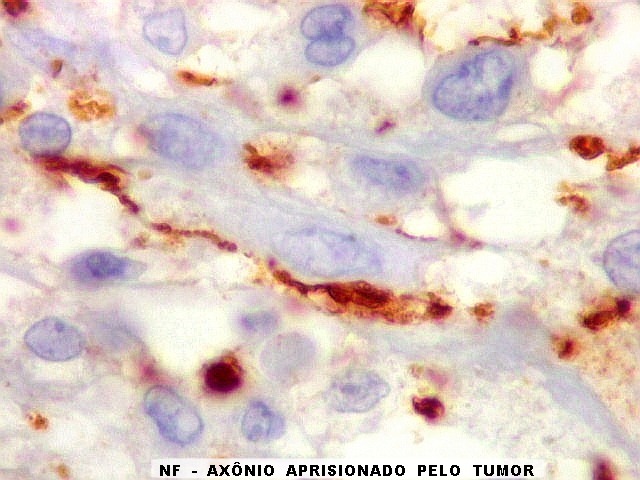
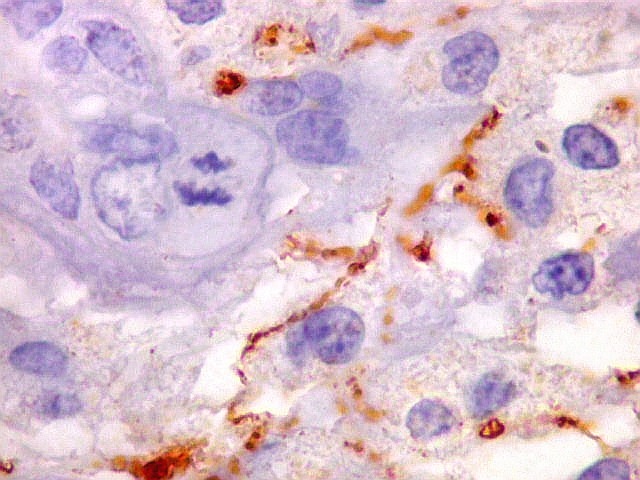
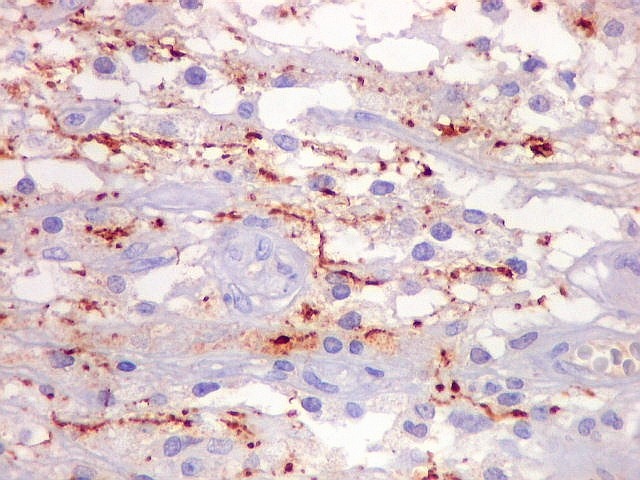
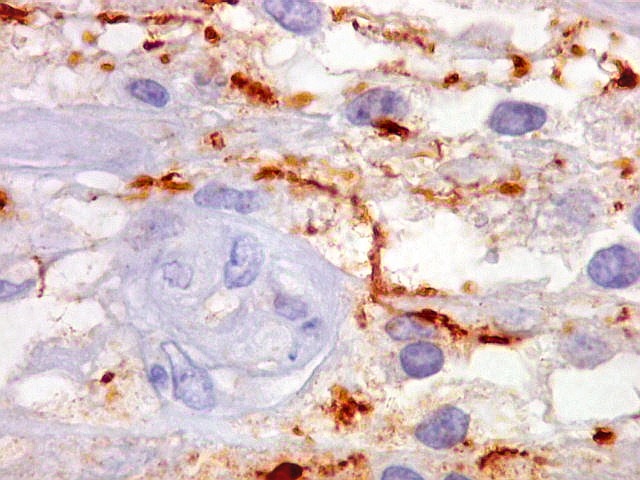
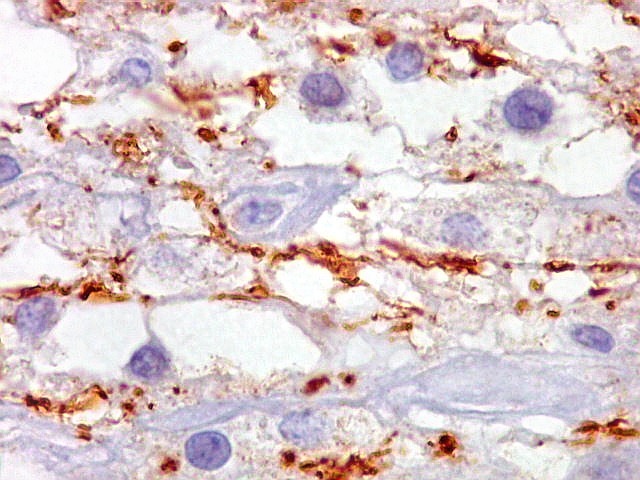
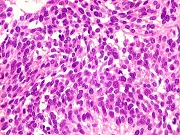
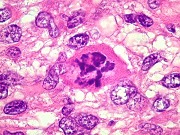
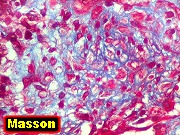
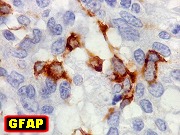
| Beta-tubulina
classe III
Tubulinas
pertencem a uma família de proteínas globulares, cujos membros
mais comuns são a alfa e a beta tubulina, constituintes dos microtúbulos.
Cada uma tem peso molecular de aproximadamente 55 kD. Os microtúbulos
são formados por dímeros de alfa e beta tubulina.
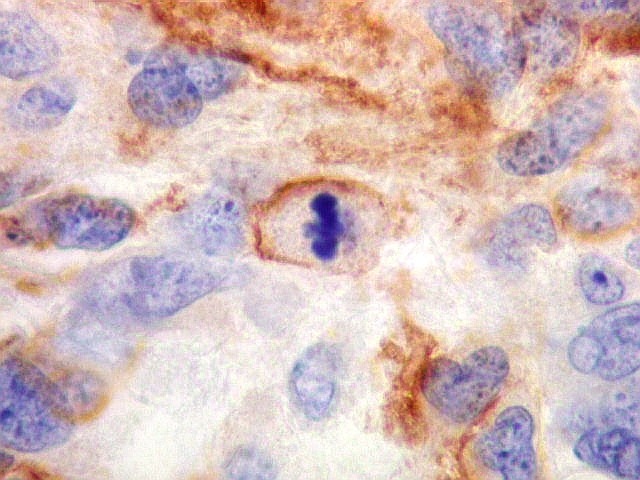
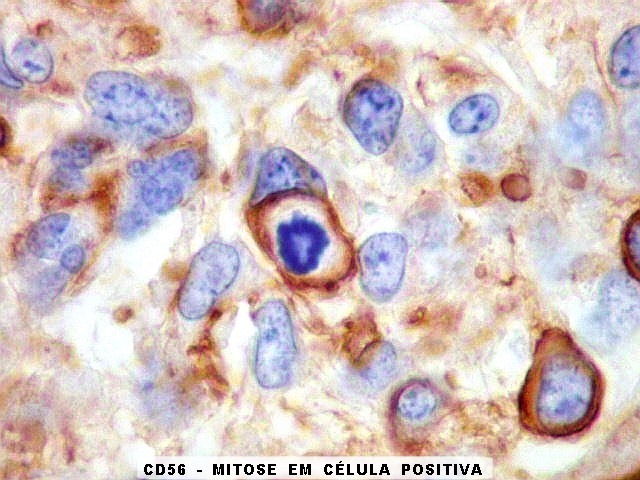
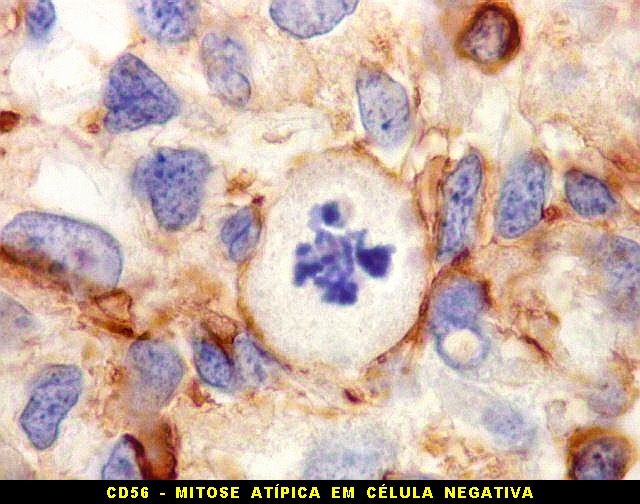
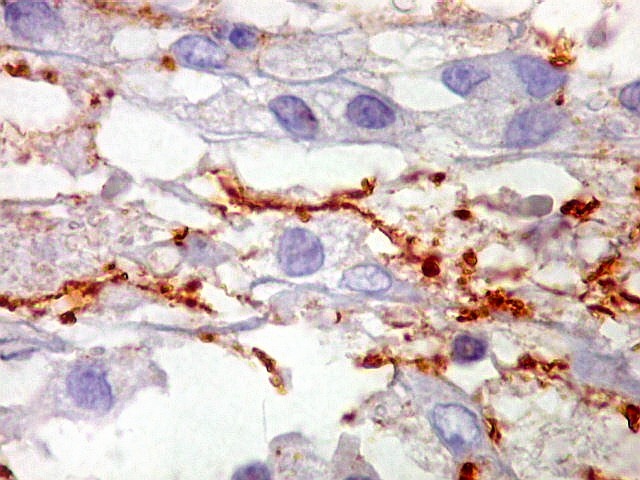
A beta-tubulina
classe III é expressada exclusivamente em neurônios, sendo
um marcador muito empregado para este tipo de células. É
abundante no cérebro, tanto na fase fetal como na pós natal.
Tanto a expressão como o processamento pós-translacional
da beta-tubulina classe III são considerados essenciais em todos
estágios da diferenciação neuronal (Fanarraga et al.
1999) e seria um dos eventos mais precoces indicadores do comprometimento
de células para a linhagem neuronal (Jirásek et al. 2002)
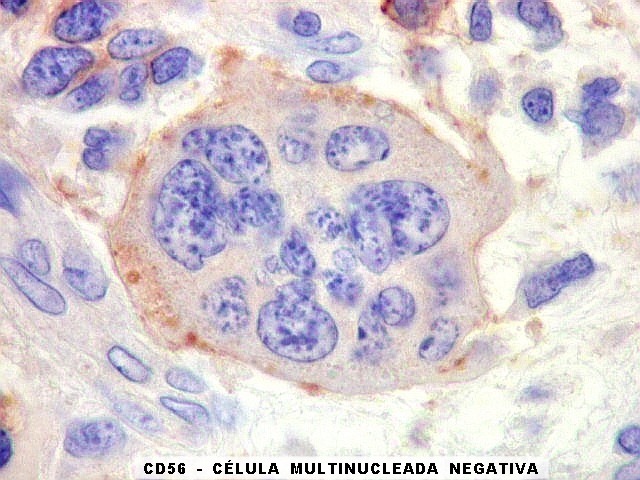
No sistema nervoso central de adultos, a distribuição da
beta-tubulina classe III é específica para neurônios,
não estando presente em células gliais normalmente diferenciadas.
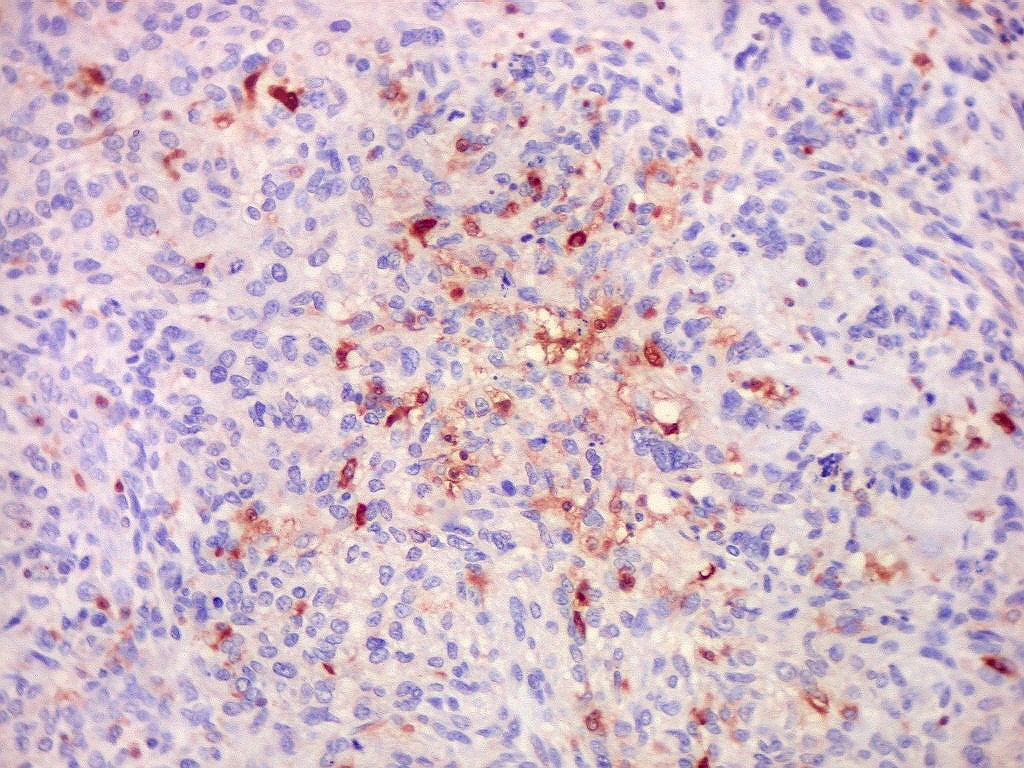
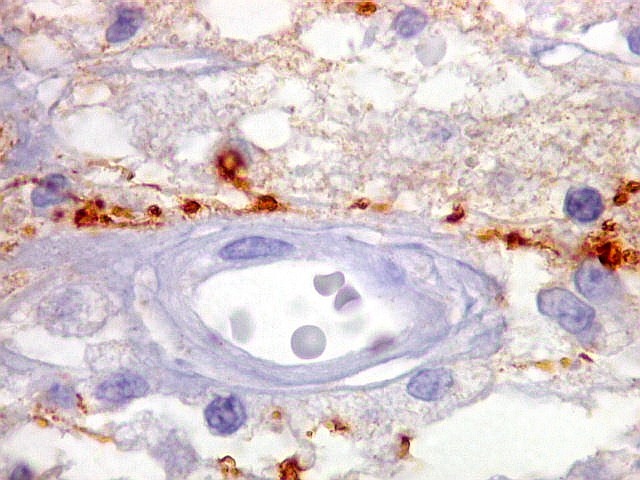
Em tumores
neurais, contudo, há alteração dos padrões
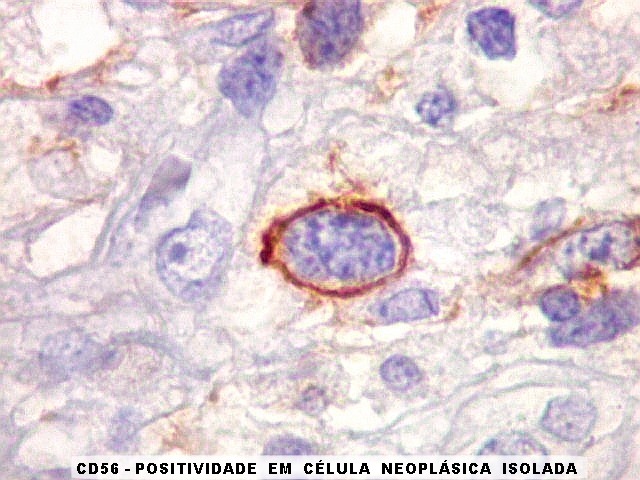
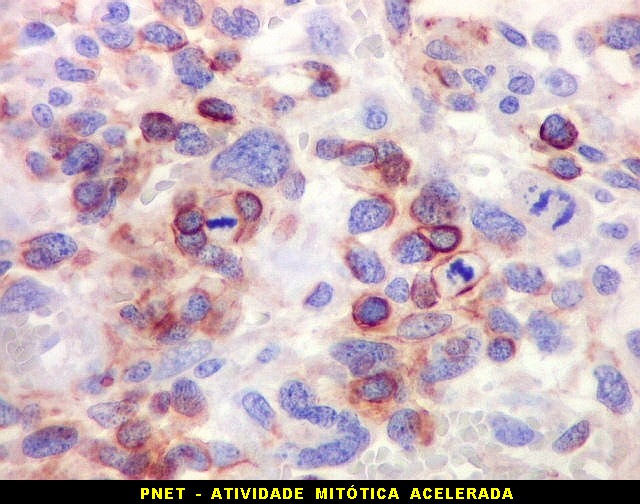
de expressão. Em tumores do tipo embrionário neuronal / neuroblástico,
como meduloblastomas, expressão da beta-tubulina classe III está
associada com diferenciação neuronal e diminuição
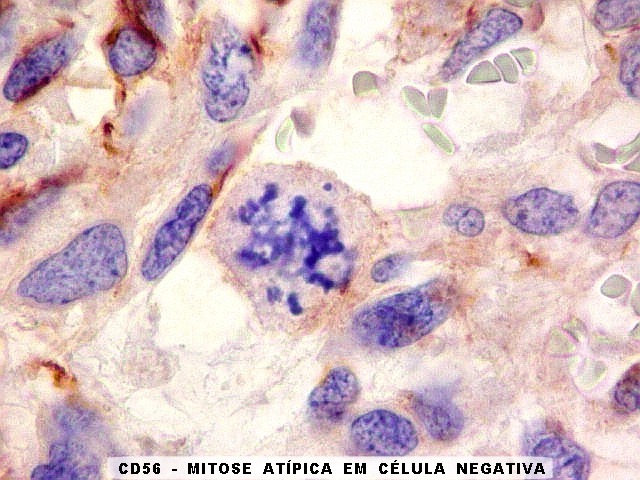
da proliferação celular. Em contraste, em gliomas ocorre
o contrário, com expressão da proteína estando associada
a graus mais altos de malignidade e altos índices proliferativos.
Esta expressão é interpretada como aberrante, e representaria
uma desdiferenciação, associada com aquisição
de fenótipo de células progenitoras gliais. Portanto, do
ponto de vista diagnóstico, a detecção de beta-tubulina
classe III em células neoplásicas não deve ser tomada
como evidência categórica de diferenciação neuronal
divergente em tumores fenotipicamente gliais (Katsetos et al. 2003).
Vários
tipos de tumores gliais expressam beta-tubulina classe III, entre eles
o glioblastoma multiforme de células gigantes e o xantoastrocitoma
pleomórfico (Martinez-Diaz et al., 2003). Também é
relatada no glioblastoma multiforme (GBM) (Katsetos et al. 2003, Yan et
al, 2011) e em oligodendrogliomas (Katsetos et al. 2002). Expressão
de marcadores neuronais é uma feição comum dos GBMs.
Em um estudo, 45 de 82 GBMs (54,8%) expressaram pelo menos um marcador
neuronal, sendo sinaptofisina o mais freqüente (Donev et al, 2010).
Em meduloblastomas, há alta expressão de beta-tubulina classe
III (91%), superando a sinaptofisina (75%) (Maraziotis et al, 1992).
É também largamente positiva em tumores neuroendócrinos
do trato gastrointestinal (83%) (Jirásek et al. 2002).
Referências
-
Donev K, et
al. Expression of diagnostic neuronal markers and outcome in glioblastoma.
Neuropathol Appl Neurobiol. 2010 Aug;36(5):411-21.
-
Fanarraga ML,
et al. Expression of unphosphorylated class III beta-tubulin isotype in
neuroepithelial cells demonstrates neuroblast commitment and differentiation.
Eur J Neurosci. 1999 Feb;11(2):517-27.
-
Jirásek
T, et al. Expression of class III beta-tubulin in neuroendocrine tumours
of gastrointestinal tract. Folia Histochem Cytobiol. 2002;40(3):305-10.
-
Katsetos CD,
et al. Localization of the neuronal class III beta-tubulin in oligodendrogliomas:
comparison with Ki-67 proliferative index and 1p/19q status. J Neuropathol
Exp Neurol. 2002 Apr;61(4):307-20.
-
Katsetos CD,
et al. Tubulin targets in the pathobiology and therapy of glioblastoma
multiforme. I. ClassIII beta-tubulin. J Cell Physiol. 2009 Dec;221(3):505-13.
-
Katsetos CD,
et al. Class III beta-tubulin isotype: a key cytoskeletal protein at the
crossroads of developmental neurobiology and tumor neuropathology. J Child
Neurol. 2003 Dec;18(12):851-66
-
Maraziotis
T, et al. Neuron-associated class III beta-tubulin isotype, retinal S-antigen,
synaptophysin, and glial fibrillary acidic protein in human medulloblastomas:
a clinicopathological analysis of 36 cases. Acta Neuropathol. 1992;84(4):355-63.
-
Martinez-Diaz
H, et al. Giant cell glioblastoma and pleomorphic xanthoastrocytoma show
different immunohistochemical profiles for neuronal antigens and p53 but
share reactivity for class III beta-tubulin. Arch Pathol Lab Med. 2003
Sep;127(9):1187-91.
-
Yan T, et al.
Neuronal markers are expressed in human gliomas and NSE knockdown sensitizes
glioblastoma cells to radiotherapy and temozolomide. BMC Cancer. 2011 Dec
20;11:524.
|