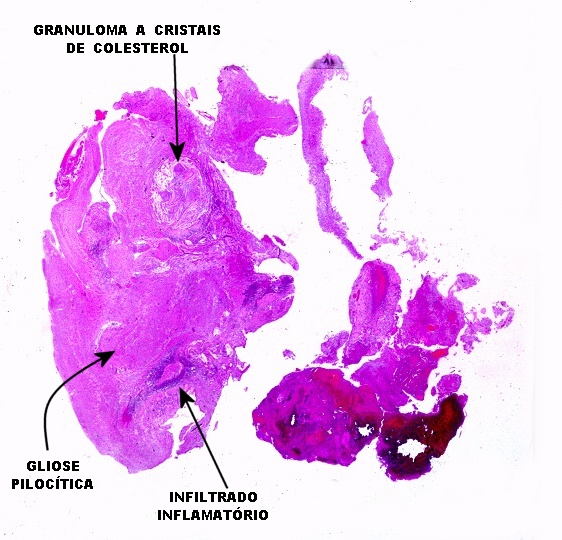
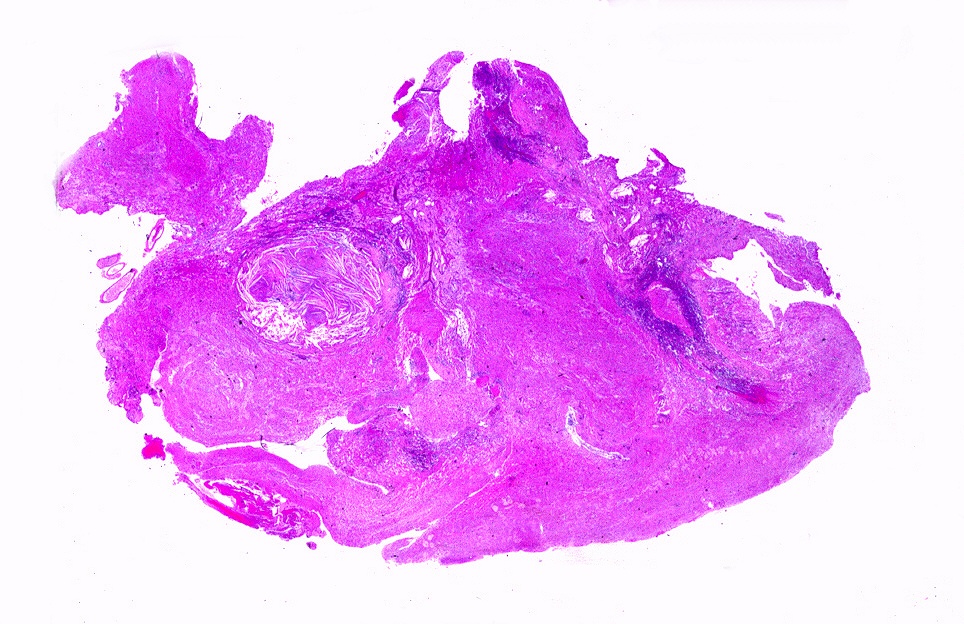
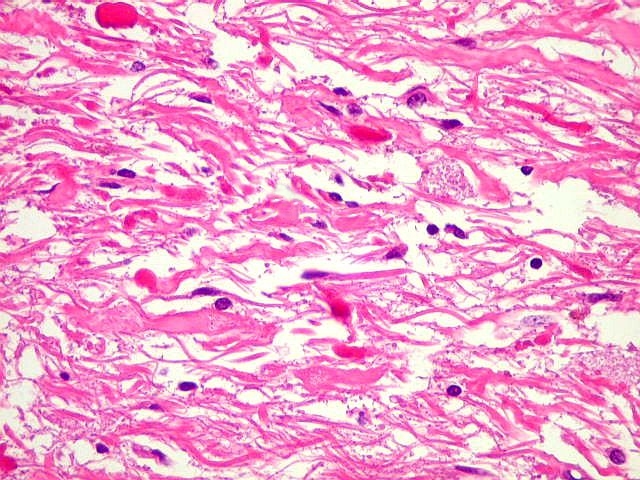
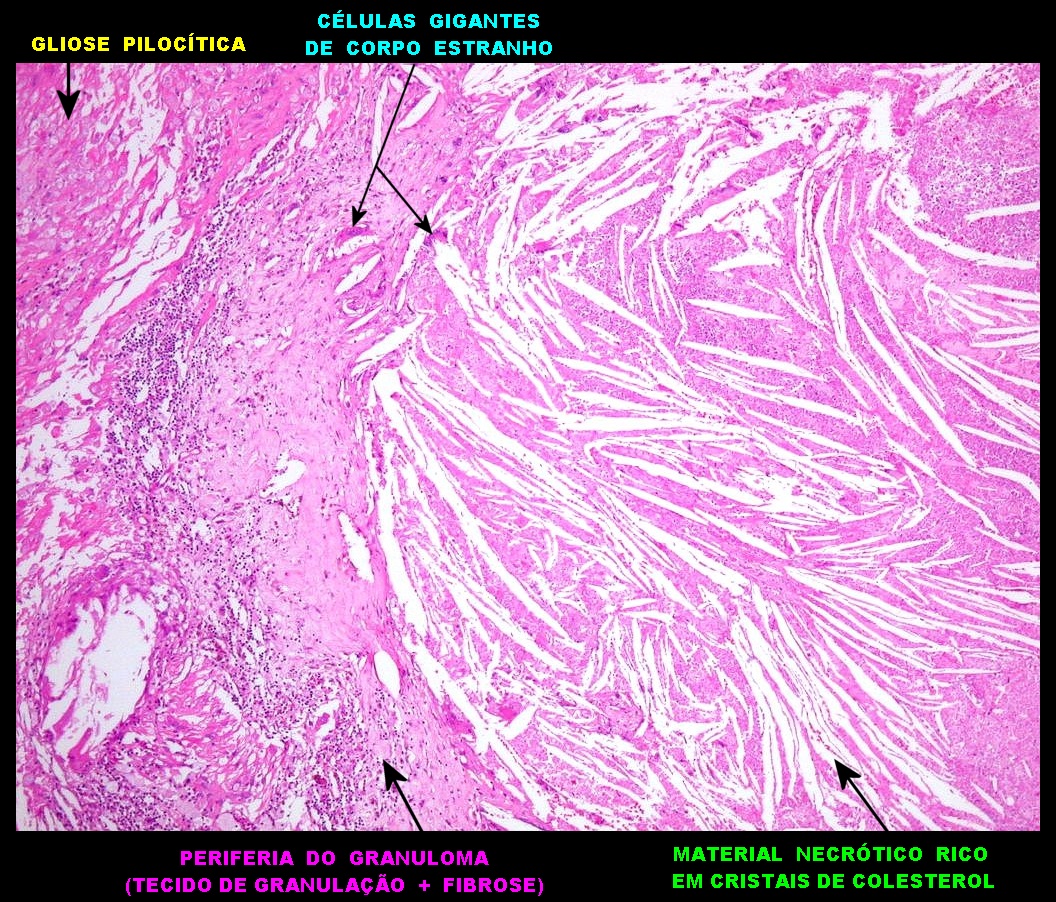
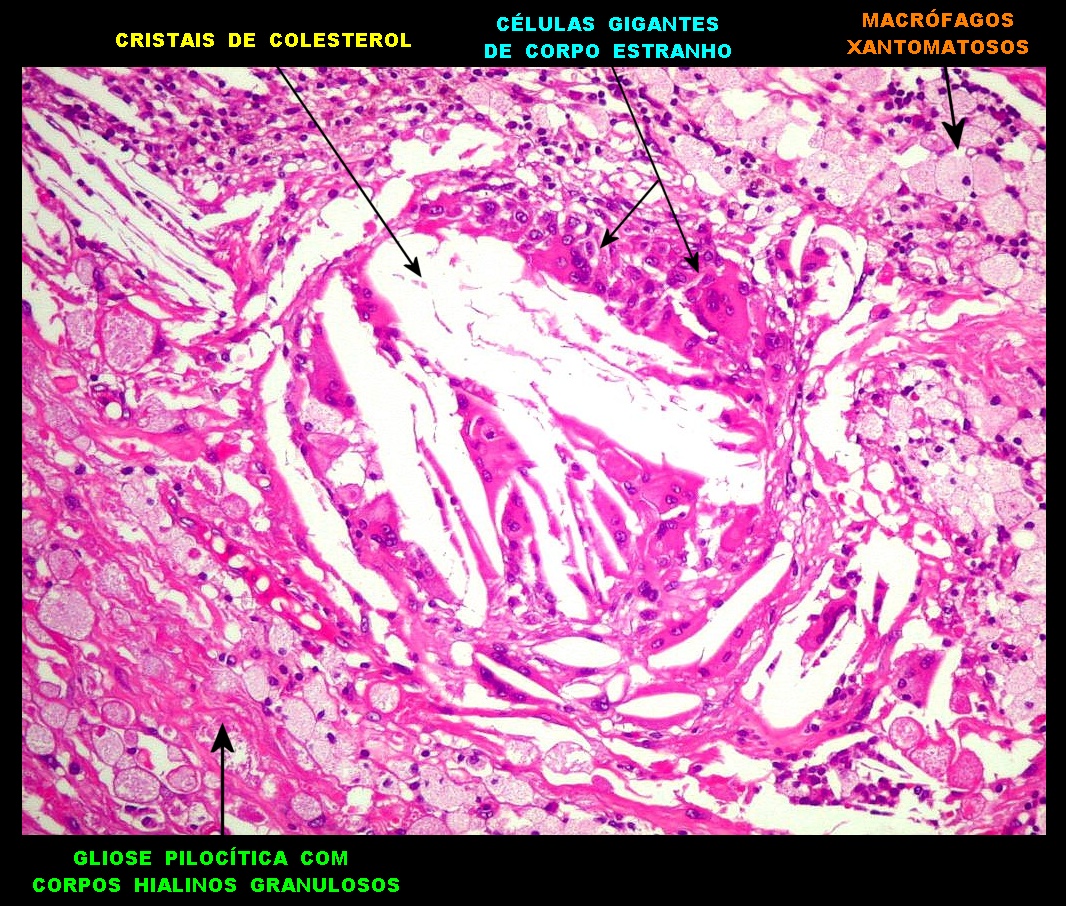
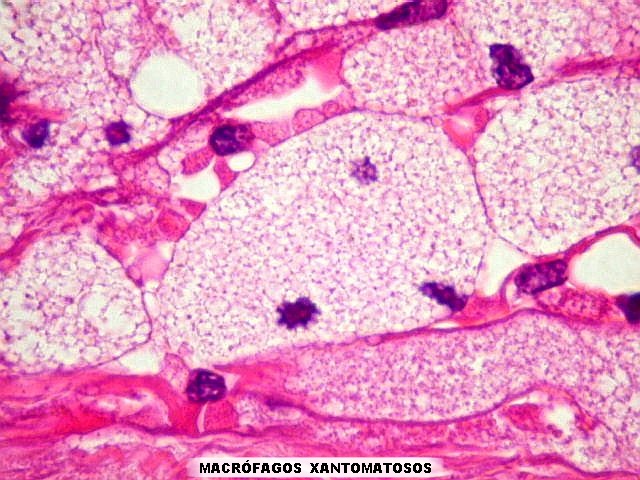
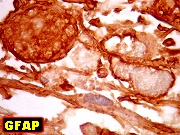
| Alfa B-cristalina
Alfa cristalina
é uma importante proteína do cristalino ocular e ocorre em
duas variedades, A e B. A variedade A é exclusiva da lente,
já a forma B ocorre em outros tecidos, inclusive no sistema nervoso
central (SNC), onde é expressada principalmente em astrócitos
e oligodendrócitos. Em condições normais esta quantidade
é baixa, mas astrócitos reativos são fortemente positivos.
A proteína
alfa B-cristalina tem homologia com proteínas de choque térmico
de baixo peso molecular, como a HSP-27 (para heat shock protein
de 27 kD). Tecidos que contêm inclusões ubiquitinadas
reagem para o anticorpo contra alfa B-cristalina. Entre eles estão
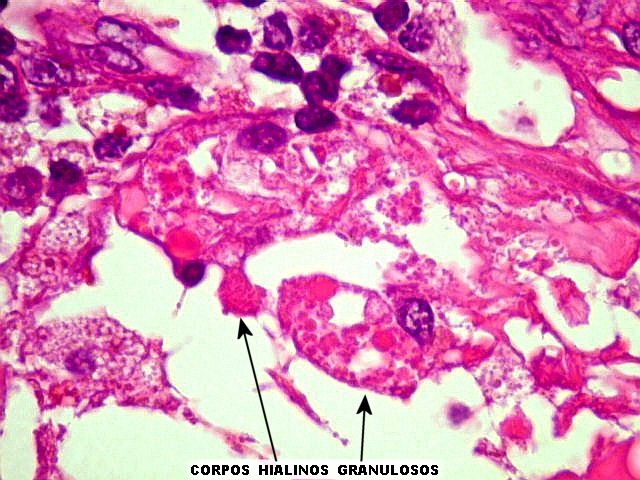
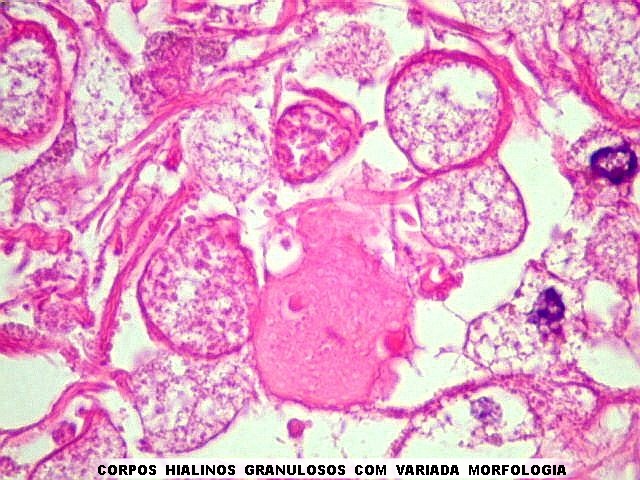
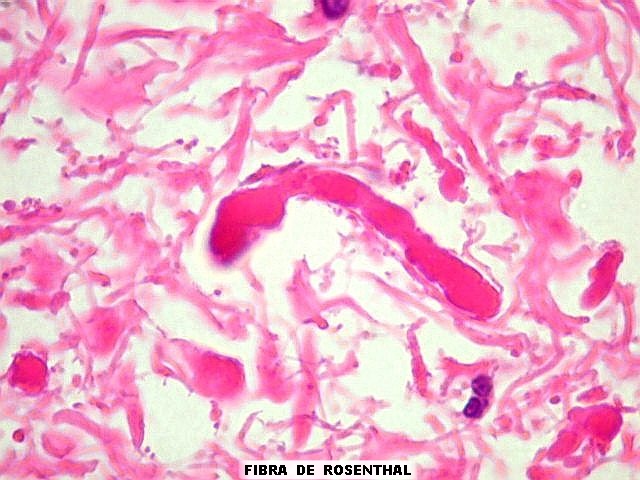
os corpos de Lewy em neurônios (uma alteração própria
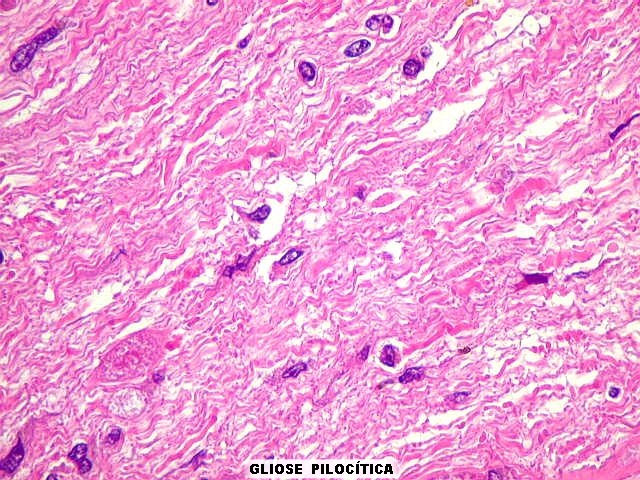
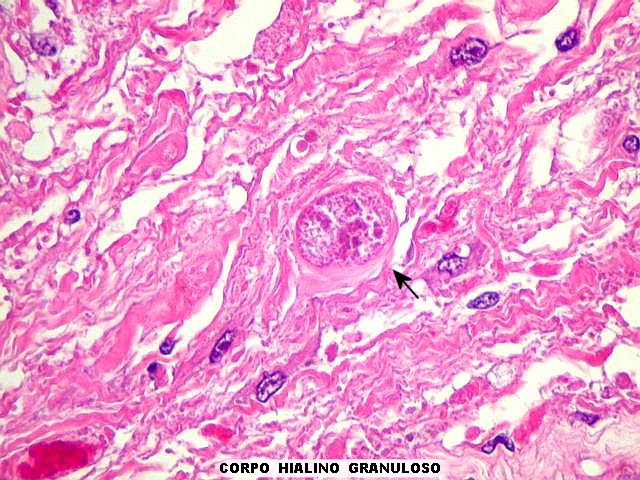
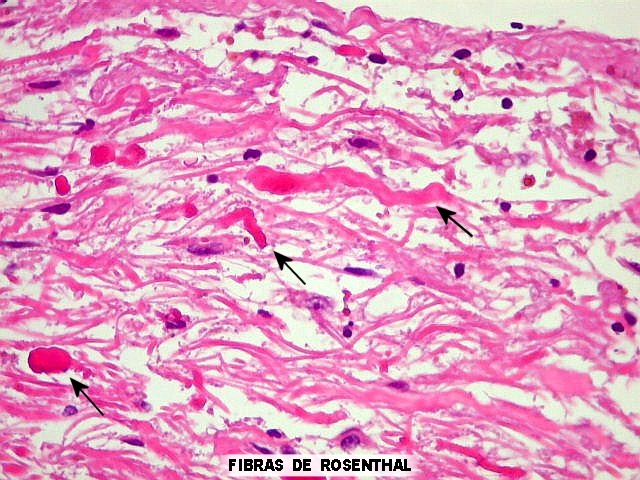
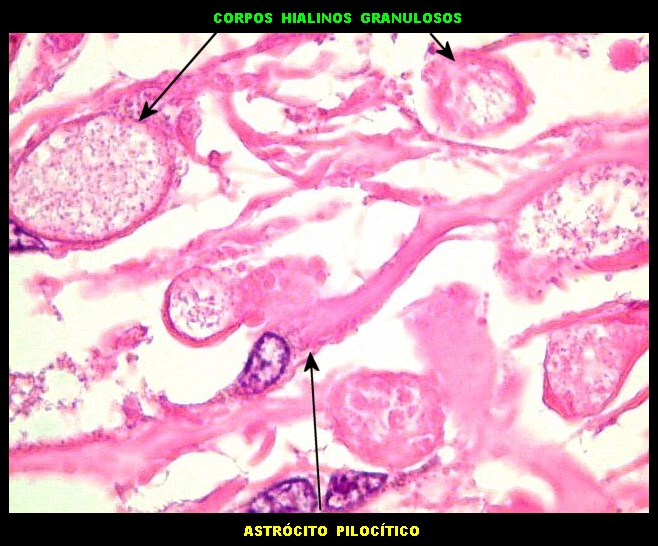
da doença de Parkinson), fibras de Rosenthal em astrócitos
pilocíticos e corpos hialinos de Mallory em hepatócitos.
Os dados da literatura sugerem que alfa B-cristalina está envolvida
na formação de corpos de inclusão ubiquitinados que
se associam a filamentos intermediários do citoesqueleto destas
células.
Proteínas
de choque térmico, proteínas chaperonas, ubiquitina.
Desenvolvimento da estrutura
espacial de uma proteína.
A estrutura primária de uma cadeia proteica é a seqüência
de aminoácidos traduzida pelo ribossomo ao ler o RNA mensageiro
da mesma. À medida que os aminoácidos vão sendo acrescentados
e a proteína vai saindo do ribossomo, a cadeia polipeptídica
dobra-se em alfa-hélices e segmentos com pregueamento beta, que
constituem a estrutura secundária. Há uma tendência
da proteína a ocultar no seu interior a grande parte dos resíduos
hidrofóbicos. Posteriormente ocorrerão várias modificações
covalentes em diferentes resíduos de aminoácidos, para dar
à proteína sua estrutura final (terciária) e permitir
sua interação com outras proteínas formando complexos
(estrutura quaternária).
O dobramento
adequado de uma cadeia proteica é auxiliado por uma classe especial
de proteínas chamadas chaperonas
(do inglês chaperone, que se traduz como companheira, dama
de companhia, guardiã, aia). Essas proteínas protegem a cadeia
proteica para evitar dobramentos errôneos, que levariam a uma proteína
errada, inativa ou até perigosa para a célula. Alguns destes
dobramentos inconvenientes causariam exposição de muitos
resíduos hidrofóbicos na superfície da cadeia. Essas
moléculas tendem a agregar-se e podem formar complexos macromoleculares
insolúveis. No processo de dobramento de uma cadeia proteica,
as chaperonas ligam-se a certas seqüências hidrofóbicas
da cadeia e, uma vez que o dobramento correto esteja concluído,
desligam-se.
As chaperonas
são incluídas entre as proteínas
de choque térmico (em
inglês, heat shock proteins ou hsp), assim chamadas
porque sua produção aumenta quando a célula é
submetida brevemente a temperaturas altas, por exemplo, a 42ºC para
células que habitualmente vivem a 37ºC. Temperaturas
altas facilitam produção de proteínas mal dobradas.
A célula responde com aumento da síntese de chaperonas, que
ajudarão estas proteínas a se redobrar corretamente.
As principais
classes de chaperonas moleculares em células eucarióticas
são as proteínas hsp60 e hsp70. As proteínas
hsp70 atuam ainda enquanto as proteínas estão sendo sintetizadas
no ribossomo, ligando-se a uma seqüência de cerca de 7 aminoácidos
hidrofóbicos antes que a cadeia proteica se desligue do ribossomo.
As proteínas hsp60 atuam após a cadeia proteica ter-se completado.
Formam uma estrutura grande em forma de barril, onde as proteínas
novas são introduzidas para isolá-las e impedir que se agreguem.
Assim elas ficam num ambiente favorável a uma redobragem correta.
Toda esta atividade de seleção e redobragem requer ATP.
Cerca de 20% de todas as proteínas recém sintetizadas são
auxiliadas pelas chaperonas do tipo hsp70 e 10% pelas do tipo hsp60.
Uma proteína
que contenha um segmento grande de aminoácidos hidrofóbicos
expostos é geralmente anormal. Pode ser que não se tenha
dobrado adequadamente ao deixar o ribossomo, pode ter sofrido uma intercorrência
que a desdobrou, ou não encontrou as proteínas normalmente
associadas a ela num complexo multimolecular. Essas proteínas não
são simplesmente inúteis, podem ser perigosas, porque o contato
com regiões hidrofóbicas de moléculas próximas
pode levar à agregação e precipitação
das mesmas, causando acúmulo intracelular e dano à célula.
As chaperonas que se ligam a estes segmentos hidrofóbicos impedem
estas proteínas de agregar. Proteínas normais que se
dobram rapidamente da maneira correta não expõem segmentos
hidrofóbicos e não são reconhecidas pelas chaperonas.
Quando os
mecanismos acima descritos de tentativa de redobramento correto falham,
entra em cena ainda outro mecanismo, que consiste na destruição
completa da cadeia proteica anormal pelos proteassomos.
Os mecanismos de controle de qualidade das proteínas produzidas
nas células são muito rígidos, levando a que cerca
de um terço de todas as proteínas sintetizadas sejam rapidamente
degradadas. Por isso, os proteassomos, que são um agregado de proteases
na forma de um barril, são abundantes e formam cerca de 1% do total
das proteínas celulares. Estão presentes em muitas cópias
tanto no citosol como no núcleo. Os sítios ativos das proteases
estão na face interna do cilindro do proteassomo. As proteínas
destinadas a destruição são marcadas por ligação
a uma cadeia de uma proteína pequena chamada ubiquitina.
Uma vez rotulada por ubiquitina (ubiquitinada),
a proteína é introduzida no proteassomo e só liberada
quando foi picada em pequenas cadeias polipeptídicas. Há
um complexo mecanismo para rotulagem com ubiquitina das proteínas
a serem destruídas. A ubiquitina liga-se ao grupo amino lateral
(em posição épsilon na cadeia do aminoácido)
de um resíduo de lisina na proteína alvo. A cadeia de ubiquitinas
é então reconhecida pelas proteínas da tampa do proteassomo.
Fonte:
-
Alberts B,
et al. Molecular Biology of the Cell, 4th Ed., Garland Science, NY, 2002;
Pp 354-62.
Referências
(obtidas em pesquisa PubMed):
-
Dabir DV, Trojanowski
JQ, Richter-Landsberg C, Lee VM, Forman MS. Expression of the small heat-shock
protein alpha B-crystallin in tauopathies with glial pathology. Am J Pathol.
2004 Jan;164(1):155-66.
-
Goldman JE,
Corbin E. Rosenthal fibers contain ubiquitinated alpha B-crystallin. Am
J Pathol. 1991 Oct;139(4):933-8.
-
Ha Y, Choi
JU, Yoon DH, Cho YE, Kim TS. Nestin and small heat shock protein expression
on reactive astrocytes and endothelial cells in cerebral abscess. Neurosci
Res. 2002 Oct;44(2):207-12.
-
Head MW, Goldman
JE. Small heat shock proteins, the cytoskeleton, and inclusion body formation.
Neuropathol Appl Neurobiol. 2000 Aug;26(4):304-12
-
Iwaki T, Iwaki
A, Tateishi J, Sakaki Y, Goldman JE. Alpha B-crystallin and 27-kd
heat shock protein are regulated by stress conditions in the central nervous
system and accumulate in Rosenthal fibers. Am J Pathol. 1993 Aug;143(2):487-95.
-
Iwaki T, Wisniewski
T, Iwaki A, Corbin E, Tomokane N, Tateishi J, Goldman JE. Accumulation
of alpha B-crystallin in central nervous system glia and neurons in pathologic
conditions. Am J Pathol. 1992 Feb;140(2):345-56.
-
Lowe J, Errington
DR, Lennox G, Pike I, Spendlove I, Landon M, Mayer RJ Ballooned neurons
in several neurodegenerative diseases and stroke contain alpha B crystallin.
Neuropathol Appl Neurobiol. 1992 Aug;18(4):341-50
-
Lowe J, McDermott
H, Pike I, Spendlove I, Landon M, Mayer RJ. alpha B crystallin expression
in non-lenticular tissues and selective presence in ubiquitinated inclusion
bodies in human disease. J Pathol. 1992 Jan;166(1):61-8.
-
Minami M, Mizutani
T, Kawanishi R, Suzuki Y, Mori H. Neuronal expression of alpha B crystallin
in cerebral infarction. Acta Neuropathol. 2003 Jun;105(6):549-54.
-
Renkawek K,
de Jong WW, Merck KB, Frenken CW, van Workum FP, Bosman GJ. alpha B-crystallin
is present in reactive glia in Creutzfeldt-Jakob disease. Acta Neuropathol.
1992;83(3):324-7.
-
Salvador-Silva
M, Ricard CS, Agapova OA, Yang P, Hernandez MR. Expression of small heat
shock proteins and intermediate filaments in the human optic nerve head
astrocytes exposed to elevated hydrostatic pressure in vitro. J Neurosci
Res. 2001 Oct 1;66(1):59-73.
-
Tseng WC, Lu
KS, Lee WC, Chien CL. Redistribution of GFAP and alpha B-crystallin after
thermal stress in C6 glioma cell line. J Biomed Sci. 2006 Sep;13(5):681-94.
-
Willwohl D,
Kettner M, Braak H, Hubbard GB, Dick EJ Jr, Cox AB, Schultz C. Pallido-nigral
spheroids in nonhuman primates: accumulation of heat shock proteins in
astroglial processes. Acta Neuropathol. 2002 Mar;103(3):276-80.
|