|
|
|
|
|
|
|
|
|
|
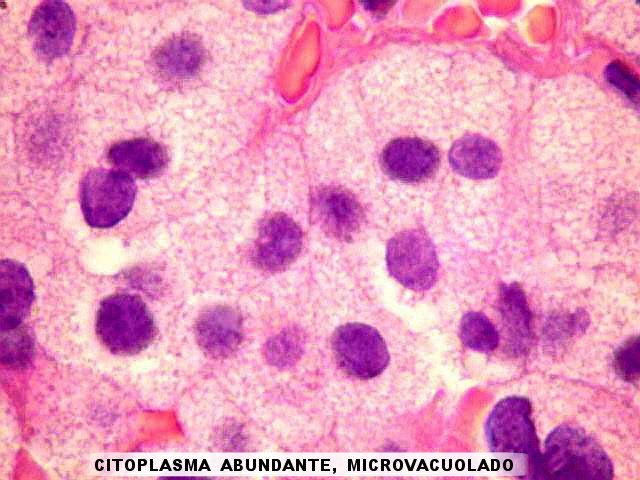
| A aparência do tumor em HE, em pequeno aumento, era o habitual em adenomas de hipófise, sendo constituído por células poligonais regulares em arranjo cordonal. Em aumento mais forte, chamava a atenção a abundância do citoplasma e o aspecto claro, como que microvacuolado, dos grânulos citoplasmáticos. Diferia do comumente observado nos adenomas eosinófilos, em que os grânulos de secreção são corados fortemente. Era também distinto dos adenomas cromófobos, que têm citoplasma escasso. | |
 |
|
 |
|
|
|
| A imunohistoquímica para hormônios hipofisários causou estranheza, pois todos os hormônios (GH, prolactina, FSH, LH, TSH, ACTH) foram fortemente positivos em todas as células, o que evidentemente teria que ser interpretado como espúrio. Abaixo, as lâminas para GH e prolactina, a título de exemplo. |
| GH. Uniformemente positivo no citoplasma, núcleos negativos. | |
| PRL. Prolactina, idêntico resultado. | |
| AE1AE3. Positivo difuso no citoplasma, com reforço na periferia. O caráter microvacuolado visto em HE também aparecia aqui. | |
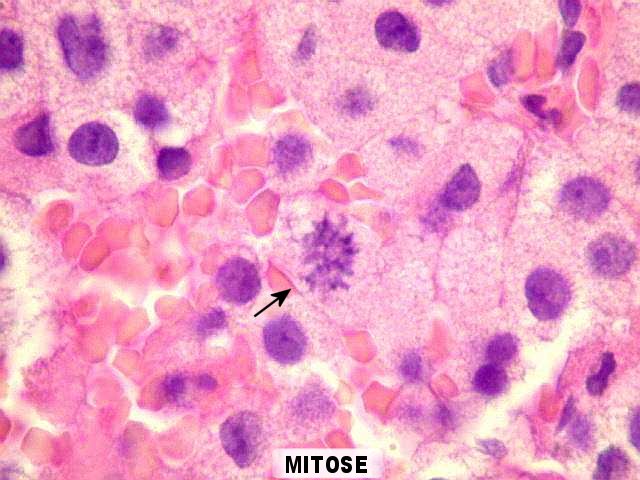
| Ki-67. Positivo em pequena parte dos núcleos (da ordem de 1%). Ausência de figuras de mitose. | |
| p53. Negativo em toda a amostra. | |
|
|
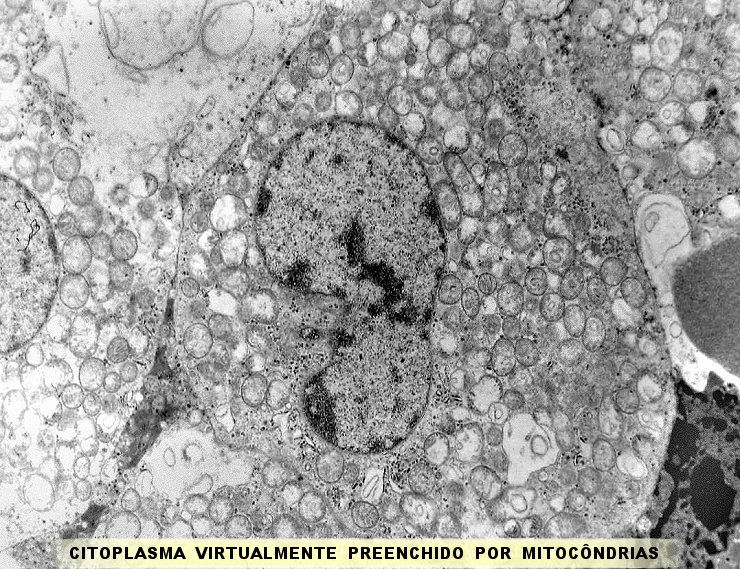
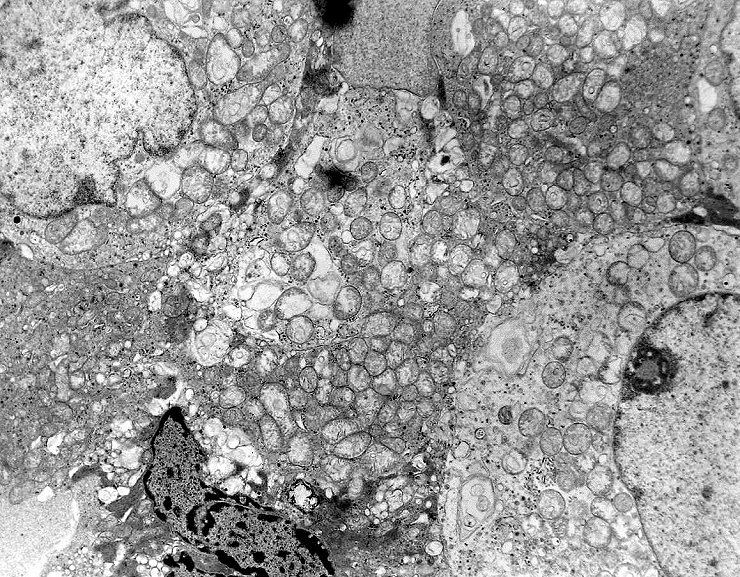
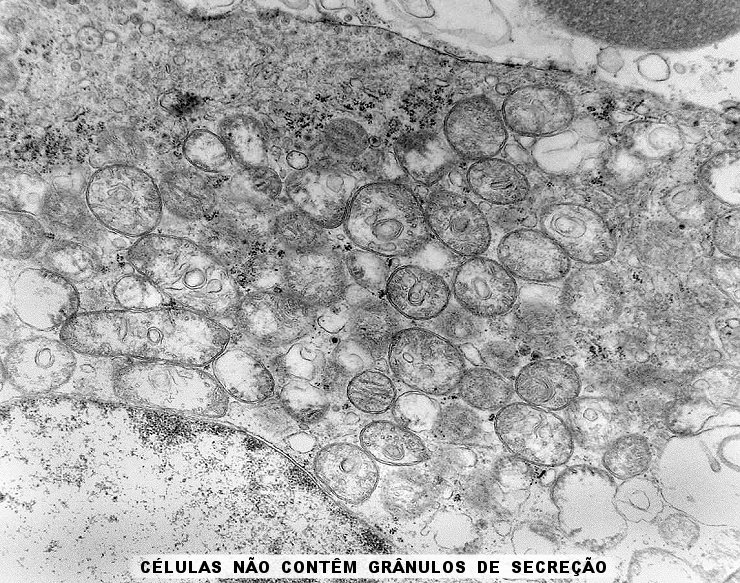
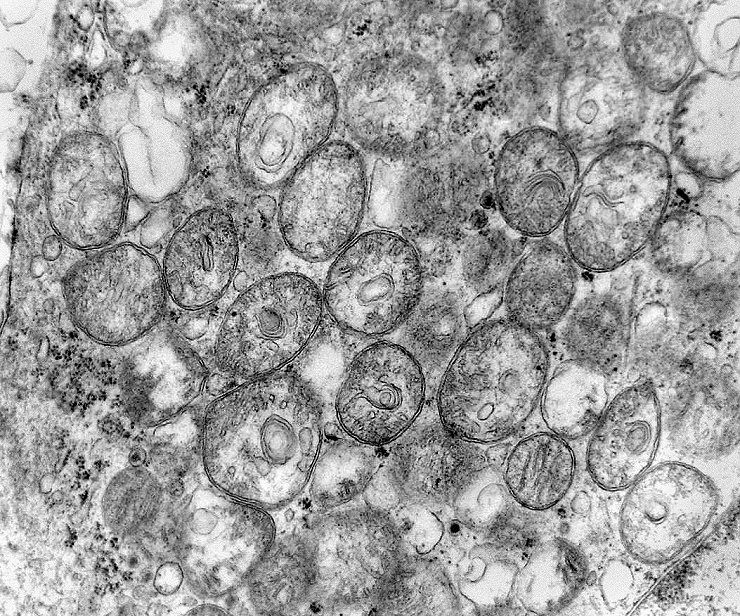
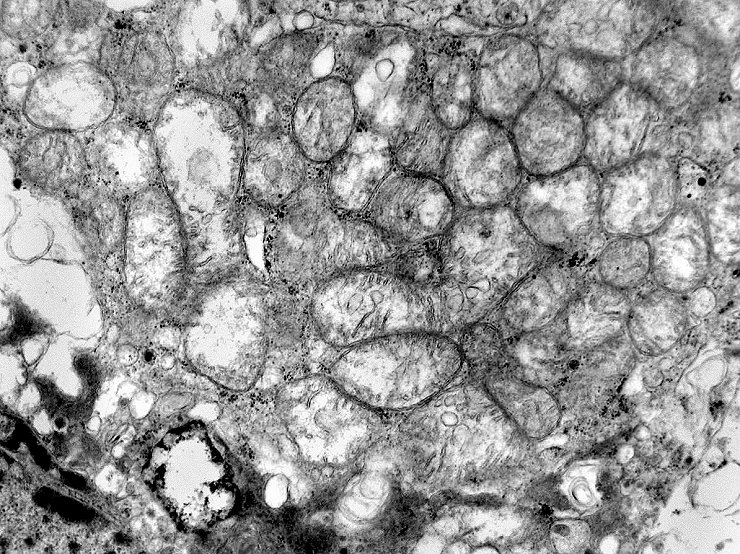
| A microscopia
eletrônica
resolveu o problema da classificação do tumor, mostrando
que as células não continham grânulos de secreção,
e que o citoplasma estava preenchido em sua maior parte por numerosas mitocôndrias,
caracterizando assim o tumor como um oncocitoma.
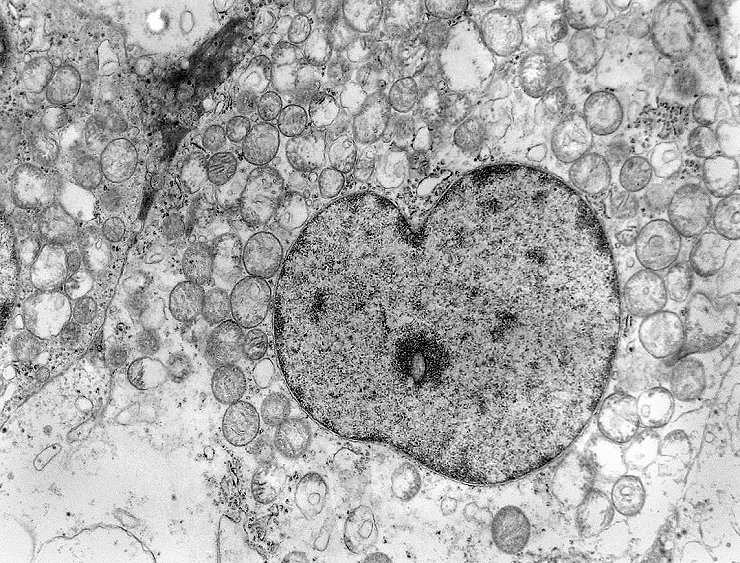
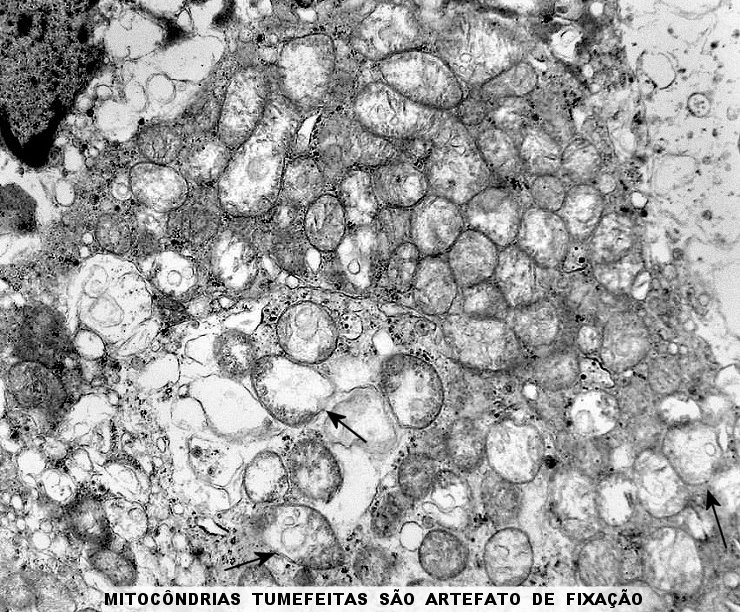
As mitocôndrias eram de tamanho e morfologia normal, exceto por alterações
secundárias à fixação sub-ótima, pois
os fragmentos foram enviados em formol e só processados para ME
após alguns dias. Há tumefação mitocondrial,
uma alteração secundária à anóxia, comum
nestas organelas. A tumefação pode responder pelo aspecto
microvacuolado visto em microscopia óptica.
Outro importante aspecto é a ausência de grânulos de secreção (geralmente eletrodensos), em concordância com a natureza não funcionante do tumor. Trata-se, portanto, de um adenoma de células null, variante oncocítica. |
 |
 |
 |
 |
 |
 |
 |
| Células
da adenohipófise.
Redesenhado do esquema de Scheithauer, ref abaixo. |
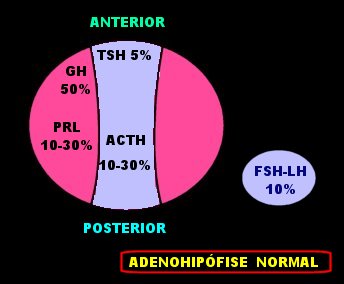 |
| A adenohipófise
pode ser dividida esquematicamente em um terço
central e dois terços laterais.
Na porção central há maior concentração de basófilos, que são células PAS positivas e, em HE, que se coram por hematoxilina (daí serem ditas basófilas), e que produzem principalmente ACTH. As células produtoras de TSH estão também situadas nesta região, mas mais anteriormente. As porções laterais têm mais células acidófilas ou eosinófilas, que se coram por eosina ou orange G, e que produzem principalmente hormônio de crescimento (GH) e prolactina (PRL). As células produtoras dos hormônios gonadotróficos FSH e LH estão distribuídas mais ou menos uniformemente pela glândula. As células que produzem os hormônios proteicos (GH e PRL) são histogeneticamente relacionadas, da mesma forma que as células que produzem os hormônios glicoproteicos TSH, FSH e LH.
|
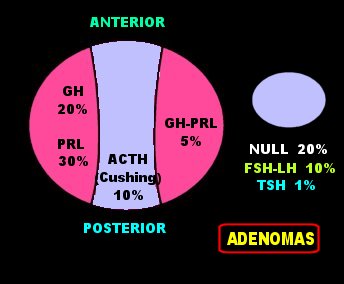
| Adenomas
da hipófise.
Redesenhado de forma simplificada do esquema de Scheithauer BW. The pituitary and sellar region. In Mills SE (ed) Sternberg’s Diagnostic Surgical Pathology, 4th Ed. Lippincott Williams & Wilkins, Philadelphia, 2004. p. 521 e segs. |
 |
| Adenomas
da hipófise.
Tumores da hipófise constituem 10 a 15 % dos tumores intracranianos. Pequenos adenomas incidentais podem ocorrer em até 27% das hipófises examinadas em autópsias. Pelo menos 1/5 da população tem anormalidades da hipófise em exames de ressonância magnética (RM). Crianças representam só 2% dos casos de adenomas da hipófise. Nelas, como nos adultos, os tumores produtores de prolactina (PRL) ou prolactinomas são os adenomas secretores mais comuns. Os adenomas secretores de ACTH são mais comuns em crianças que em adultos. Clínica. Os adenomas da hipófise podem produzir sintomas relacionados a hipersecreção dos vários hormônios. Os adenomas maiores (macroadenomas, > 1 cm), apresentam efeito de massa e causam cefaléia, panhipopituitarismo (por compressão da hipófise normal), distúrbios de campo visual e hiperprolactinemia discreta (< 200 ng/ml). Isto é devido à compressão da haste hipofisária, chamado efeito de secção da haste. Compressão do quiasma óptico leva inicialmente a quadrantanopsia superior lateral, progredindo a hemianopsia bitemporal e, eventualmente, cegueira. Como o panhipopituitarismo tem sintomas insidiosos, raramente é a causa da visita inicial ao médico. Diabetes insipidus é extremamente raro em adenomas da hipófise. Sua presença sugere outros tipos de lesão paraselar. Os adenomas da hipófise podem também invadir inferiormente os seios paranasais; lateralmente, os seios cavernosos, causando oftalmoparesias, e superiormente, o parênquima cerebral e o III ventrículo. Imagem. Radiologicamente, tumores < 10 mm são chamados microadenomas e > 10 mm, macroadenomas. Acima de 4 cm são considerados adenomas gigantes. A adenohipófise normal tem isossinal homogêneo à substância cinzenta. A neurohipófise tem hipersinal espontâneo em T1, que se acredita devido a vacúolos de fosfolípides. Com contraste, há impregnação difusa do tecido adenohipofisário. Histopatologia. Os termos cromófobo, acidófilo e basófilo são comumente associados a adenomas, mas não têm correlação com achados funcionais ou imunohistoquímicos. Na maioria, os adenomas são constituídos por proliferações monomórficas de células com núcleos redondos e uniformes, cromatina finamente granulosa, nucléolos pouco proeminentes e quantidade moderada de citoplasma. Mitoses são incomuns, e o índice Ki-67 é geralmente < 3%. Os adenomas habituais têm crescimento puramente expansivo, mas geralmente não são encapsulados. Adenomas atípicos. São assim designados adenomas com feições sugestivas de comportamento agressivo, inclusive crescimento invasivo, índice Ki-67 > 3%, e positividade nuclear extensa para p53. Contudo, é necessário encontro de metástases para o diagnóstico de carcinoma da hipófise. O crescimento invasivo pode comprometer ossos, nervos e vasos. Invasão microscópica, como a da dura-máter, é comum e não deve ser considerada indicador seguro de comportamento agressivo do tumor. Carcinomas da hipófise - muito raros, para caso clique (1) (2). Por definição, precisam apresentar metástases, que podem ser crânio-espinais ou sistêmicas. Invasão cerebral como critério de malignidade é controversa. Imunohistoquímica. Adenomas da hipófise são consistentemente positivos para sinaptofisina, com percentagem menor de marcação para cromogranina e queratinas de baixo peso molecular. A positividade para os vários hormônios é essencial para classificação funcional. Tratamento. Cirurgia é a principal modalidade de tratamento para adenomas da hipófise. A abordagem por via transesfenoidal é menos invasiva, e especialmente indicada para tumores com efeito de massa, causando perda visual por compressão do quiasma, e em tumores hiperfuncionantes com síndrome de Cushing, acromegalia ou hipertiroidismo. Outras indicações são fracasso do tratamento clínico e a apoplexia pituitária (necrose hemorrágica aguda maciça de um adenoma). Tratamento
clínico é freqüentemente usado na fase inicial para
pacientes com tumores secretores de prolactina ou hormônio de crescimento
(GH). Para os prolactinomas usam-se os agonistas da dopamina (eg. bromocriptina
ou Parlodel), que reduzem tanto a hiperprolactinemia quanto o tamanho do
tumor. Para os adenomas secretores de GH usam-se análogos
de longa ação da somatostatina, que interagem com receptores
da somatostatina nas células hipofisárias para diminuir a
secreção do hormônio. Contudo, estas drogas não
causam redução significativa no tamanho do tumor. Para
tumores produzindo síndrome de Cushing, o tratamento cirúrgico
continua o mais eficiente. Em tumores não funcionantes, tratamento
clínico tem resultados variáveis.
Fonte:
|
| Adenomas
da hipófise quanto à secreção hormonal.
Lactotrófico (25%). Causam amenorréia e/ou galactorréia na mulher, impotência no homem. 2/3 são macroadenomas (> 1 cm). O restante são microadenomas. Somatotrófico (10%). Causam gigantismo ou acromegalia. 5/6 são macro, 1/6 micro. Adenomas corticotróficos (10%) produzem síndrome de Cushing. 5/6 são microadenomas. Cerca de 2% produzem síndrome de Nelson, com pigmentação difusa da pele. Destes, 100% são macroadenomas. Adenomas gonadotróficos correspondem a 7 a 15 %. Geralmente são funcionalmente silenciosos e podem causar hipogonadismo devido a efeito de massa. 95% são macroadenomas. Adenomas tireotróficos são raros – cerca de 1%. Podem estar associados a hiper- ou hipotiroidismo. Geralmente são macroadenomas invasivos. Adenomas plurihormonais correspondem a cerca de 10%. Geralmente causam acromegalia e hiperprolactinemia. ¾ são macroadenomas. Os chamados adenomas de células null correspondem a cerca de 20% dos adenomas hipofisários, sendo 14% da variedade não oncocítica e 6 % da variedade oncocítica ou oncocitomas. Não produzem hormônios, mas pode haver discreta hiperprolactinemia devido a compressão da haste hipofisária. 95% são macroadenomas que se manifestam pelo efeito de massa, causando hipopituitarismo, distúrbios visuais e cefaléia. Os não oncocíticos são cromófobos e contêm muito poucos grânulos secretórios. Os oncocíticos aparecem como acidofílicos devido à grande quantidade de mitocôndrias, e não pela presença de grânulos de secreção. Clinicamente, não há diferença entre as duas variedades. Extraído de Scheithauer BW. The pituitary and sellar region. In Mills SE (ed) Sternberg’s Diagnostic Surgical Pathology, 4th Ed. Lippincott Williams & Wilkins, Philadelphia, 2004. p. 521 e segs. |
| Oncocitomas.
Oncocitomas são tumores observados em muitos tecidos, particularmente glândulas, como a tiróide (onde também são chamados de tumores de células de Hürthle), paratiróide (adenomas oxifílicos), adrenais, glândulas salivares, adenohipófise, pâncreas e rim. São constituídos por células oncocíticas ou oxifílicas. Estas são células epiteliais contendo abundante quantidade de mitocôndrias, que dão aspecto granuloso e eosinófilo ao citoplasma e volume celular aumentado, origem do termo oncocito . O termo oncocito foi primeiramente empregado por Hamperl (1931) segundo a palavra grega 'onkousthai' (que significa inchar, tornar-se maior). O termo oncocitoma foi introduzido por Jaffé em 1932. Em microscopia eletrônica, o citoplasma está preenchido por abundantes mitocôndrias, que podem ser morfologicamente normais ou anômalas. A causa da alteração é desconhecida, admitindo-se que o aumento do número de mitocôndrias seria uma reação compensatória a defeitos na cadeia respiratória, o que já foi demonstrado em certos tecidos, como no fígado. Os mecanismos moleculares exatos, porém, não são conhecidos. Oncocitomas na hipófise. Na hipófise, os oncocitomas foram descritos pela primeira vez por Kovacs e Horvath, e Landolt e Oswald, em 1973. São considerados atualmente uma variante dos adenomas não secretantes (null cell adenomas) e não produzem hormônios em níveis detectáveis por métodos laboratoriais ou imunohistoquímicos. Os adenomas null correspondem a cerca de 20% dos adenomas da hipófise. Quase todos adenomas null são macroadenomas. Como não têm efeitos endócrinos, chamam a atenção por seu efeito de massa, como compressão do quiasma óptico e alteração visual. A maioria dos pacientes tem evidência clínica ou laboratorial de hipopituitarismo (Scheithauer, 2004). Dependendo da quantidade de mitocôndrias, podem aparecer em microscopia óptica como cromófobos ou oncocíticos, uma distinção que não tem importância clínica. Schmid et al. (2001) demonstraram mRNA para GH em 42% de 31 oncocitomas e para beta FSH em 78% de 32 adenomas null. Estes sinais são, contudo, ineficientes para induzir secreção, já que não foi possível detectar estes hormônios por imunohistoquímica. Além disso, em 94% dos oncocitomas foram encontrados pelo menos dois tipos de mRNA. Isto sugere que eles se originem de células pluripotenciais, capazes de produzir vários hormônios. Terada et al. (1995) estudaram a produção hormonal de 647 adenomas de hipófise usando imunohistoquímica e microscopia eletrônica. Prolactinomas representaram 26,3%, adenomas produtores de GH 12,5%, de ACTH 12,4 %, e gonadotrofinas 9,4%. Os oncocitomas constituiram 12,4% da casuística. 73% dos prolactinomas ocorreram em mulheres e 73.8% dos oncocitomas em homens. Niveiro et al. (2004) estudaram a incidência de transformação oncocítica em 65 adenomas, usando anticorpos antimitocôndria. Observaram 8 casos com 50% ou mais de células oncocíticas, dos quais 6 eram adenomas gonadotróficos e 2 não secretantes (null cell). Concluíram que adenomas com transformação oncocítica eram estatisticamente mais freqüentes em pacientes mais idosos, mas não tinham agressividade maior (i.e. extensão extraselar ou índice de proliferação Ki-67 alto) que os não oncocíticos. Em IH, mitocôndrias podem ser avaliadas por anticorpos contra mitochondrial protein (MP), citocromooxidase (COX) e manganês-superóxido-dismutase (Mn-SOD). Todos são significativamente mais abundantes em oncocitomas que em adenomas null (Nishioka et al, 1997). Oncocitos e oncocitomas em outros tecidos. Oncocitos e tumores deles derivados são observados em muitos tecidos, particularmente glândulas, como a tiróide (onde também são chamados de tumores de células de Hürthle), paratiróide (adenomas oxifílicos), adrenais, glândulas salivares, pâncreas e rim. Oncocitos são encontrados freqüentemente em tecidos humanos metabolicamente ativos, como a tiróide e seus tumores. Quando a proporção de oncocitos num tumor tiroidiano passa de 75%, o tumor é referido como oncocítico ou de células de Hürthle, podendo corresponder a adenomas ou carcinomas. Dettori et al. (2003) encontraram alta incidência de cariótipos aneuplóides em nódulos tiroidianos foliculares constituídos por oncocitos, sugerindo uma relação causal entre os dois achados. Na parótida, oncocitos são raros antes dos 50 anos, aumentam em freqüência nos anos subseqüentes e tornam-se comuns após os 70 anos. São considerados uma alteração própria do envelhecimento (Martinez-Madrigal et al. 1997). No SNC, descreve-se transformação oncocítica no plexo coróideo e seus tumores, principalmente em adultos, sem implicações prognósticas (Giangaspero e Cenacchi, 1999). Tanji et al. (2000) mostraram alterações oncocíticas no plexo coróideo de pacientes com síndrome de Kearns-Sayre, uma doença multisistemática devida a defeitos na fosforilação oxidativa e associada a alterações no DNA mitocondrial (rearranjos, deleções, duplicações). Em 2 casos de autópsia, demonstraram que as alterações principais foram deleções (Delta-mtDNAs) e diminuição na expressão de proteínas codificadas por mtDNA. A alteração oncocítica ocorre também em hepatócitos, principalmente em hepatites crônicas e cirroses (Tanji et al., 2003). Usando 7 casos de cirrose, sendo 6 com oncocitos, os autores observaram que 80% dos oncocitos mostraram deficiência histoenzimática e imunohistoquímica de citocromooxidase e da subunidade I do complexo IV, que são codificadas por DNA mitocondrial. Já a succinato-desidrogenase e uma subunidade do complexo III, que são codificadas por DNA nuclear, estavam preservadas. Três casos com oncocitos estudados com Southern blot mostraram deficiências de mtDNA de 66%, 71% e 85%. Os autores concluíram que oncocitos hepáticos apresentam deficiências significativas de DNA mitocondrial e enzimas da cadeia respiratória codificadas por mtDNA, e que estas alterações devem ser importantes na patogênese da transformação oncocítica. Referências.
|
| Caso do Serviço de Neurocirurgia da Santa Casa de Limeira, gentilmente contribuído pelo Dr. Paulo Roland Kaleff. |
| Para TC e RM deste caso, clique » | 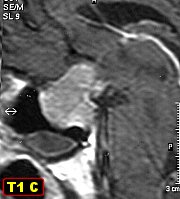 |
| Outro caso de oncocitoma da hipófise : | Imagem | Patologia |
| Mais sobre adenomas da hipófise | ||||||
| Peça GE-20 | Peça GE-32 | Lâmina A.238 | Banco de Imagens | Neuropatologia | Neuroimagem | Características de imagem |
| Textos de apoio: | Hipófise normal | Adenomas | Adenoma de hipófise ectópico | Oncocitomas | Prolactina e seu controle hipotalâmico |
| Casos de adenoma de hipófise invasivo | imagem (1) (2) (3) | patologia (1) (2) (3) |
| Caso de carcinoma da hipófise com metástases hepáticas (1968) | Peça GE-17 | Banco de imagens | Carcinoma da hipófise com metástases
pulmonares:
imagem, patologia |
Sobre carcinomas da hipófise |
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|