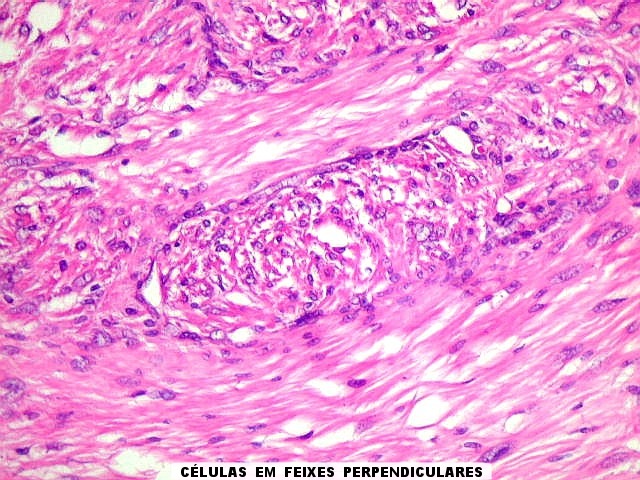
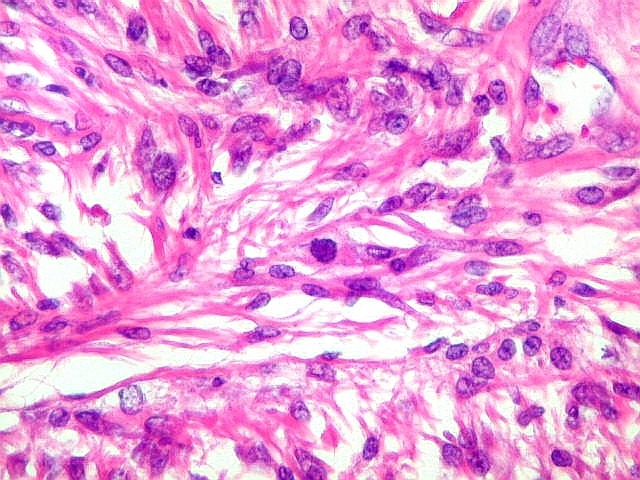
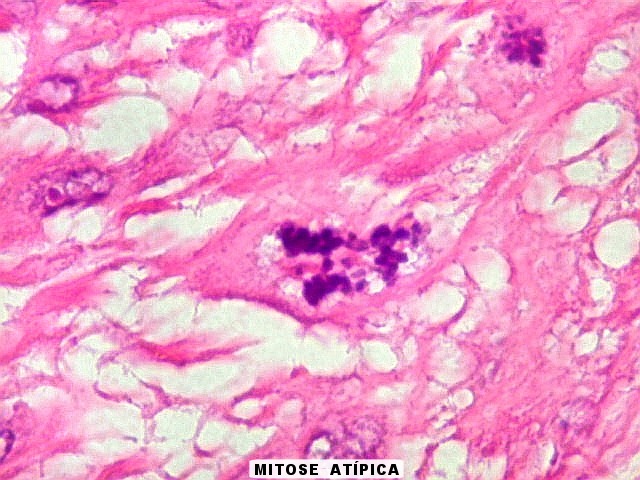
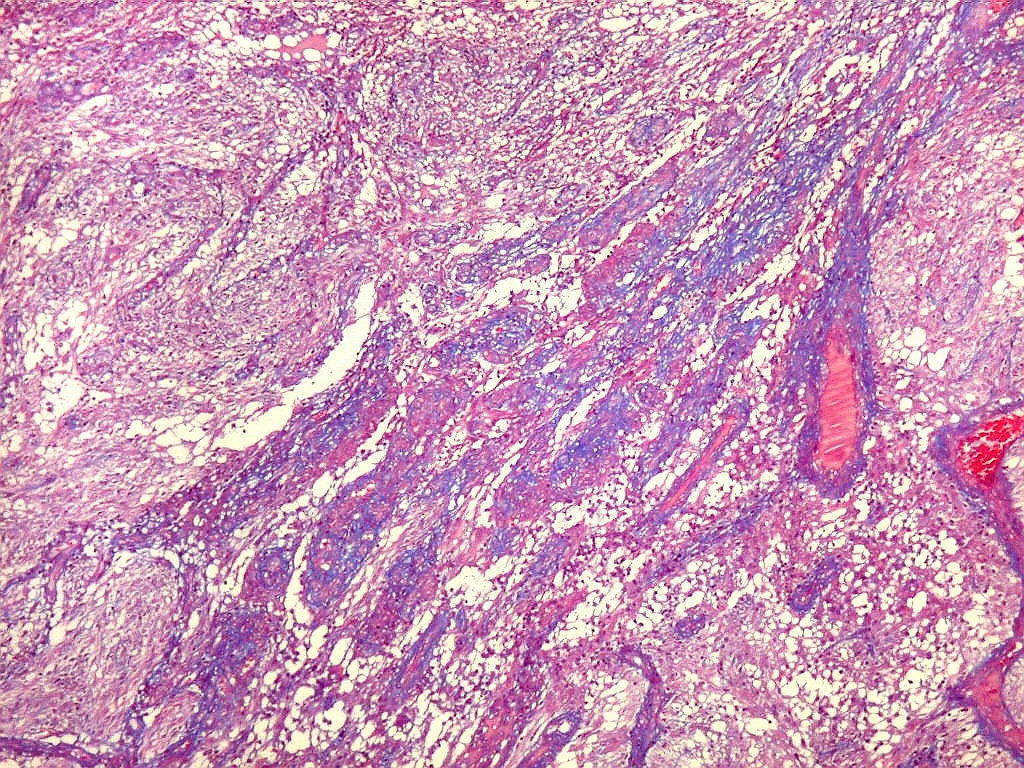
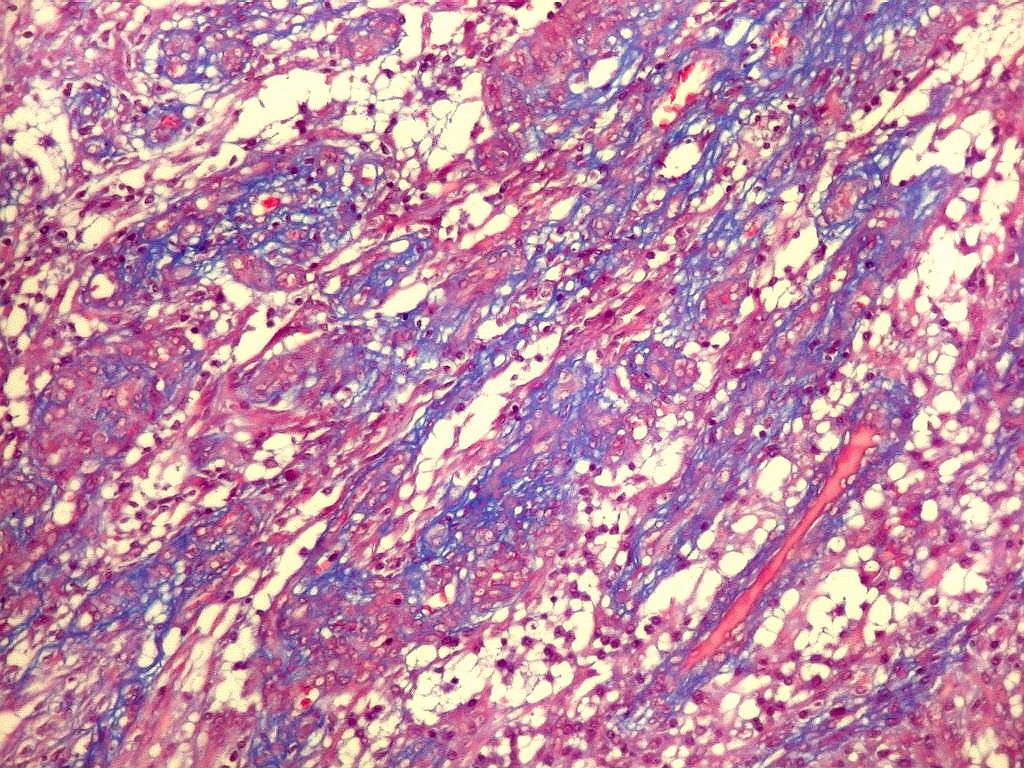
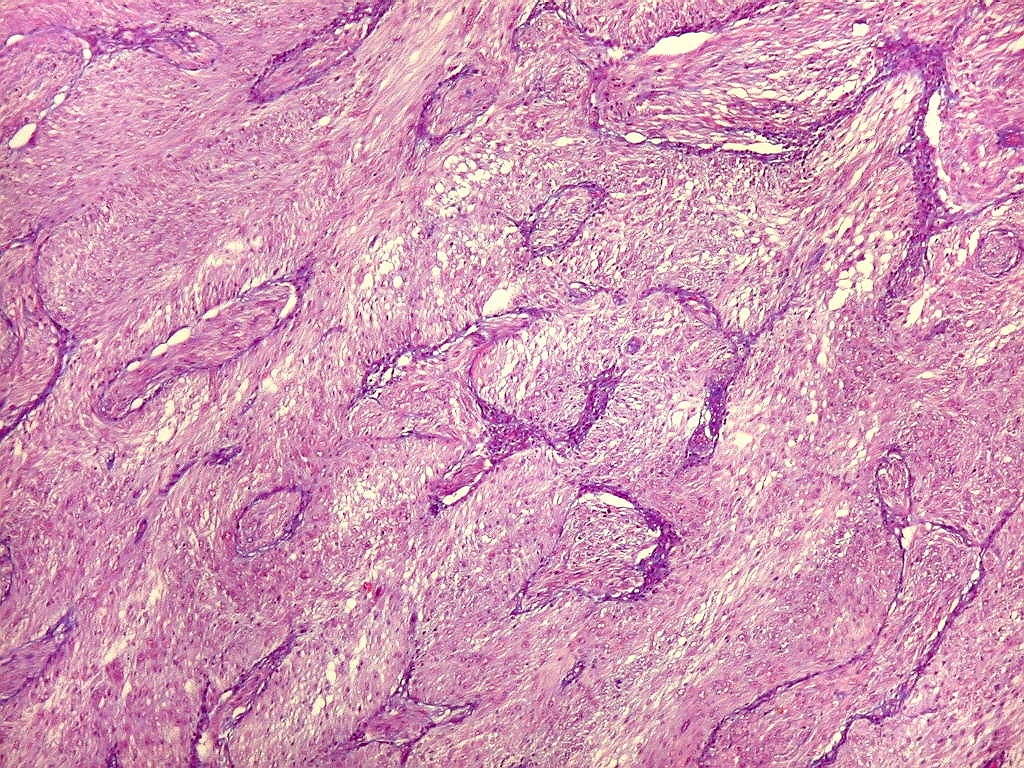
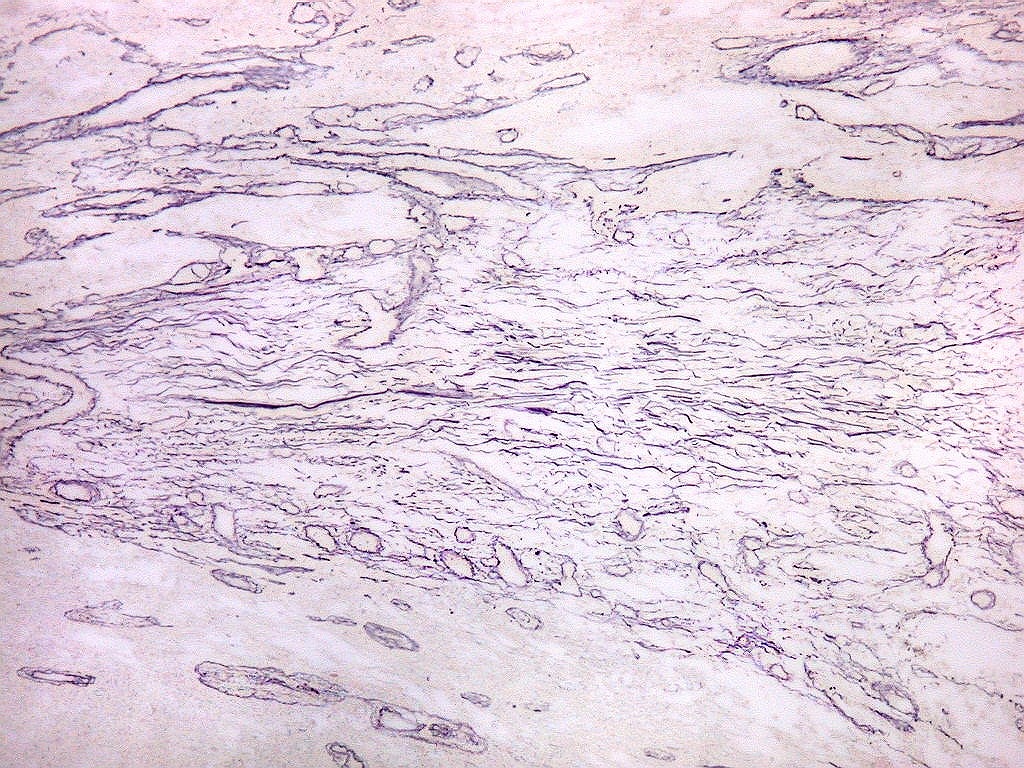
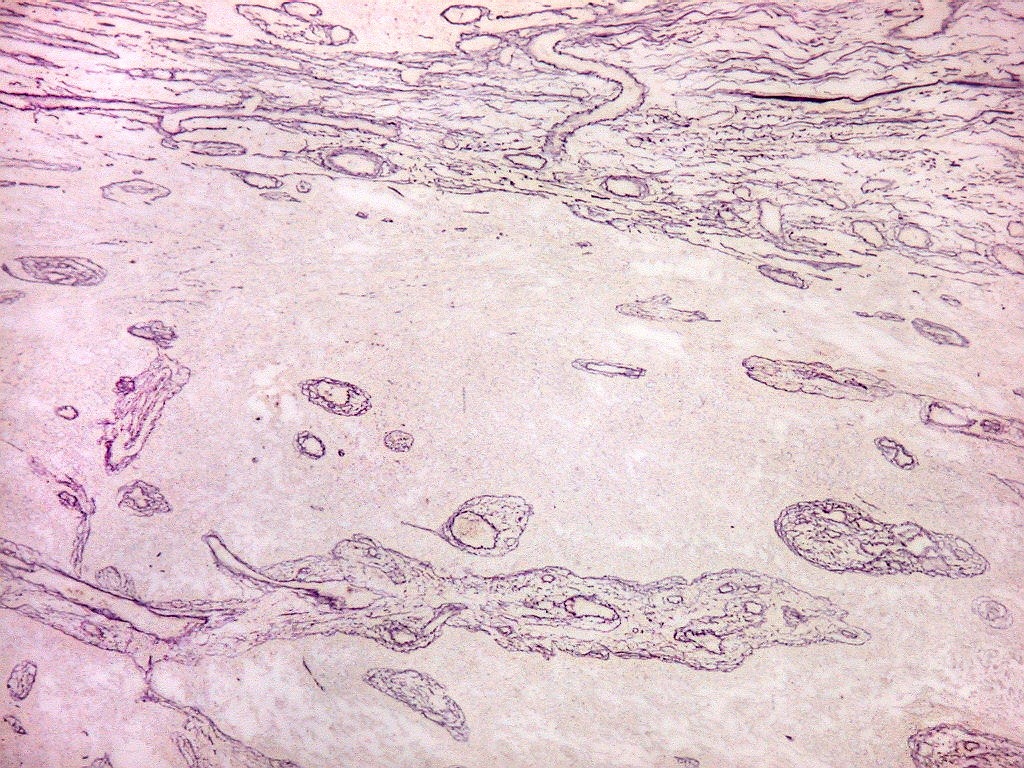
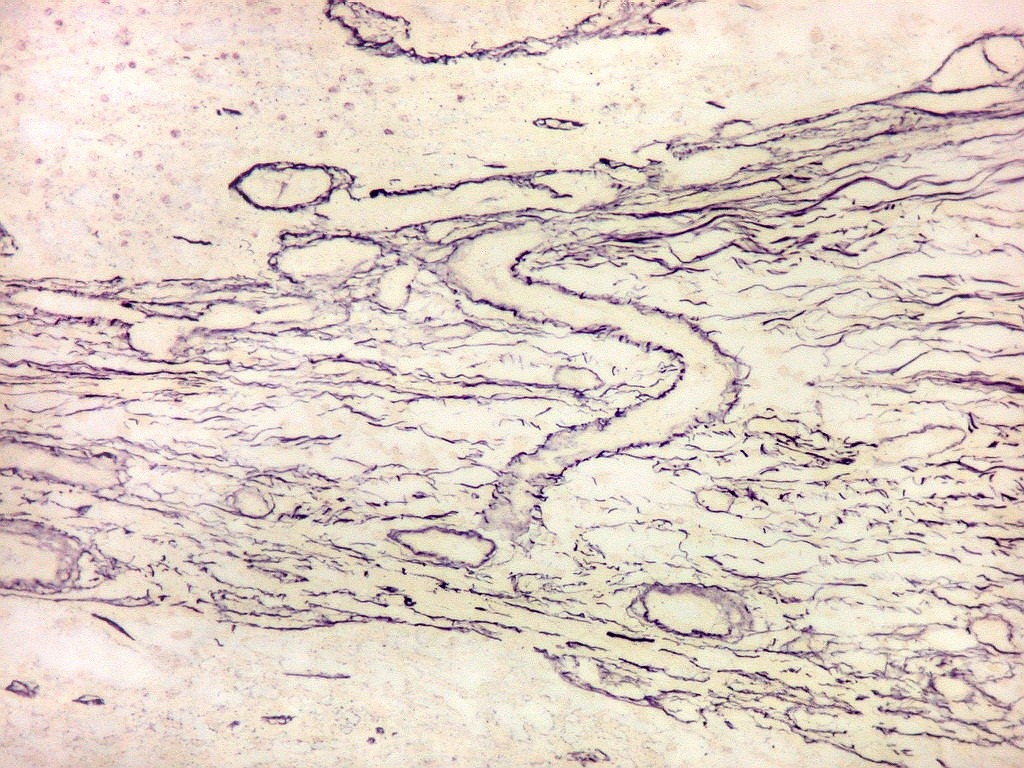
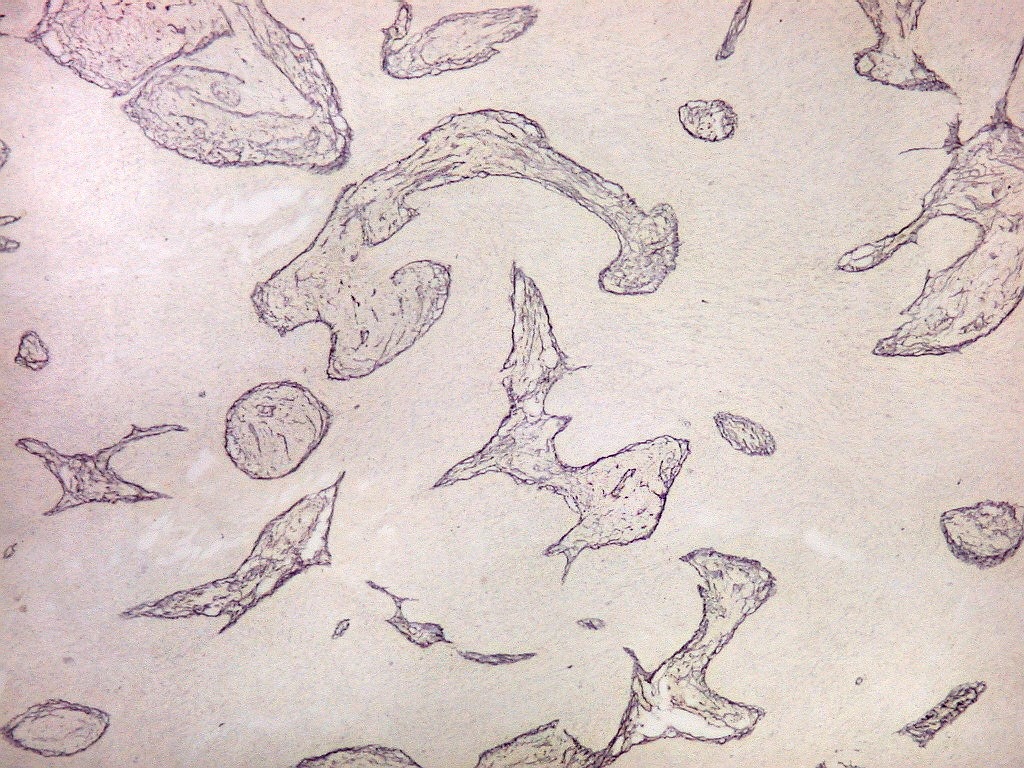
| Fibras
do tecido conjuntivo.
As fibras
do tecido conjuntivo são de três tipos : colágenas,
elásticas e reticulínicas. As colágenas e reticulínicas
são variedades de colágenos fibrilares (respectivamente tipos
I e III). Os colágenos são sintetizados em grandes
quantidades por células do tecido conjuntivo, como fibroblastos
e osteoblastos, e secretados para o espaço extracelular, onde ocorre
a polimerização para formar as fibrilas. São os principais
componentes da pele e ossos, e as proteínas mais abundantes do corpo
em mamíferos, onde correspondem a 25% da massa total de proteína.
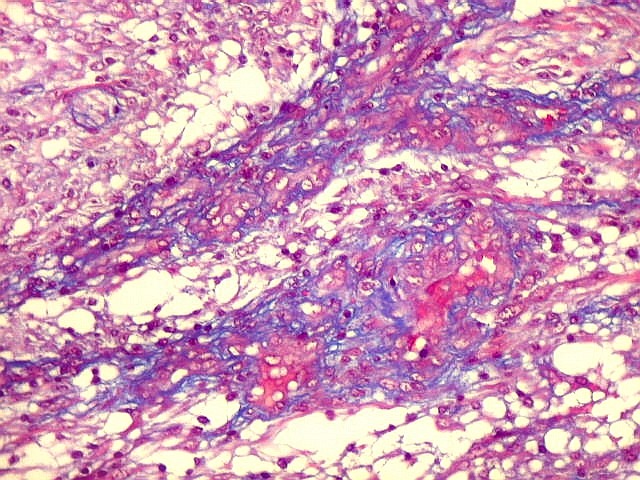
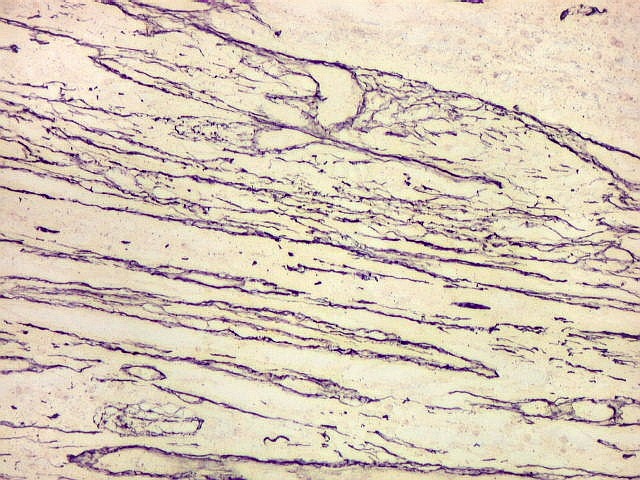
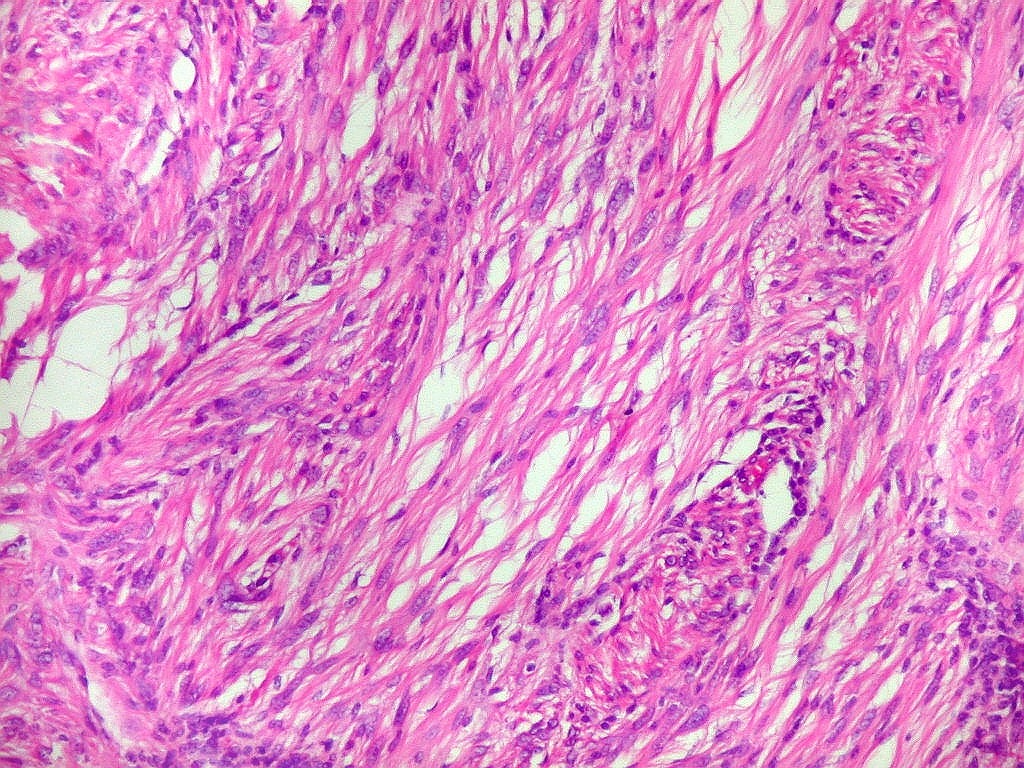
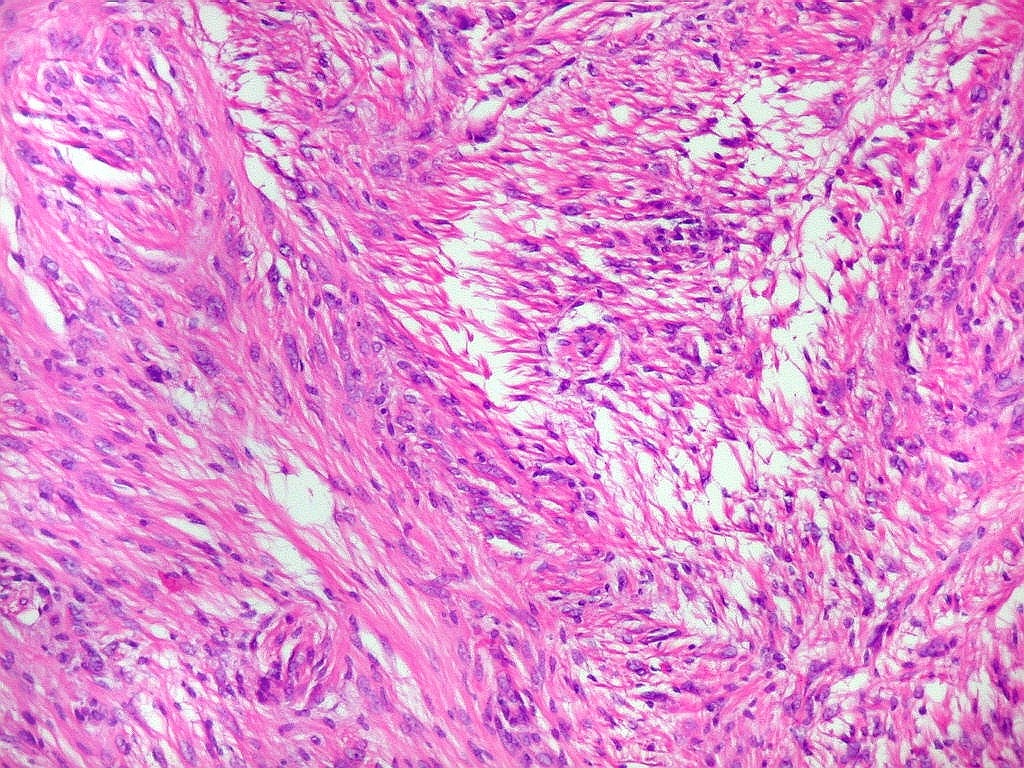
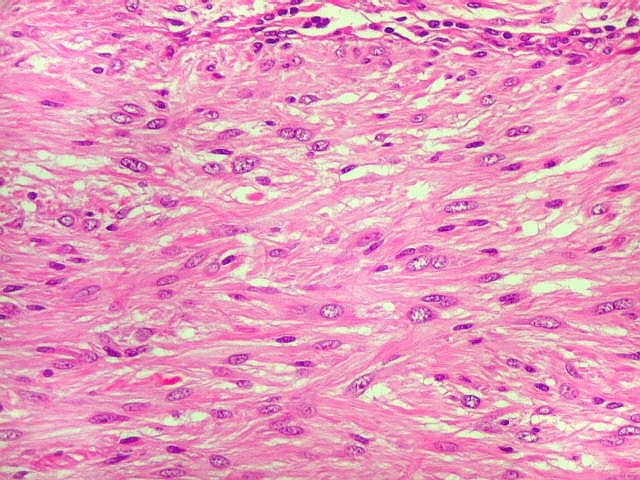
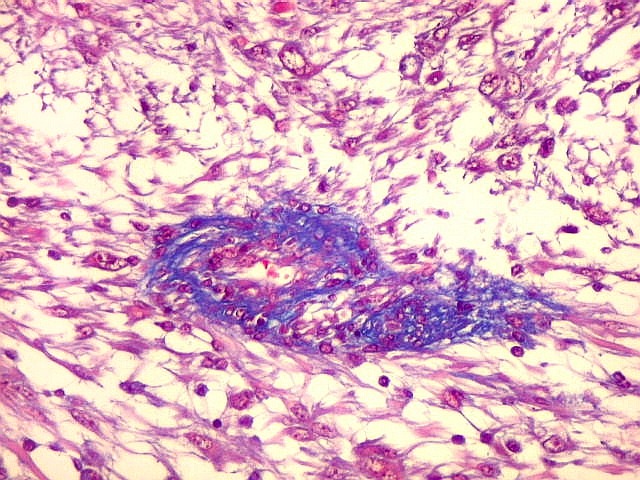
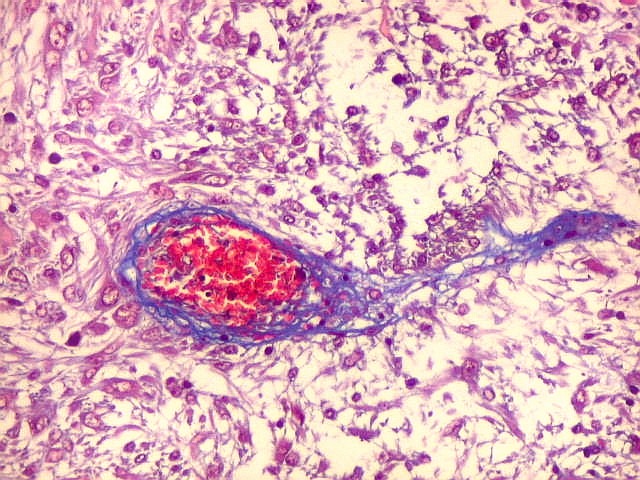
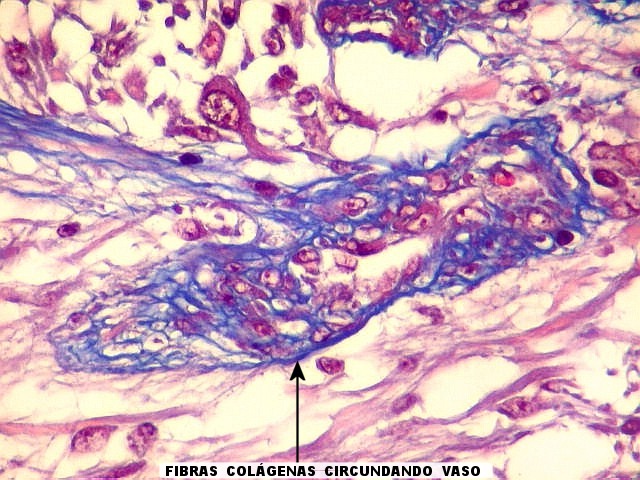
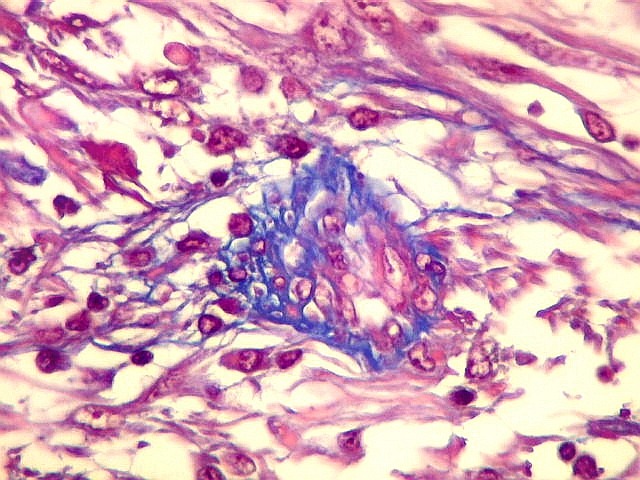
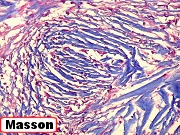
Fibras colágenas.
As fibras
colágenas são o tipo principal e mais abundante. São
flexíveis e têm alta resistência a estiramento. Com
microscopia óptica, aparecem como estruturas onduladas de espessura
variável e comprimento indefinido, que se coram pela eosina e pelo
azul de anilina, este usado no tricrômico de Masson.
Em microscopia
eletrônica, as fibras colágenas consistem de feixes de subunidades
cilíndricas de comprimento longo, as fibrilas colágenas.
A espessura (diâmetro transversal) das fibrilas colágenas
é variável, mas podem chegar a cerca de 200 nm em tendões
ou outros tecidos que suportam forças tenseis. As fibrilas
mostram estriações transversais muito próximas, que
se repetem a cada 68 nm ao longo da fibrila. Este bandeamento reflete
o arranjo escalariforme das moléculas da proteína colágeno.
Cada molécula
de colágeno mede cerca de 300 nm de comprimento e 1,5 nm de espessura
e é formada por 3 cadeias polipeptídicas (cadeias alfa),
arranjadas em tripla hélice. Exceto em suas extremidades, cada terceiro
aminoácido da cadeia é uma glicina. A posição
X após uma glicina é freqüentemente ocupada por uma
prolina, e a posição Y precedendo uma glicina é freqüentemente
ocupada por uma hidroxiprolina. A alta proporção destes
aminoácidos é essencial para a conformação
em tripla hélice. A glicina, sendo o menor dos aminoácidos
(só um hidrogênio como cadeia lateral), permite a íntima
associação das três cadeias alfa que formam a tripla
hélice. A prolina tem estrutura em anel, que estabiliza a conformação
em hélice de cada cadeia alfa.
As cadeias
alfa não são iguais e, de acordo com diferenças químicas
entre elas, mais de 18 tipos de moléculas de colágeno já
foram descritas.
O colágeno
mais comum é o tipo I, que responde por mais de 90% do colágeno
do corpo. É um dos principais constituintes da pele (derma), ossos,
ligamentos, tendões, fascias, esclera do globo ocular, dentina,
e cápsulas dos órgãos. Sua principal propriedade é
resistência à tensão. No colágeno tipo
I uma das cadeias alfa difere das outras duas. Associados à
cadeia de aminoácidos há grupos açúcar ligados
covalentemente aos resíduos de hidroxilisina. Por isso o colágeno
é, na verdade, uma glicoproteína.
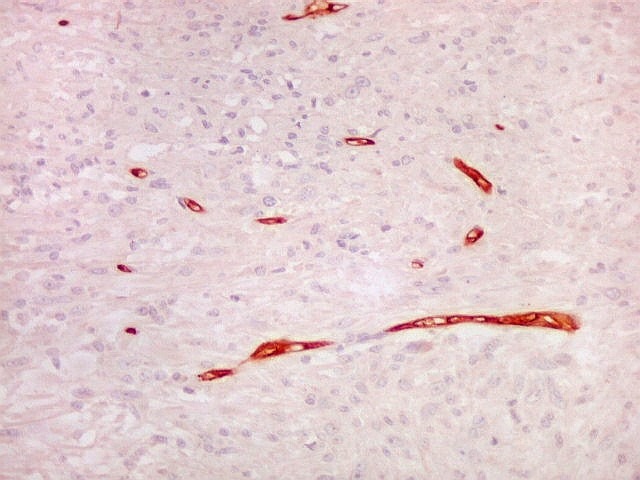
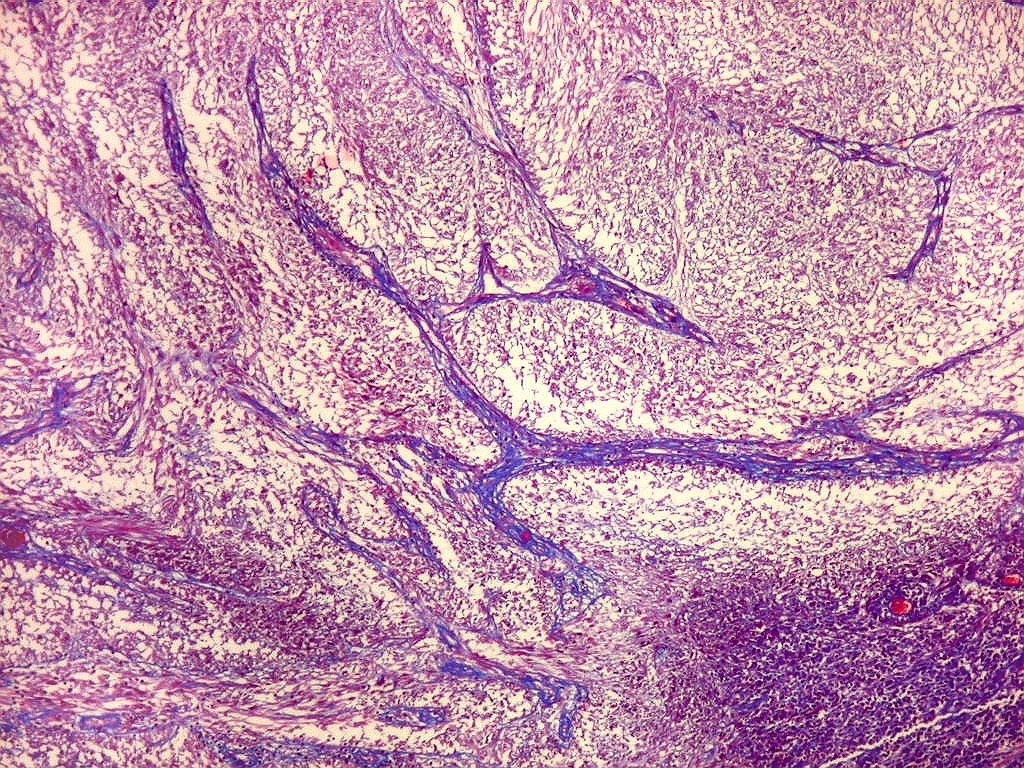
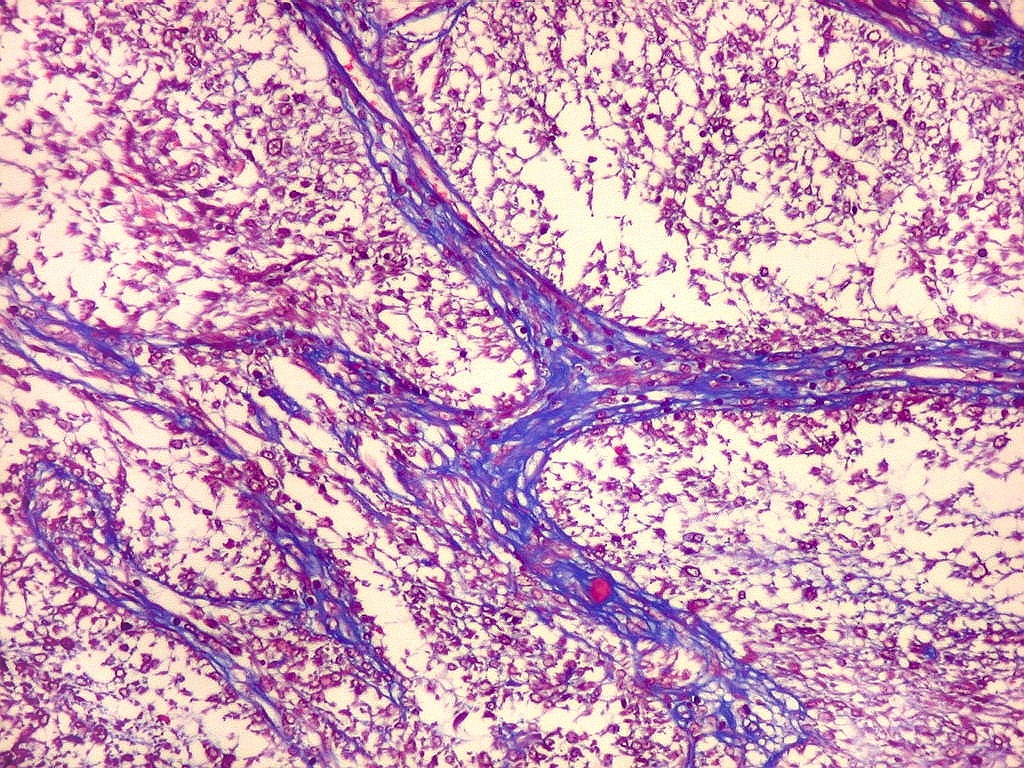
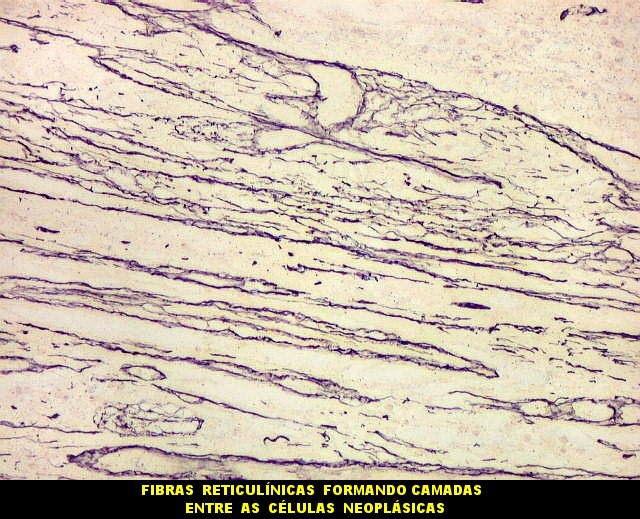
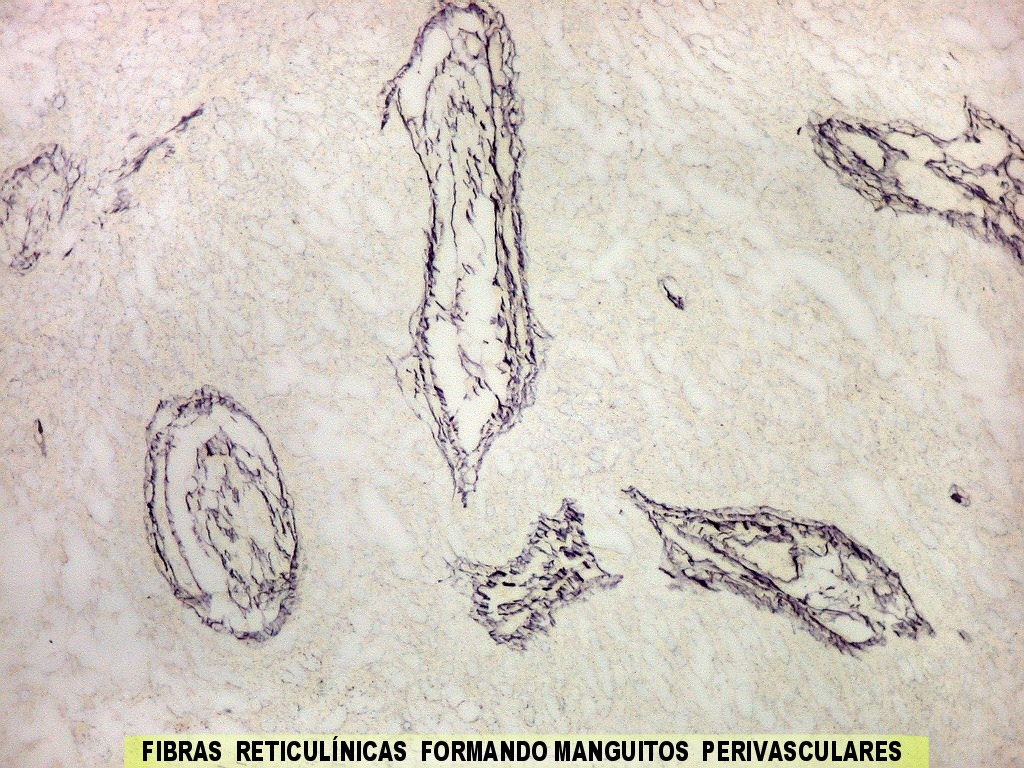
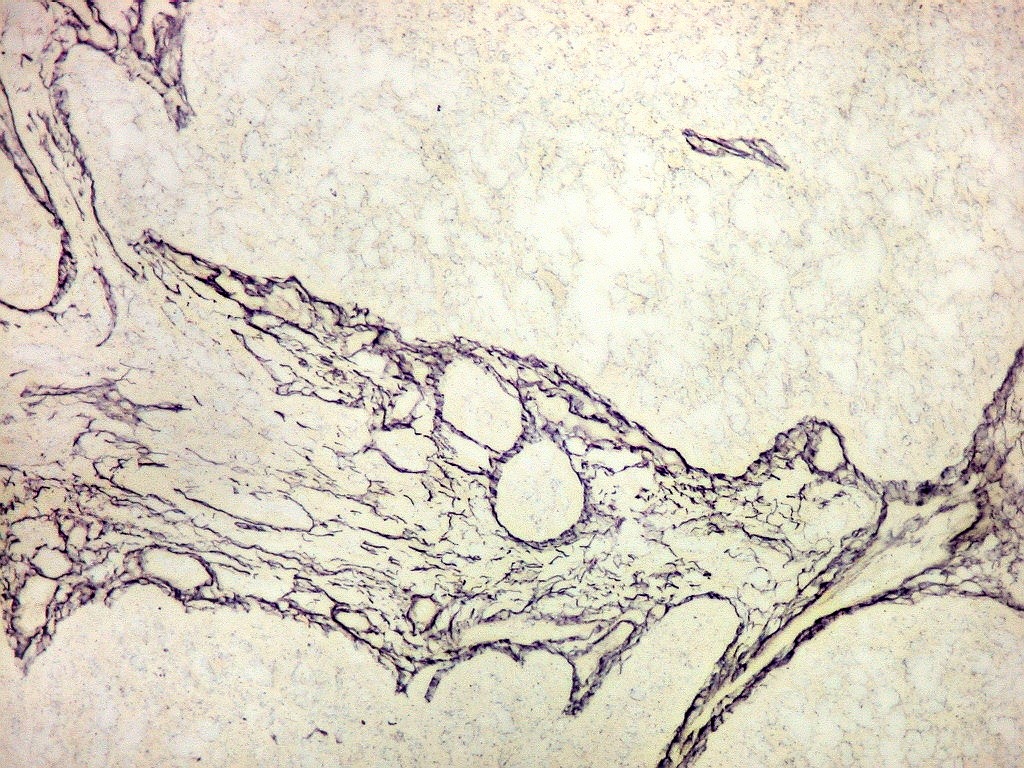
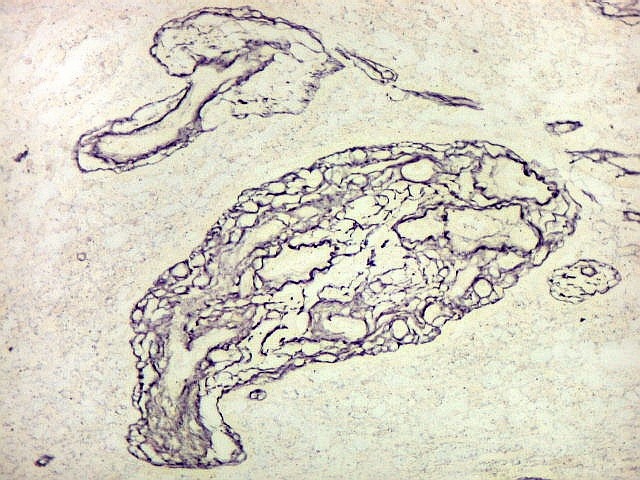
Fibras
reticulínicas.
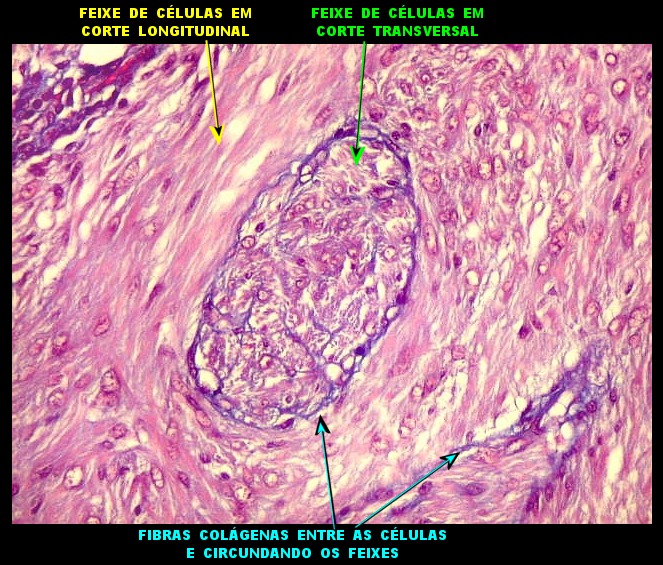
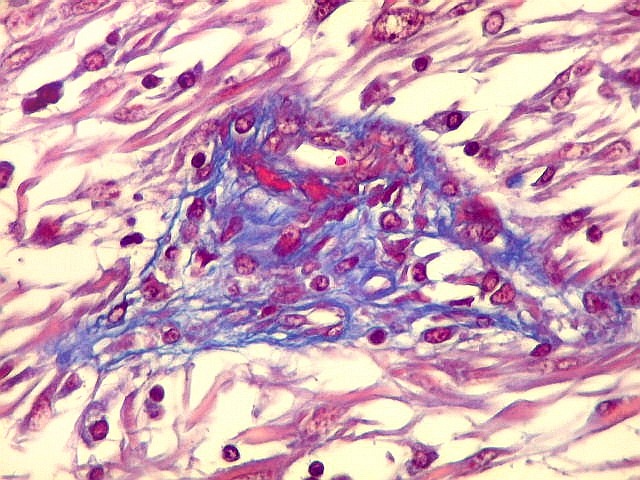
As fibras
reticulínicas são intimamente aparentadas às fibras
colágenas porque ambas consistem de fibrilas colágenas. Contudo,
as fibrilas (subunidades) nas fibras reticulínicas são de
diâmetro bem menor, da ordem de 20 nm (em comparação
com 200 nm das fibrilas constituintes das fibras colágenas).
Não formam feixes, mas estão dispersas isoladamente em uma
matriz de substância fundamental, e têm proporção
maior de grupos açúcar.
Fibras reticulínicas
não são identificáveis em cortes de parafina corados
por HE. Podem ser demonstradas na reação do PAS em função
do componente glicídico e, preferentemente, por técnicas
de impregnação argêntica, onde aparecem em preto (daí,
chamadas fibras argirofílicas). Com a mesma técnica, fibras
colágenas se coram mais claras, em marrom.
As fibras
reticulínicas correspondem ao colágeno do tipo III. São
encontradas formando um retículo entre as células de vários
órgãos, como fígado, baço, rim, pulmão,
útero, etc. Também ocorrem entre as células musculares
lisas de vasos e no endonêurio. Dão suporte estrutural e elasticidade
aos órgãos parenquimatosos.
Fibras elásticas.
Para breve texto, clique.
Fontes :
-
Ross MH, Reith
EJ, Romrell LJ: Histology. A Text and Atlas. 2nd Ed.
Williams & Wilkins, Baltimore, 1989. pp. 87-90.
-
Alberts B et
al. Molecular Biology of the Cell. 5th Ed. Garland Science, New York,
2008. pp. 1184-6.
|