|
|
|
|
|
|
|
|
| Aspecto geral. | |
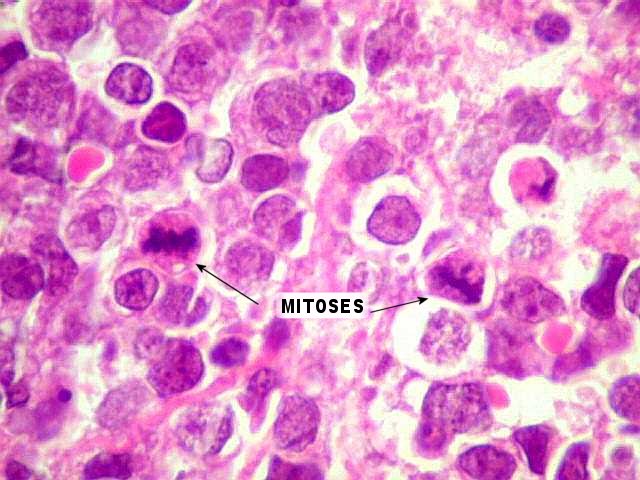
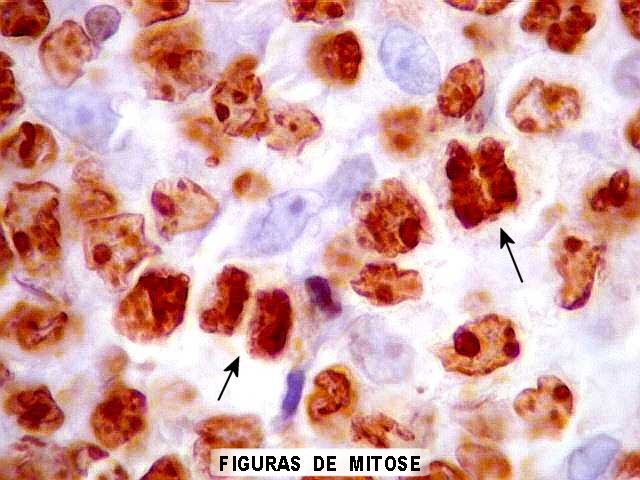
| Neoplasia de células redondas, pouco diferenciada, com alto índice mitótico, sem áreas de necrose na amostra enviada. |
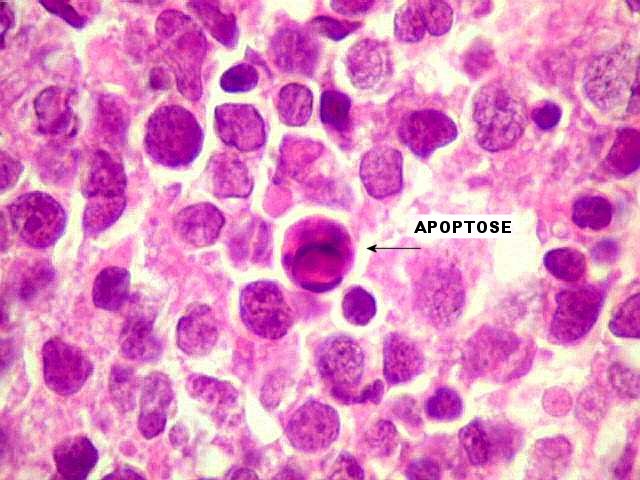
| Em aumento forte, nota-se pleomorfismo nuclear, nucléolos proeminentes, abundantes mitoses e figuras de apoptose. | |
 |
|
 |
|
|
|
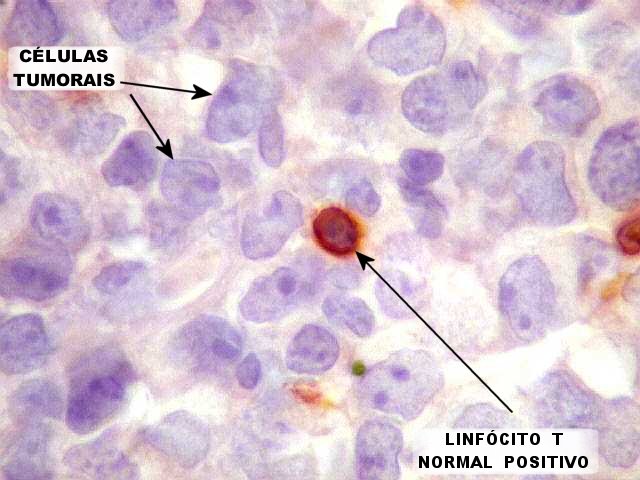
| CD20. Marcador de linhagem B, positivo difuso em padrão membrana nas células tumorais. | |
| CD3. Marcador de linhagem T, positivo em padrão membrana em pequenos linfócitos. As células neoplásicas são maiores e negativas. | |
 |
|
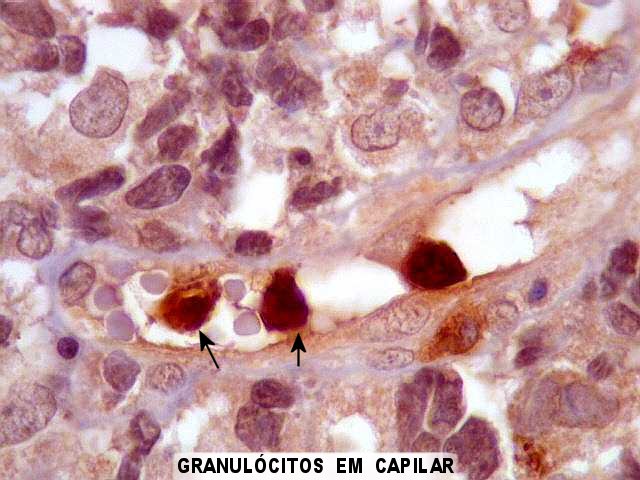
| MPX. Mieloperoxidase, marcador de linhagem granulocítica. Positivo em granulócitos presentes no tumor, inclusive intravasculares (controle interno positivo). Negativo nas células neoplásicas. Reação foi usada para afastar a possibilidade de um sarcoma granulocítico. | |
 |
|
| Kappa. Marcador de plasmócitos. Presente em raras células normais no tumor, negativo nas células neoplásicas. | |
| Lambda. Marcador de plasmócitos. Além de algumas células normais, marca parte das células neoplásicas, que são de linhagem B e podem ter, portanto, capacidade para produzir cadeias leves de imunoglobulinas. | |
| Ki-67. Positivo na quase totalidade dos núcleos de células neoplásicas, aproximando-se do padrão visto no linfoma de Burkitt. | |
 |
|
| AE1AE3. Pancitoqueratina, pedida para afastar um carcinoma indiferenciado. Negativa. | TdT. Antígeno expressado em carcinomas de pulmão e tiróide, pedido para afastar um carcinoma do tipo oat cell. Negativo. |
| Conclusão.
Linfoma
não-Hodgkin de alto grau histológico, imunofenotipo B.
Os quadros histológico e imunohistoquímico neste caso favorecem dois subtipos de linfoma, difuso de grandes células B e linfoma de Burkitt. Porém, como a morfologia é compatível com difuso de grandes células B, este fica sendo o diagnóstico final. Mesmo assim, foi pedida hibridização para virus de Epstein-Barr (EBV) (EBER, que resultou negativa). Agradecimentos ao Dr. Leandro Luiz Lopes de Freitas, médico contratado do Depto. de Anatomia Patológica da FCM-UNICAMP, especializado em Hemopatologia, e ao Prof. Dr. José Vassallo, professor titular do mesmo Departamento, por valioso auxílio na condução deste caso. |
| Linfomas
ósseos.
Linfoma não Hodgkin primário de osso é uma forma clinico-patológica microscopicamente idêntica aos linfomas nodais, mas apresenta-se como massa óssea. Subseqüentemente, pode desenvolver-se em doença generalizada. Por convenção, um intervalo de 4-6 meses é necessário entre a manifestação esquelética e aparecimento de lesões extraesqueléticas para definir-se um linfoma como primário de osso. Isto é feito na vigência de tratamento para o linfoma ósseo. Em todo caso de linfoma que se apresenta inicialmente no osso, estadiamento é indispensável para excluir doença primária extraesquelética. Incidência e localização. Linfomas primários de osso são raros, correspondendo a menos de 1% de todos os linfomas não Hodgkin. Mais de 50% ocorrem após os 40 anos. Em crianças, têm 1/10 da freqüência do sarcoma de Ewing. Os ossos mais envolvidos são fêmur e pelve (20% dos casos cada), seguindo-se úmero e vértebras (10% cada). Há predileção por ossos do tronco, como esterno, costelas e clavícula. No esqueleto apendicular há preferência pelos ossos longos tubulares como fêmur e úmero. Lesões multifocais no mesmo osso ou em ossos diferentes ocorrem em 10-40%. A localização em osso do crânio, como no presente caso, é raríssima. Clínica. O sintoma mais comum é dor e, às vezes, aumento de volume localizado. Radiologia. Os achados são inespecíficos. Tipicamente, os linfomas não Hodgkin apresentam-se como lesão lítica, de padrão permeativo ou 'comido de traça'. Freqüentemente, há ruptura da cortical óssea, com extensão aos tecidos moles. Nos ossos longos, a lesão é mais comum na diáfise. Embora a lesão seja usualmente lítica, pode haver esclerose óssea (lesão blástica). Macro. Tumor tem aspecto em carne de peixe, róseo-acinzentado. Mostra erosão da cortical óssea e extensão a tecidos moles. Áreas de esclerose com aspecto em marfim podem ocorrer. Micro. A maioria dos linfomas ósseos caem na categoria de linfoma difuso de grandes células B. Padrão nodular é muito raro em linfomas ósseos primários. Pode haver padrão esclerosante, com ninhos celulares separados por densas faixas de colágeno. É comum que o tumor permeie extensamente a medula óssea sem destruir as trabéculas ósseas. Na maioria, os linfomas têm aspecto pleomórfico, com coexistência de células pequenas, médias e grandes, o que ajuda na distinção com sarcoma de Ewing, onde predomina a uniformidade celular. As células podem ser comprimidas pelo tecido fibroso assumindo padrão fusiforme, que pode levantar diagnóstico diferencial com sarcoma. Para diagnóstico imunohistoquímico, pelo menos LCA, CD20 e CD3 devem ser pesquisados. Linfomas T e linfoma anaplásico de grandes células são raros. Monoclonalidade pode ser investigada com anticorpos anti-kappa e anti-lambda. Para afastar tumores não linfomatosos, usa-se queratina, desmina, actina de músculo liso e MIC2 (para sarcoma de Ewing). Prognóstico. O prognóstico dos linfomas ósseos tem muito mais a ver com o estadiamento do que com o grau ou tipo histológico da doença. Pacientes com doença monostótica sem envolvimento de tecidos moles têm sobrevida de 5 e 10 anos de 58 e 53,5%, comparados com 22 e 12% se a doença já atingiu tecidos moles. 1. Após diagnóstico de linfoma no osso, não se encontra doença em outros locais pelo estadiamento. Se isto se mantém após 6 meses, pode-se confirmar o linfoma como primário de osso. O prognóstico pode ser excelente. 2. Estadiamento revela envolvimento de outros sítios esqueléticos, mas ausência de lesões em linfonodos, fígado ou baço. Prognóstico também muito bom. 3. Após diagnóstico de linfoma no osso, estadiamento revela envolvimento de linfonodos ou órgãos extraesqueléticos. Prognóstico não tão bom. 4. Paciente com linfoma generalizado já diagnosticado passa a apresentar lesões ósseas. Prognóstico reservado. Refs. Dorfman HD, Czerniak B. Bone Tumors. Mosby, St. Louis, 1998. p.679. Inwards
CY, Unni KK: Bone tumors. in Mills SE et al (eds): Sternberg’s
Diagnostic Surgical Pathology. 4th Ed. Lippincott, Williams & Wilkins,
2004. pp 270-2.
Para doença
de Hodgkin com envolvimento ósseo, clique.
|
| Caso do Serviço de Neurocirurgia da Santa Casa de Limeira, SP (Chefe Prof. Dr. Antonio Augusto Roth-Vargas), gentilmente contribuído pelos Drs. Paulo Roland Kaleff, Marcelo Senna Xavier de Lima e Hoyama da Costa Pereira. |
| Para TC deste caso, clique » |
 |
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|