|
|
2. Imunohistoquímica. |
|
|
|
2. Imunohistoquímica. |
|
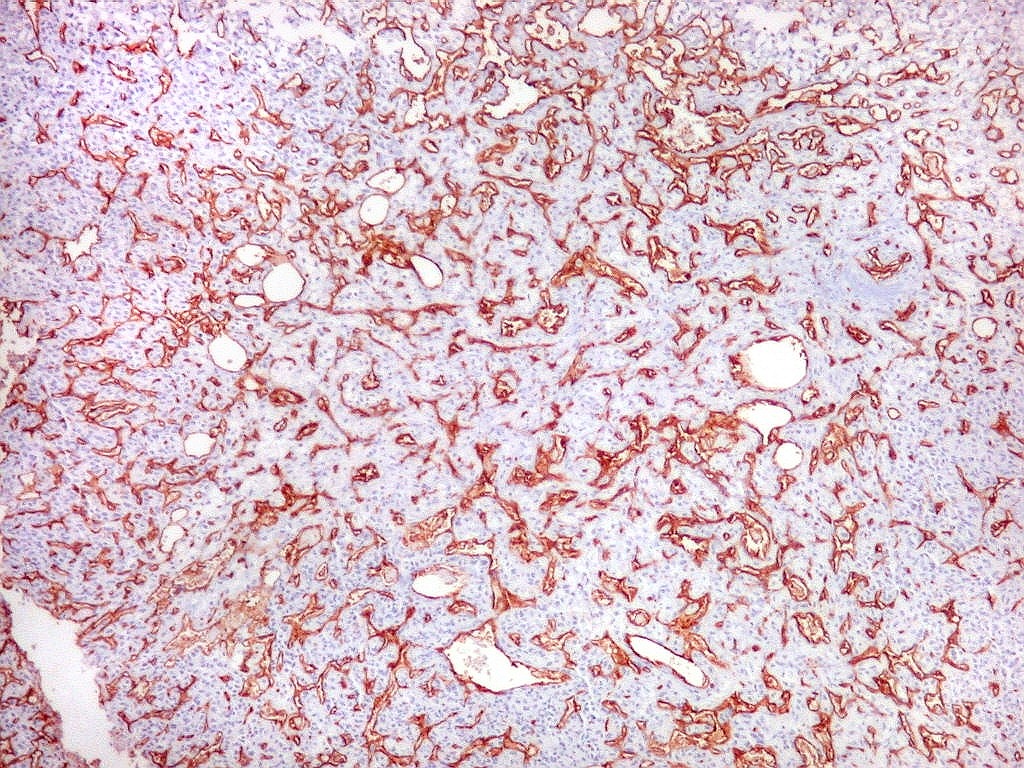
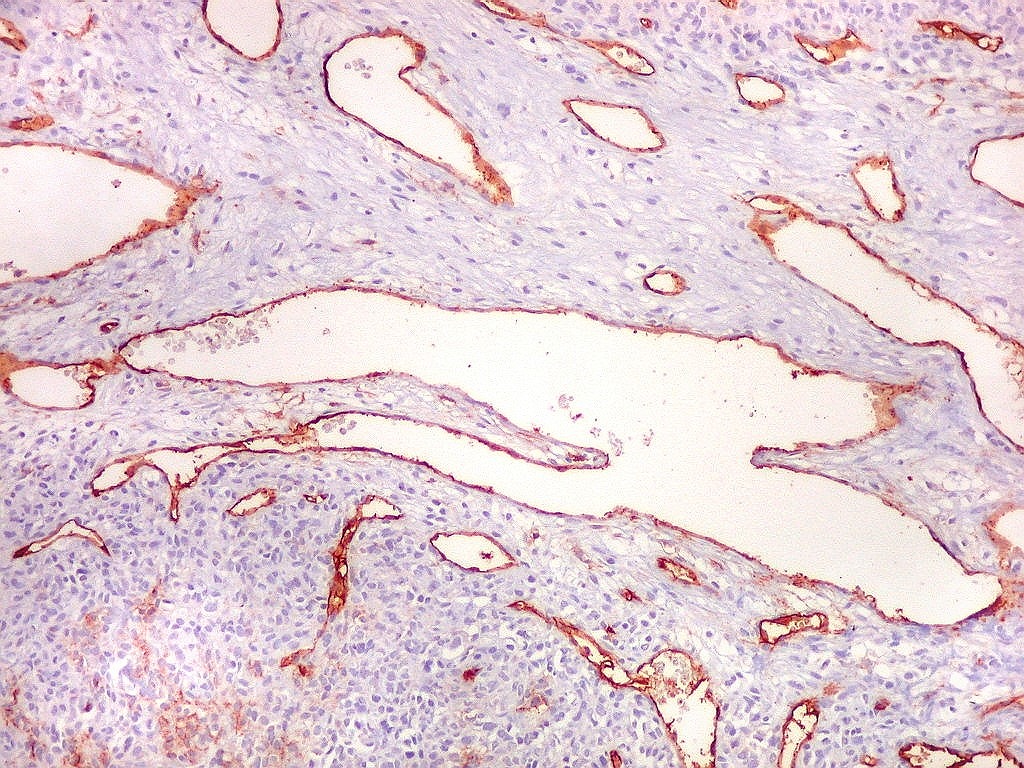
| CD34.
A extraordinária vascularização do tumor é demonstrada com máxima vantagem pela reação imunohistoquímica para CD34, que marca a face luminal das células endoteliais. Uma profusa rede de pequenos capilares, não raro de luzes comprimidas, como fendas, permeia extensas áreas da neoplasia. |
 |
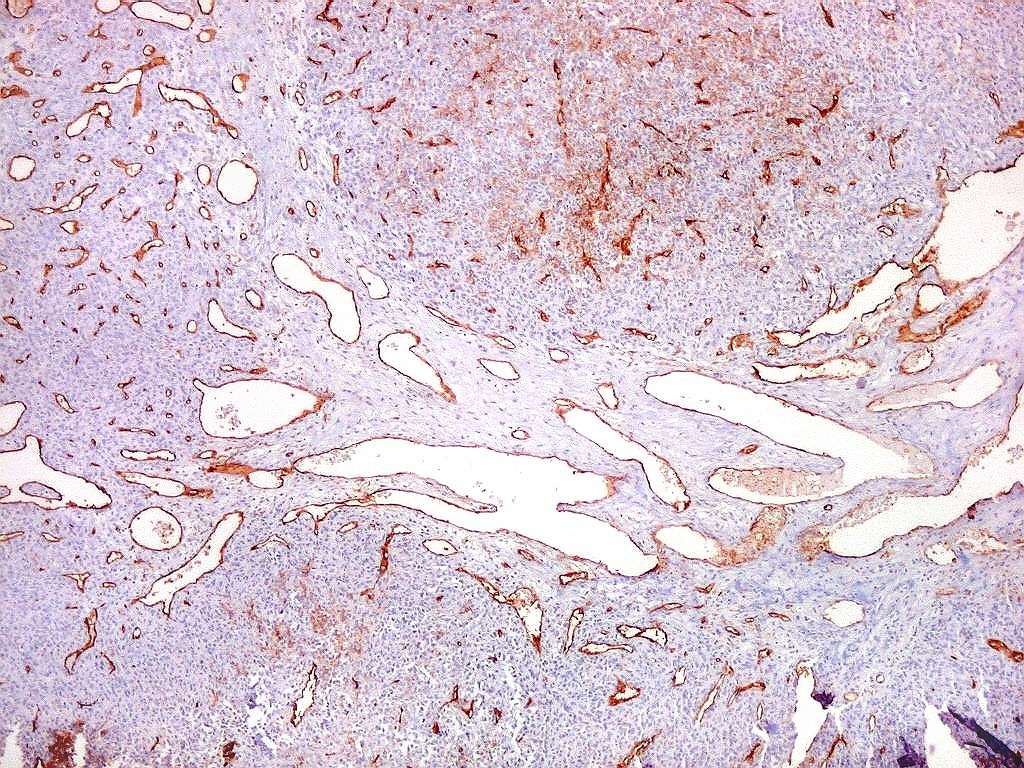
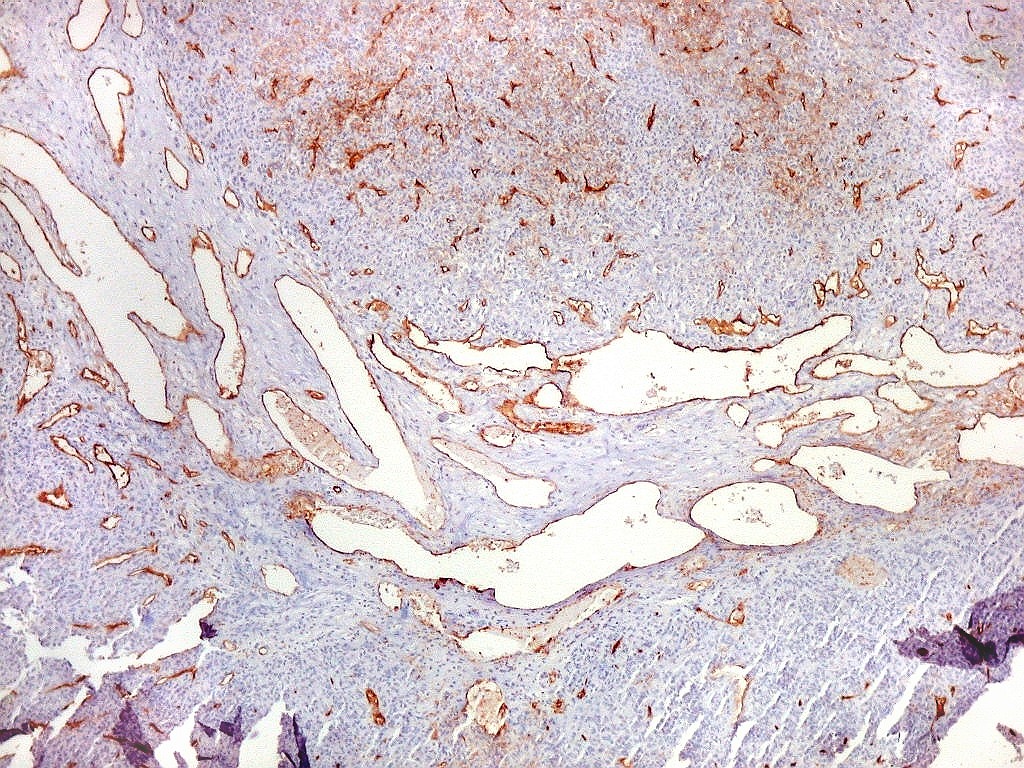
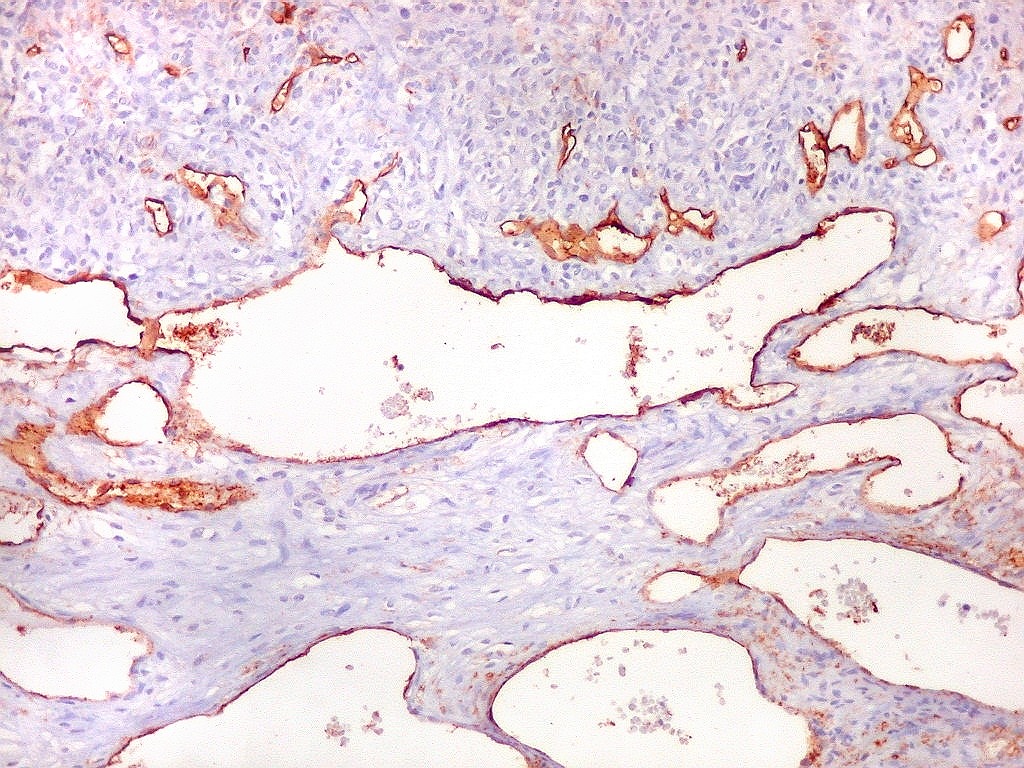
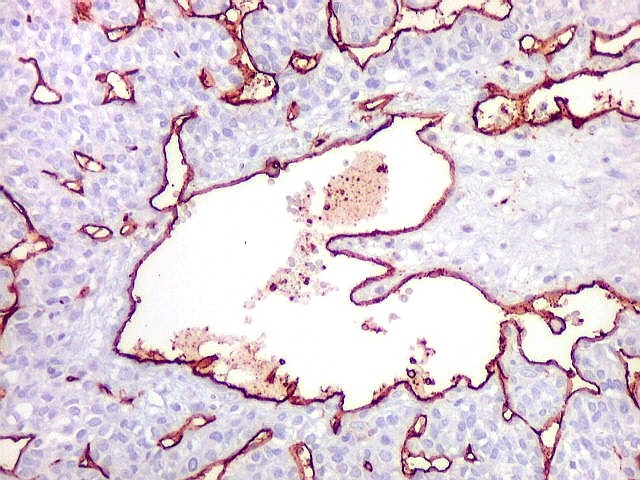
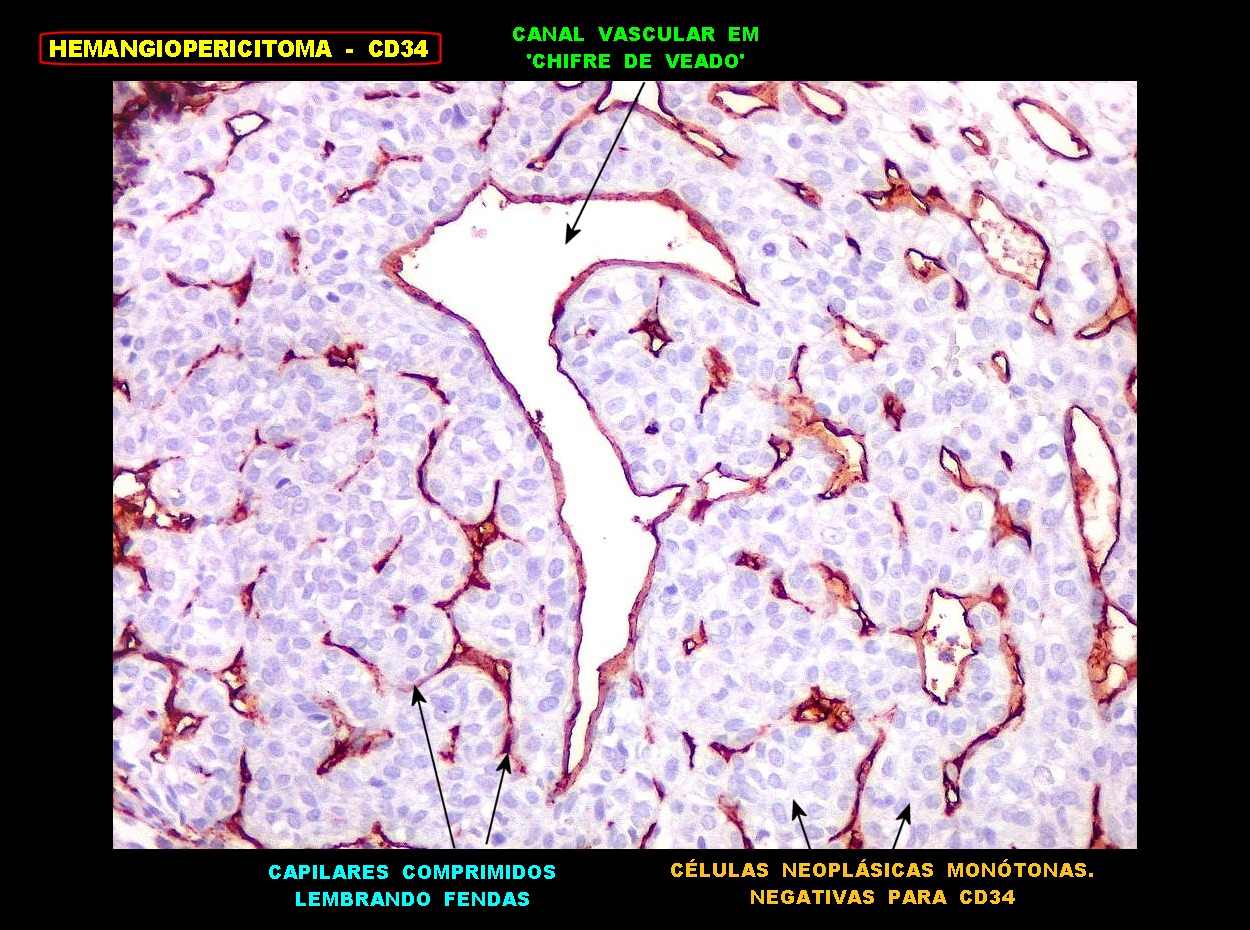
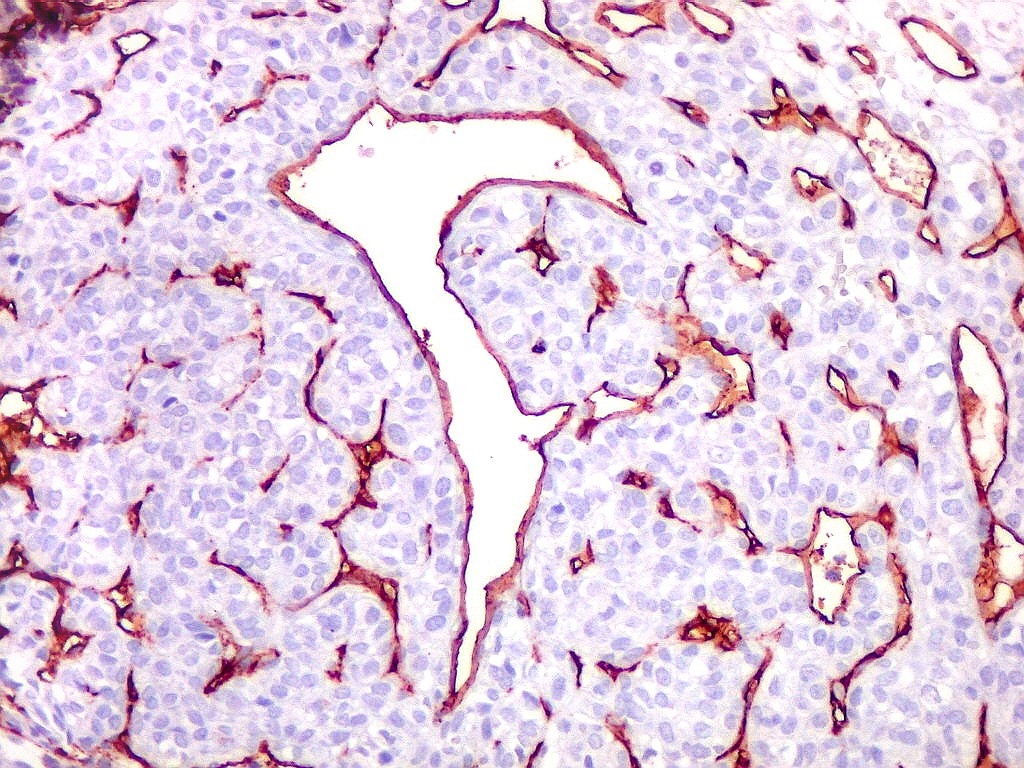
| Vasos
de variados calibres.
Observam-se, além das áreas compactas com capilares finos, áreas mais frouxas com grandes sinusóides ou canais vasculares dilatados, com contornos e ramificações irregulares, que ensejam a clássica comparação com chifres de rena (staghorn pattern). |
 |
 |
 |
 |
 |
 |
 |
 |
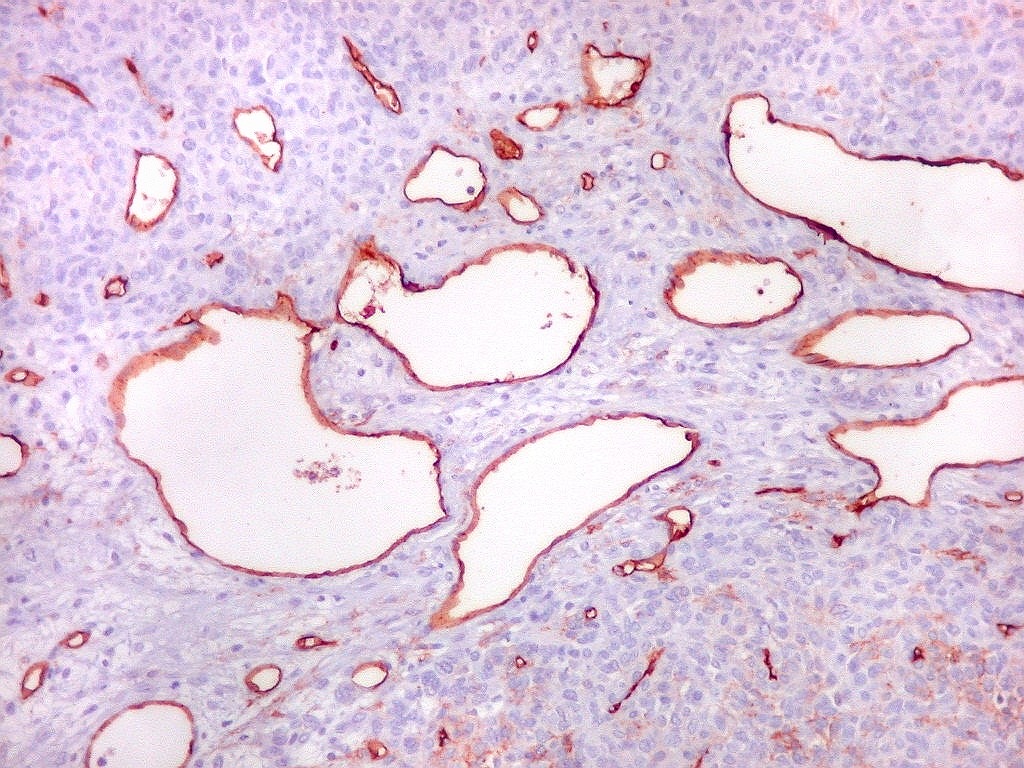
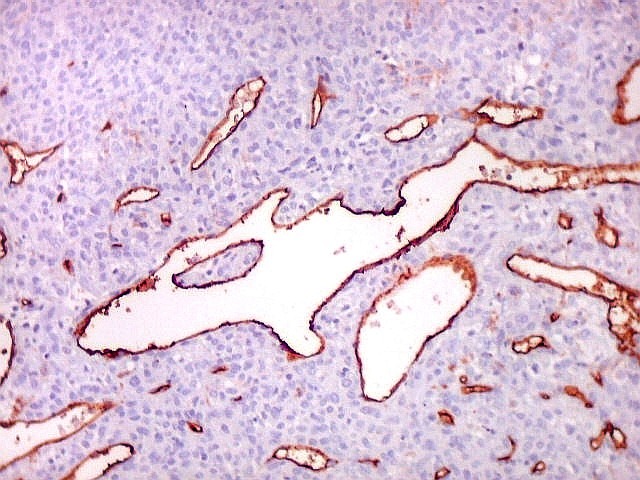
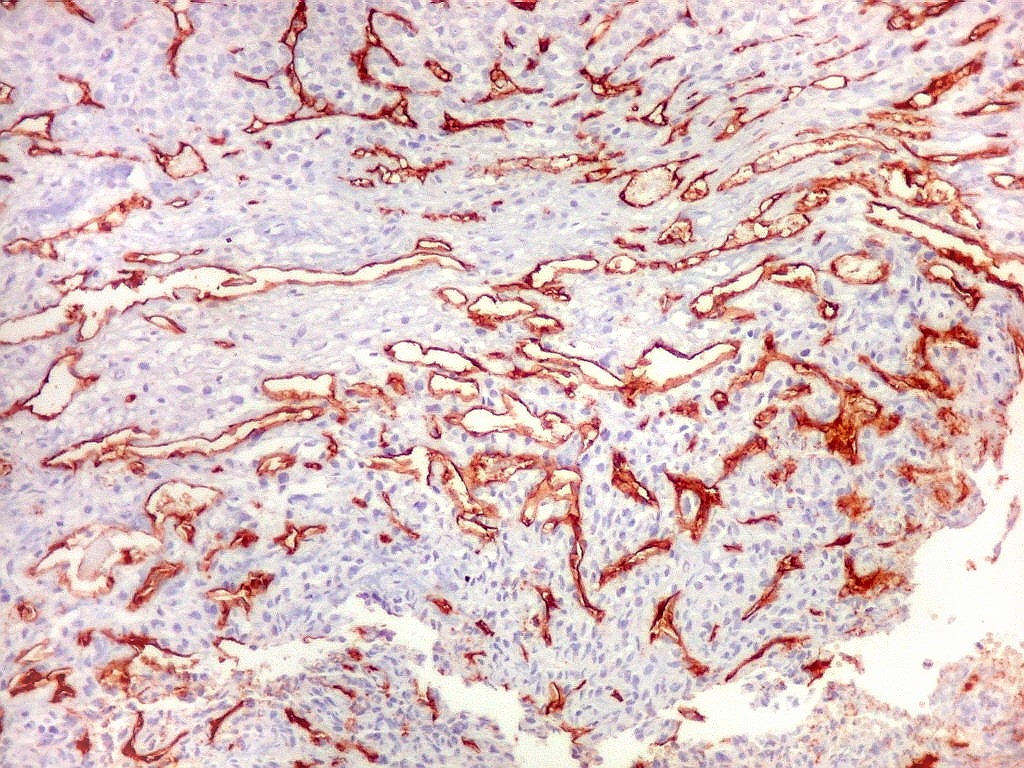
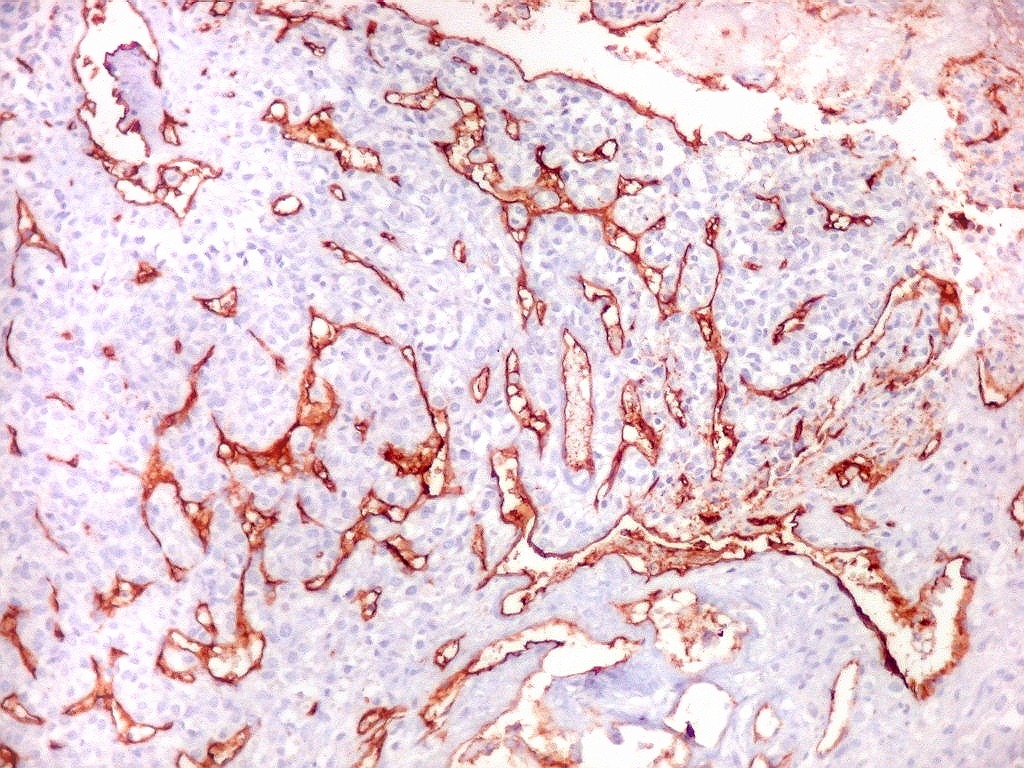
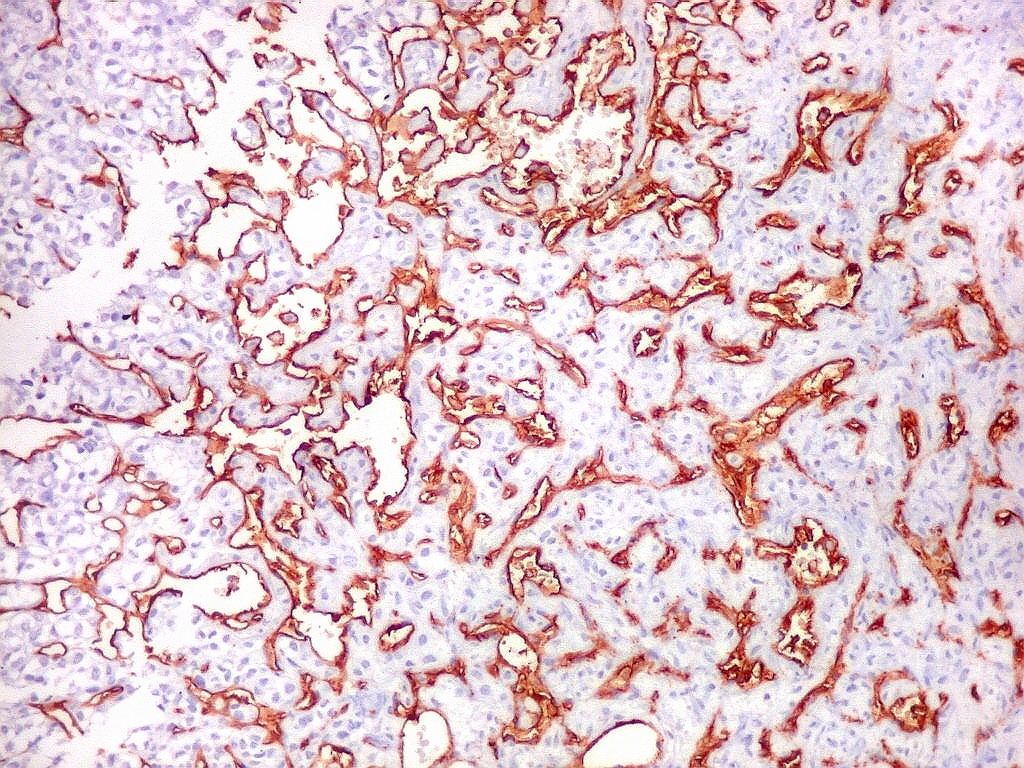
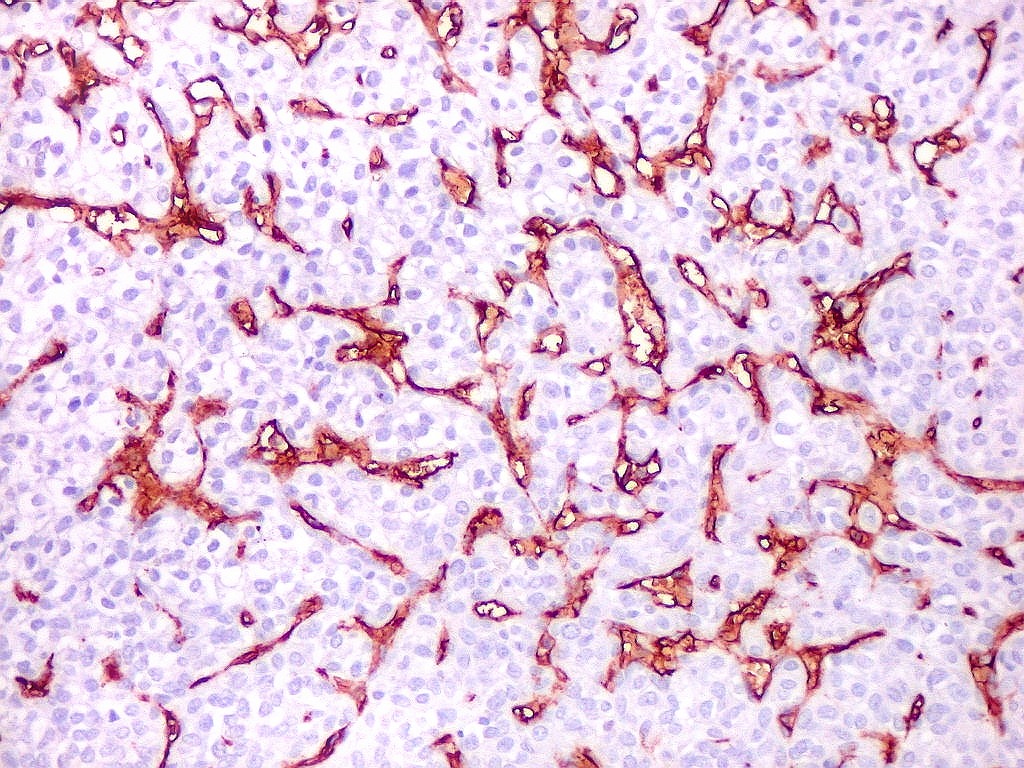
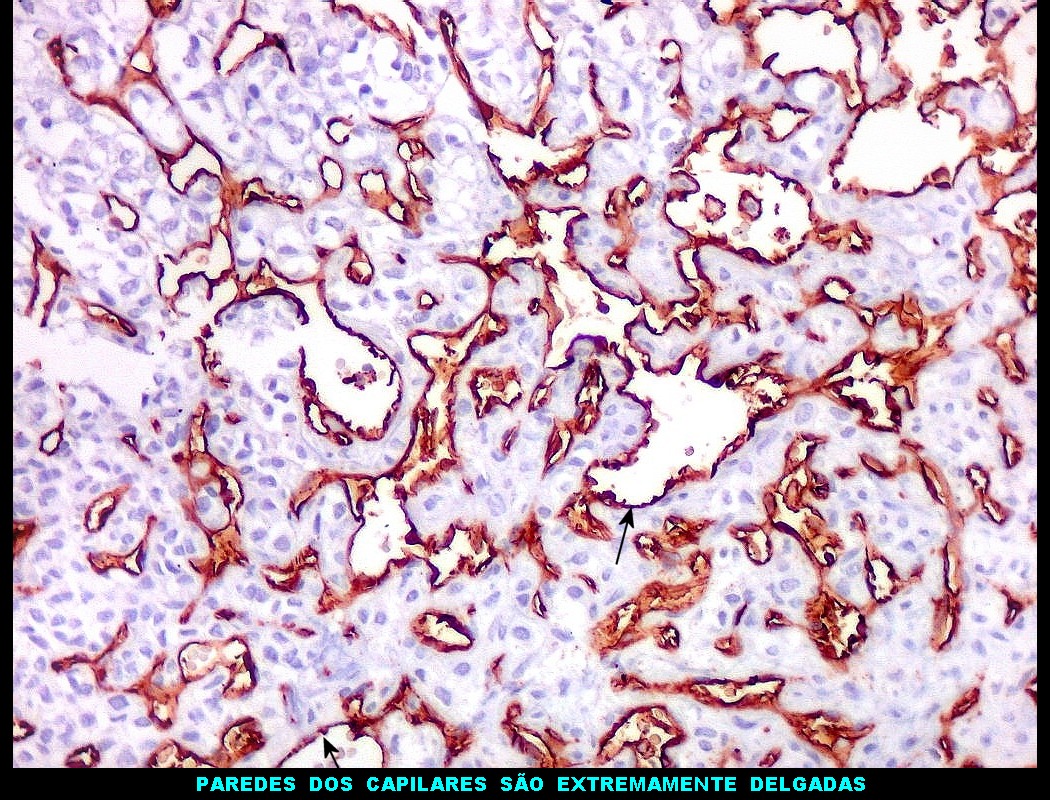
| Rede
de finos capilares.
Na maior parte do tumor predominam finos canais vasculares com paredes extremamente delgadas, luz irregular, geralmente fina ou quase virtual, aparentemente comprimidos pelas células neoplásicas. |
 |
 |
 |
 |
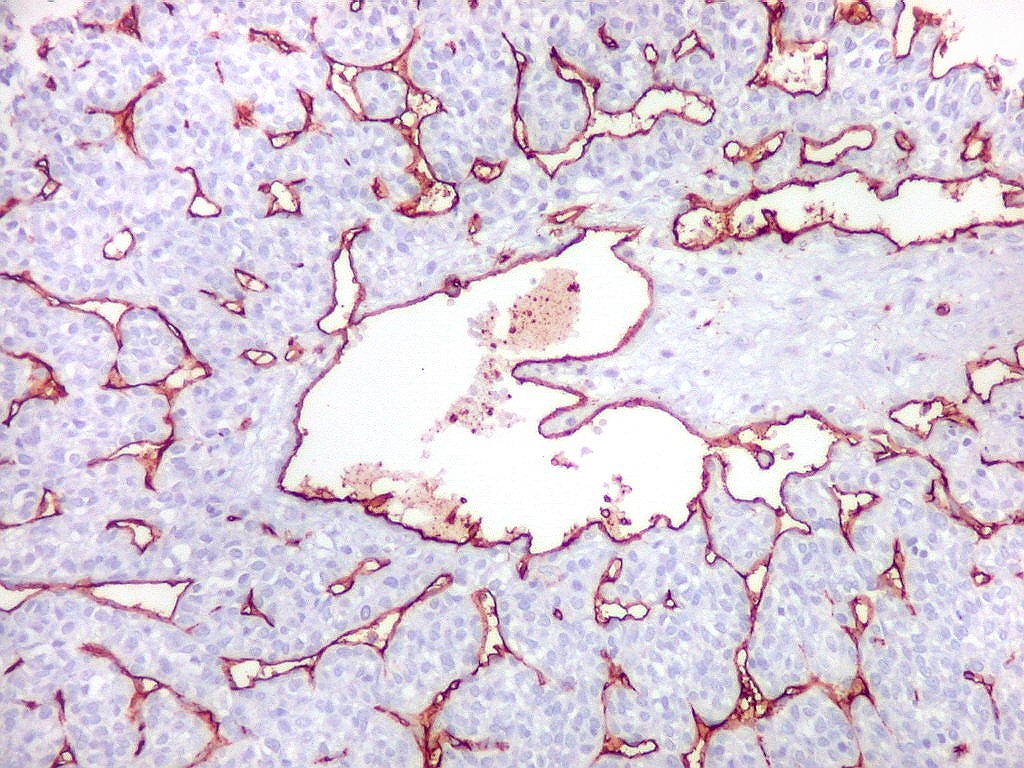
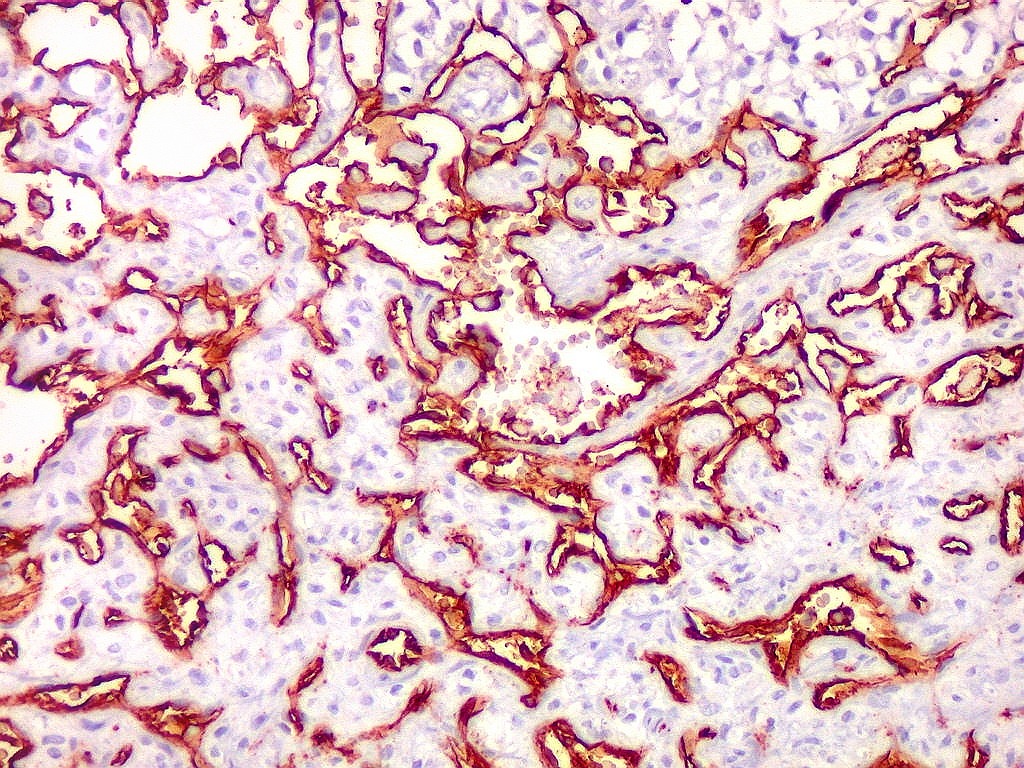
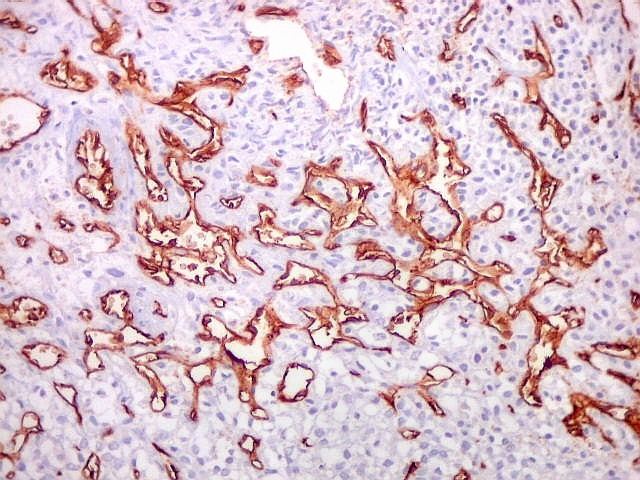
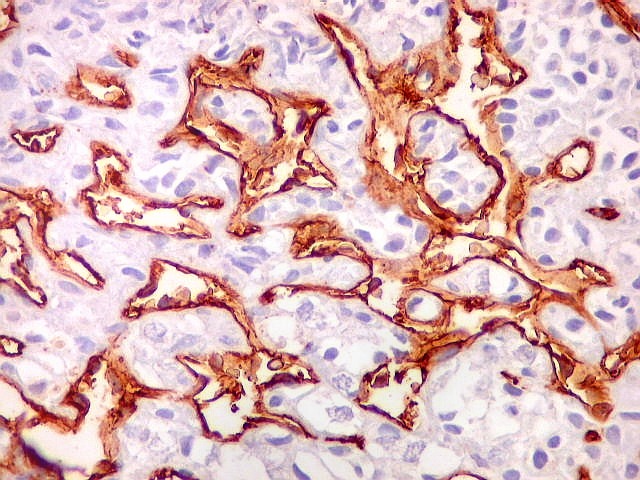
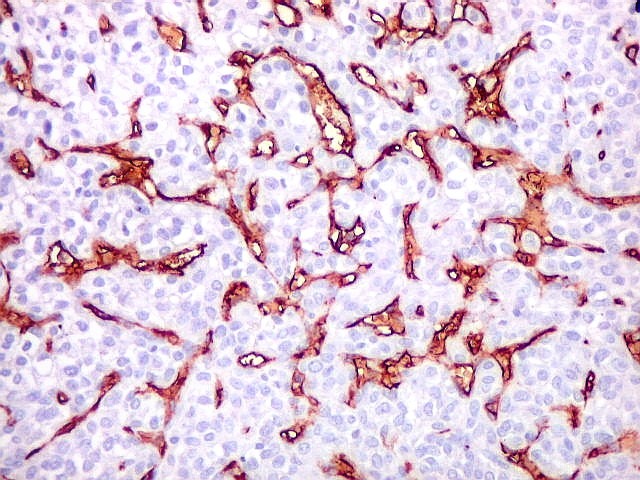
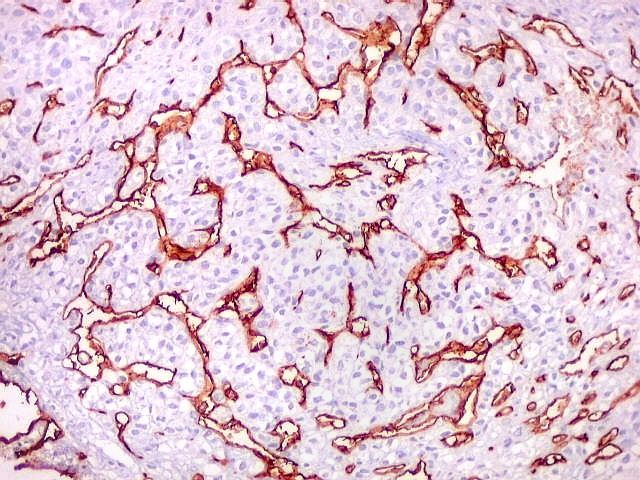
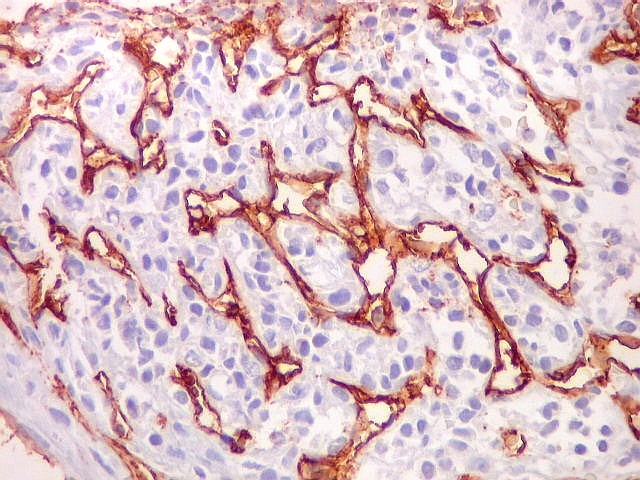
| Células
tumorais são negativas para CD34.
As células deste hemangiopericitoma são negativas para CD34. Células do tumor fibroso solitário são praticamente sempre positivas. Ver exemplos (1) (2) (3). |
 |
 |
 |
 |
|
 |
 |
 |
|
 |
 |
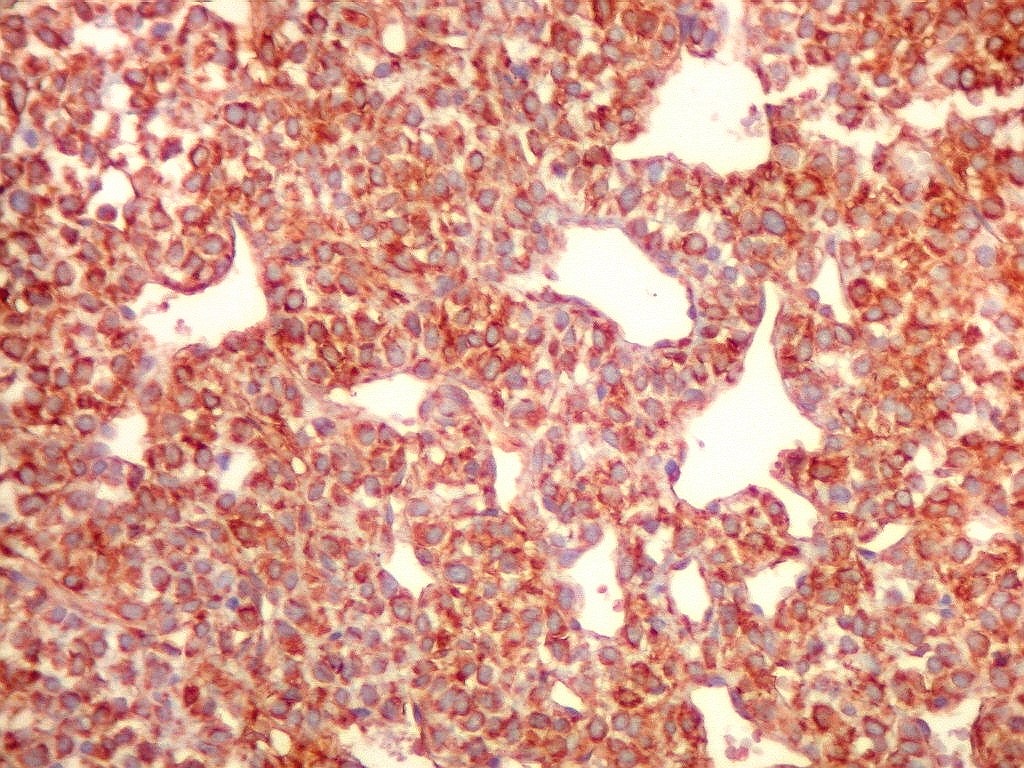
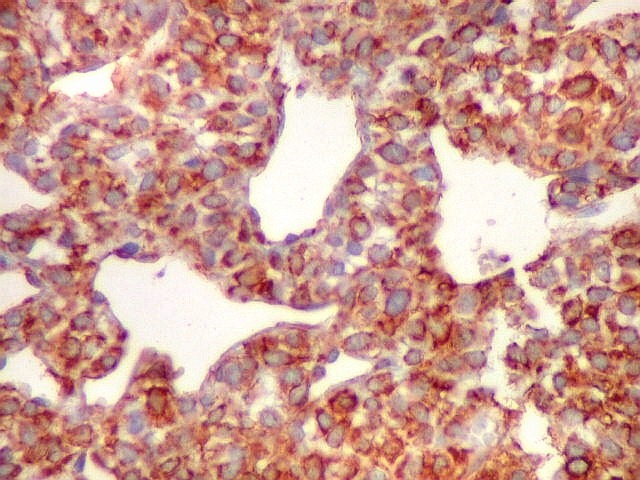
| VIM.
Vimentina, um filamento intermediário do citoesqueleto, de distribuição ubiquitária, especialmente em células de origem mesenquimal, é difusamente positiva no citoplasma das células deste hemangiopericitoma. |
 |
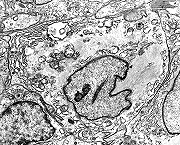
| Para filamentos intermediários deste caso em microscopia eletrônica, clique. | |
 |
|
| CD99.
Positividade difusa em padrão membrana é descrita em hemangiopericitomas e tumores difusos solitários, entre outros. Para exemplos de CD99 em tumores difusos solitários, clique (1) (2) (3). Lembrar que CD99 também é o antígeno de escolha para diagnóstico do tumores neuroectodérmicos primitivos periféricos (pPNET) / sarcoma de Ewing, que não têm relação com os dois tipos anteriores. Para exemplos de CD99 em pPNETs, clique (1) (2) (3). |
| BCL-2. Positividade em padrão citoplasmático. | |
|
|
| EMA. Negativo em toda a amostra (negatividade para EMA ajuda a diferenciar de meningiomas, habitualmente positivos). | |
| Ki-67.
Positivo em algo em torno de 10% dos núcleos (estimativa visual grosseira, sem contagem), sugere tumor de moderada capacidade de proliferação e aconselha acompanhamento cuidadoso para detectar recidiva precoce. |
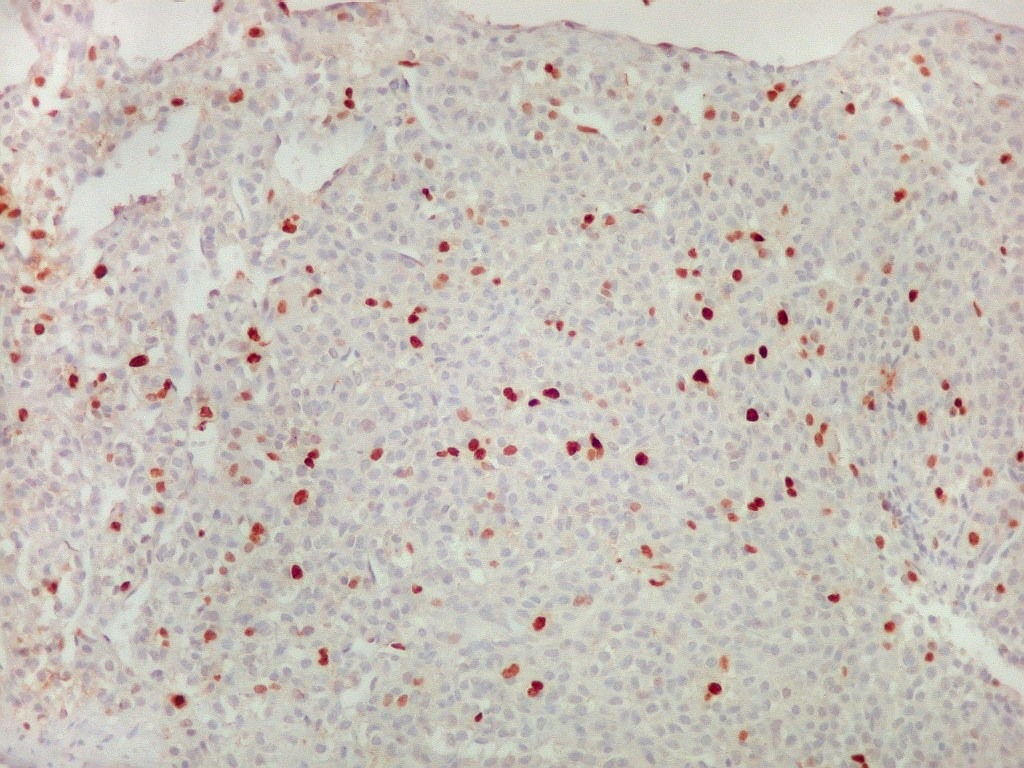 |
| Ki-67
marca
também mitoses.
Em células em mitose, o citoplasma também é positivo. |
| p53. Alta proporção de núcleos positivos indica acúmulo da proteína p53, sugerindo que mutação no gene desta proteína pode ter tido papel na gênese ou manutenção deste tumor. | |
| Hemangiopericitoma
Definição. Tumor mesenquimal altamente celular e vascularizado, com aparência monótona em aumento fraco, e vasos bem desenvolvidos, freqüentemente com aspecto ‘em chifre de veado’ (staghorn em inglês). Está quase sempre aderido à dura-máter e tem tendência a recidivar e dar metástases fora do sistema nervoso central. Corresponde histologicamente ao grau II da OMS. Hemangiopericitomas anaplásicos são considerados grau III. Histórico e sinonímia. Hemangiopericitoma foi individualizado em 1942 como tumor de tecidos moles por Stout e Murray, que também postularam sua origem em pericitos. Em 1938 Cushing e Eisenhardt descreveram três variedades de ‘meningiomas angioblásticos’, termo atualmente não mais aceito. Retrospectivamente, a variedade 1 correspondia aos hemangiopericitomas, mas hoje está estabelecido que meningiomas e hemangiopericitomas são entidades diferentes. Também são distintos dos tumores fibrosos solitários, mas há sugestões de um espectro entre ambos. Incidência. Hemangiopericitomas de meninge correspondem a cerca de 0,4% dos tumores primários do sistema nervoso central. A proporção entre hemangiopericitomas e meningiomas foi de 1:50 em média em três séries. Hemangiopericitomas tendem a ocorrer em idade mais jovem que os meningiomas (a idade média ao diagnóstico foi 43 anos), com discreto predomínio masculino (66 homens para 47 mulheres ou 1,4:1 nas 3 séries), ao contrário dos meningiomas, que predominam em mulheres. Localização. Hemangiopericitomas são quase sempre solitários e aderidos à dura-máter craniana ou espinal. Em 4 grandes séries totalizando 153 casos, 8% eram espinais. Clínica. Os sinais e sintomas são superponíveis aos dos meningiomas. Quando adjacentes ao osso tendem a dar lesões líticas, ao contrário dos meningiomas, que podem causar hiperostose. Estudos angiográficos mostram hipervascularidade, que explica a tendência a sangramentos. O tumor tipicamente tem suprimento vascular duplo, a partir de vasos meníngeos e corticais. Exames de imagem mostram tumor bem delimitado, aderido à dura, com superfície lisa ou nodular e forte impregnação por contraste. Pode haver flow voids em RM (grandes vasos com alto fluxo). Ao contrário dos meningiomas, hemangiopericitomas tipicamente não apresentam calcificações. Macro. Na cirurgia são notáveis pela tendência a sangramento. Micro.
São tumores monomorfos, compostos de células densamente
arranjadas e orientadas ao acaso, em padrão estoriforme, com escasso
tecido conjuntivo intersticial. O citoplasma é escasso e os limites
celulares são imprecisos. Os núcleos são arredondados
a ovalados, com cromatina densa e nucléolos pouco evidentes. As
pseudoinclusões características dos meningiomas estão
ausentes. Há variação no grau de atipias nucleares
e mitoses. Os hemangiopericitomas anaplásicos (OMS grau III) mostram
pelo menos 5 mitoses por 10 campos de grande aumento e/ou necrose, mais
dois ou mais dos seguintes: hemorragia, e atipias nucleares e celularidade
em grau moderado a alto. Há uma rica rede de fibras reticulínicas,
tipicamente envolvendo células individualmente. O tumor é
altamente vascularizado, com numerosos canais vasculares em forma de fenda
forrados por células endoteliais achatadas. Há freqüentes
espaços vasculares (sinusóides) alargados, ramificados, de
paredes finas, cujo contorno em corte lembra chifres de rena (staghorn
pattern).
Imunohistoquímica. As células tumorais são difusamente positivas para vimentina, fator XIIIa (células esparsas em 80-100%), CD57 (Leu-7) (70%) e para CD34 em 33 a 100 % dos casos, geralmente em padrão focal, ao contrário da positividade difusa característica dos tumores fibrosos solitários. Pode haver positividade focal para desmina, actina de músculo liso e citoqueratinas. Contudo, apesar do conceito de que pericitos são células musculares lisas modificadas, positividade para marcadores musculares é baixa e não ajuda no diagnóstico. Pode haver marcação focal e fraca para EMA (diagnóstico diferencial com meningiomas). São negativas para proteína S-100, CD31 (um antígeno clássico de células endoteliais) e receptor de progesterona (encontrado na maioria dos meningiomas). Embora não haja nenhum anticorpo totalmente sensível ou específico, o painel imunohistoquímico acima geralmente permite a distinção contra meningiomas ou tumor fibroso solitário. Microscopia eletrônica. As células são alongadas, densamente arranjadas e apostas umas às outras com mínimo espaço intersticial. Podem conter feixes intracitoplasmáticos de filamentos intermediários. No interstício encontram-se septos de material eletrodenso semelhante a membrana basal, que equivale à rede de fibras reticulínicas demonstradas com impregnação argêntica. Não se observam desmossomos ou gap junctions. Histogênese. A origem do tumor permanece incerta. O grupo de trabalho para a classificação de tumores ósseos e de tecidos moles da OMS é da opinião que a maioria dos assim chamados hemangiopericitomas não têm diferenciação pericítica, sendo de natureza fibroblástica. Morfologicamente, formam um contínuo com os tumores fibrosos solitários. Estudos genéticos não demonstraram monossomia do cromossomo 22 nem anormalidades do gene NF2, que são encontradas em alta proporção de meningiomas. Prognóstico. O tumor geralmente recidiva após intervalos de 40 a 70 meses em diferentes séries, sugerindo que o crescimento é mais rápido que o dos meningiomas. Ki-67 de 10 % (0,6-36%) foi relatado numa série de 31 casos e 5% (1,2 a 39%) noutra de 62 casos. Estes valores assemelham-se aos dos meningiomas anaplásicos (OMS grau III). Mesmo em tumores que tiveram remoção macroscopicamente completa, a recidiva local é praticamente inevitável, tendo ocorrido em 91% e 85% de duas séries no intervalo de 15 anos. Em uma série, 9 de 17 hemangiopericitomas irradiados recidivaram com intervalo mediano de 58 meses. Dos não irradiados, 13/15 recidivaram com intervalo mediano de 29 meses. Em um estudo, a sobrevida aos 5, 10 e 15 anos foi 67%, 40% e 23%. A maioria dos hemangiopericitomas de meninge dão metástases a ossos, fígado e pulmão. A sobrevida mediana após o diagnóstico foi 2 anos. A probabilidade de que a morte seja relacionada ao tumor original foi 61% aos 15 anos. Tumores de alto grau recidivaram 6,7 anos mais cedo que os de baixo grau. Apesar da recidiva mais precoce, o grau do tumor não teve influência sobre a sobrevida. Os melhores fatores prognósticos ainda são excisão macroscopicamente completa e radioterapia pós-cirúrgica. Fontes:
|
| Caso do Serviço de Neurocirurgia do Hospital e Maternidade Madre Theodora, gentilmente contribuído pelo Dr. Donizeti César Honorato, Campinas, SP. |
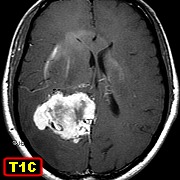
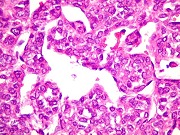
| Para mais imagens deste caso e texto: | RM | Macro, HE, colorações | ME |
 |
 |
 |
| Neuropatologia
- Graduação |
Neuropatologia -
Casos Complementares |
Neuroimagem
- Graduação |
Neuroimagem -
Casos Complementares |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Patologia - outros aparelhos | Pages in English |
|
|
|
|