|
|
|
|
|
|
|
|
| Destaques da imunohistoquímica. Para destaques da HE e colorações especiais, clique. | ||
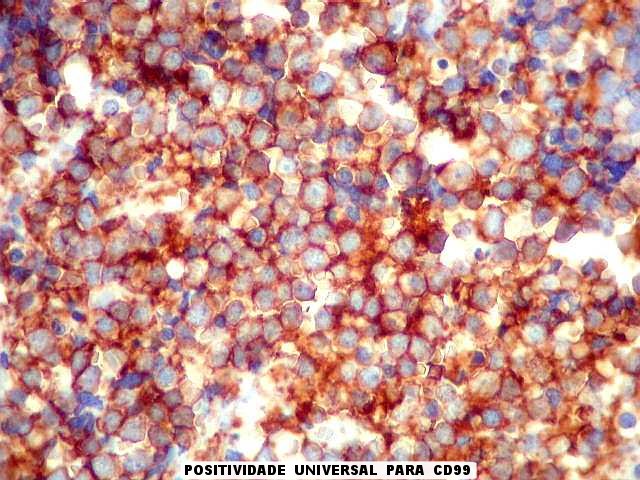
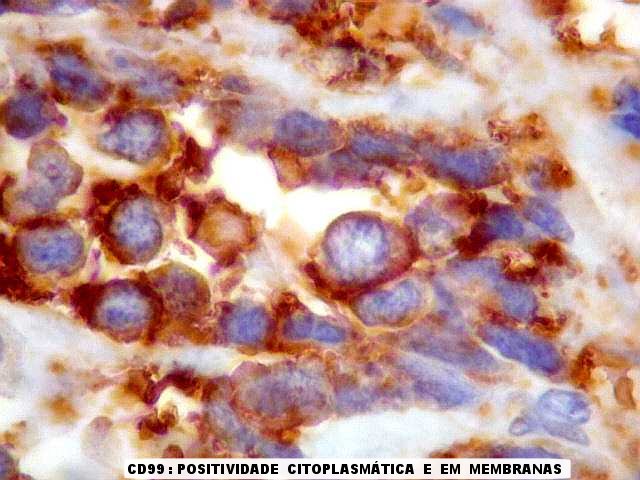
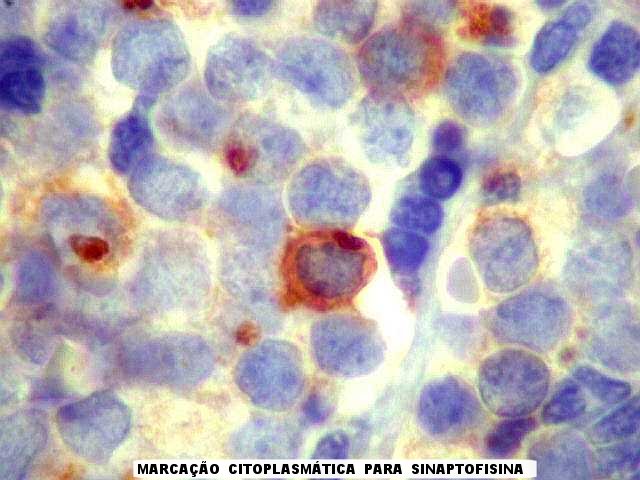
| CD99. Positividade forte e universal, citoplasmática e em membranas | CD56. Positivo focal em membranas | SNF. Positividade citoplasmática em células isoladas |
| VIM. Positividade citoplasmática em células isoladas | S-100. Positivo em raízes, negativo no tumor | CD34. Positivo em endotélio e células conjuntivas proliferadas, negativo no tumor |
| 1A4. Positivo em vasos, negativo no tumor | 1A4. Positivo em ligamentos infiltrados (miofibroblastos?) | Ki-67. Marcação de cerca de 20% dos núcleos. |
|
|
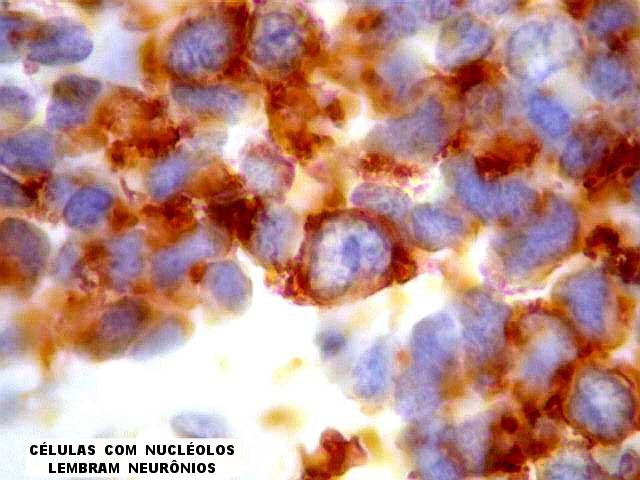
| CD99. Esta glicoproteína de membrana é positiva na virtual totalidade dos tumores da linhagem Ewing/PNET, em padrão membrana. Contudo, é inespecífica, podendo ocorrer em outros tumores, como linfoma linfoblástico, que precisam ser pesquisados por marcadores hematológicos (abaixo). Sendo estes negativos (como foram, no presente caso), impõe-se o diagnóstico de tumor neuroectodérmico primitivo ou sarcoma de Ewing, que são considerados polos de uma só entidade. Quando há evidência de diferenciação neural, por positividade para marcadores neurais, faz-se o diagnóstico de tumor neuroectodérmico primitivo (PNET, segundo a sigla em inglês, primitive neuroectodermal tumor). Quando não se consegue demonstrar marcadores neurais, o tumor é considerado um sarcoma de Ewing extraesquelético. | |
 |
 |
 |
|
| CD56
ou NCAM. Neural cell adhesion molecule é
uma proteína de membrana com papel na coesividade de células
do SNC e SNP. Também é distribuída em células
neuroendócrinas ou neuroectodérmicas e seus tumores.
É um marcador sensível de linhagem endócrina em carcinomas
de pequenas células do pulmão e de sítios extrapulmonares.
Não é específica para diferenciação
neuroendócrina, pois uma minoria (até 25%) de carcinomas
do ovário, carcinomas de células renais, tumores pulmonares
não endócrinos e carcinomas de endométrio são
positivos. CD56 também é um importante marcador de
células NK e de linfomas T/NK.
No presente caso houve positividade para CD56 em grande parte das células tumorais em padrão membrana. |
|
| SNF. Sinaptofisina, uma proteína associada a vesículas sinápticas, é um importante marcador de diferenciação neuronal. Aqui, encontramos várias células neoplásicas com positividade citoplasmática nítida, e aparentemente com uma quantidade de citoplasma maior que a maioria das células tumorais. Tomamos estas células como evidência da linhagem neural do tumor. | |
 |
|
| VIM. Vimentina é positiva em células tumorais isoladas, e vasos. Algumas células são redondas, outras apresentam prolongamentos. | |
| S-100. As células tumorais foram negativas para proteína S-100, mas raízes cruzando o tumor eram fortemente positivas. O anticorpo marca células de Schwann e baínhas de mielina. |
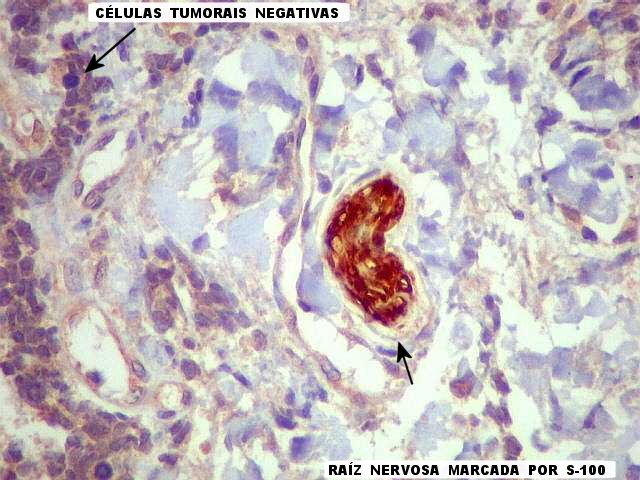 |
|
| S-100 - Marcação de adipócitos. Células adiposas maduras dos tecidos infiltrados mostram positividade citoplasmática para S-100, um achado corriqueiro. As células tumorais de permeio são negativas. | |
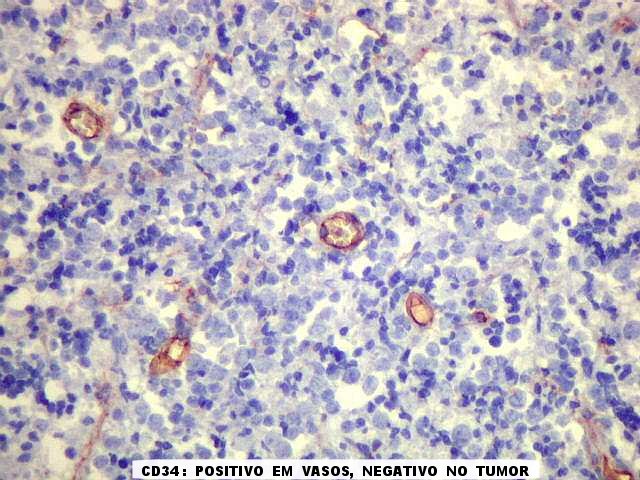
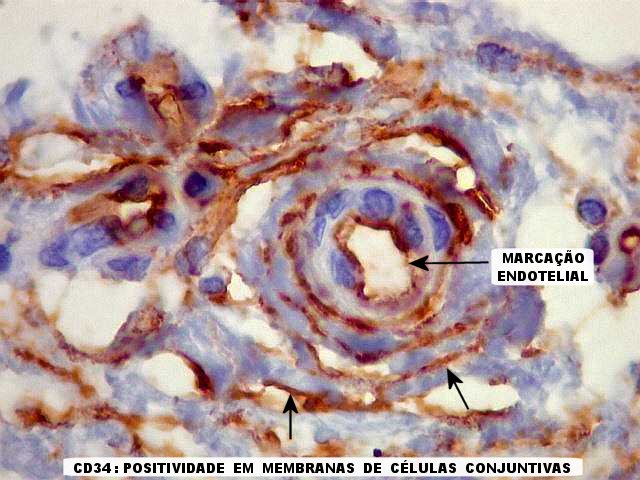
| CD34. CD34 é positivo em endotélio e habitualmente o utilizamos para estudar vasos tumorais. Aqui observamos dois padrões. Em áreas sólidas de tumor 'puro', sem elementos conjuntivos ou reação desmoplásica, CD34 marcou apenas as luzes de pequenos vasos e foi negativo no tumor. |
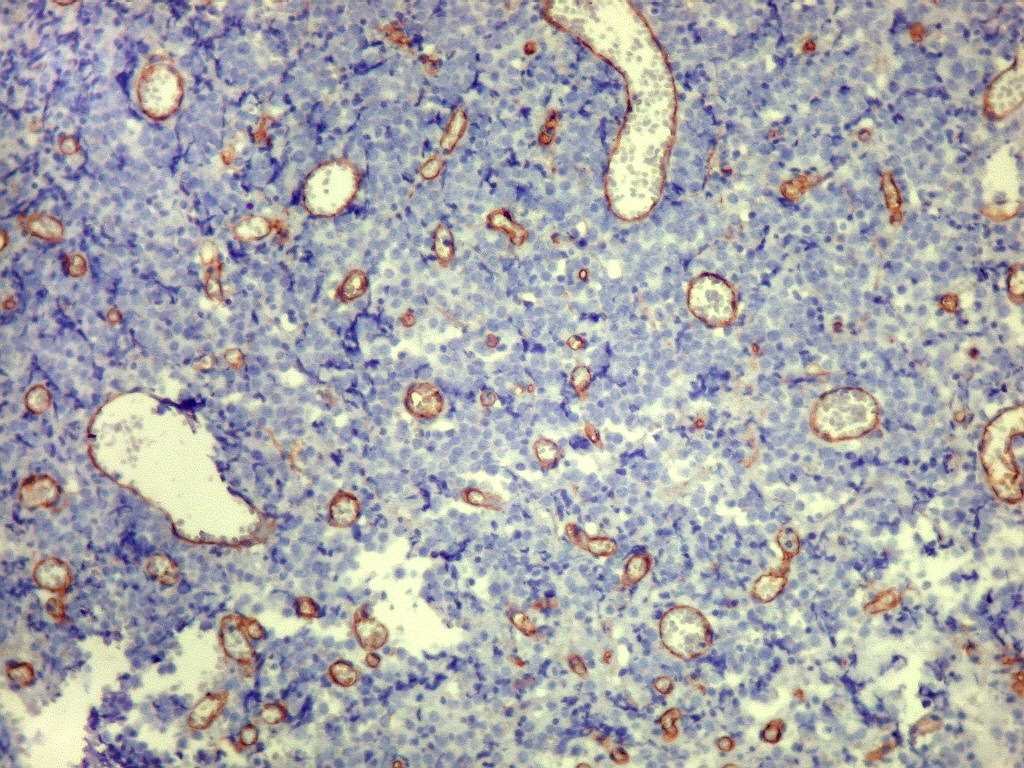 |
 |
|
| CD34. Positividade em tecido fibroso, reação desmoplásica e em células perivasculares. Nas áreas de tumor ricas em tecido conjuntivo, já comentadas acima em HE e tricrômico de Masson, essas células mostraram marcação nas membranas externas por CD34, não raro exuberante. Geralmente estas áreas estavam associadas a vasos, às vezes lembrando manguitos perivasculares. |
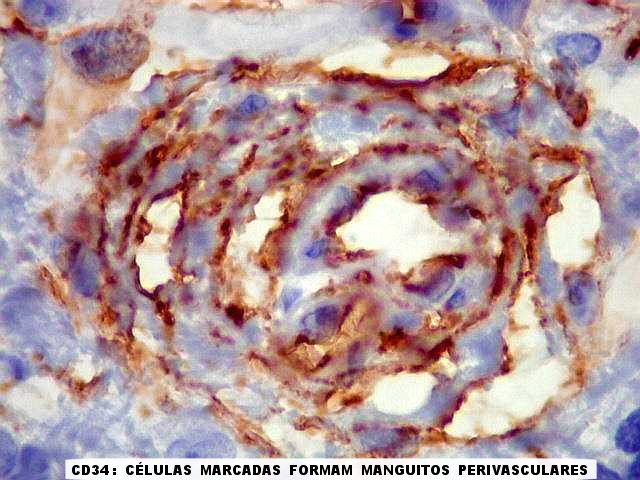 |
|
 |
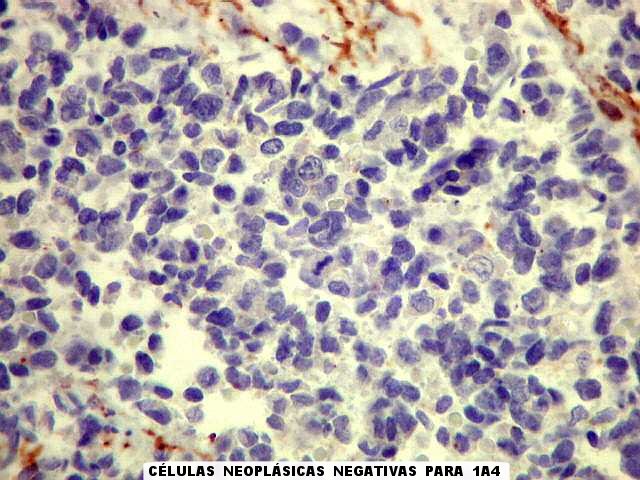
| 1A4. É um anticorpo contra actina de músculo liso (mais especificamente, 1A4 é o clone celular que produz dito anticorpo). Reage contra células musculares lisas, mas também contra outras células contendo actina, como miofibroblastos e células mioepiteliais. Aqui, utilizamos 1A4 para tentar demonstrar diferenciação muscular nas células tumorais. Contudo, a virtual totalidade das células neoplásicas não expressaram a proteína. As células positivas são relacionadas a vasos ou a prováveis miofibroblastos nos ligamentos infiltrados pelo tumor. |
 |
|
| 1A4. Positividade em vasos. Como esperado, pequenos vasos intratumorais marcaram-se fortemente para actina de músculo liso. Algumas células positivas, aparentemente isoladas, provavelmente estavam associadas a vasos próximos, mas fora do plano de corte. | |
| Células na luz vascular (artefato). Como já comentado acima em HE, vasos preenchidos por células neoplásicas são melhor interpretados como artefato de compressão e manipulação do tecido. | |
 |
|
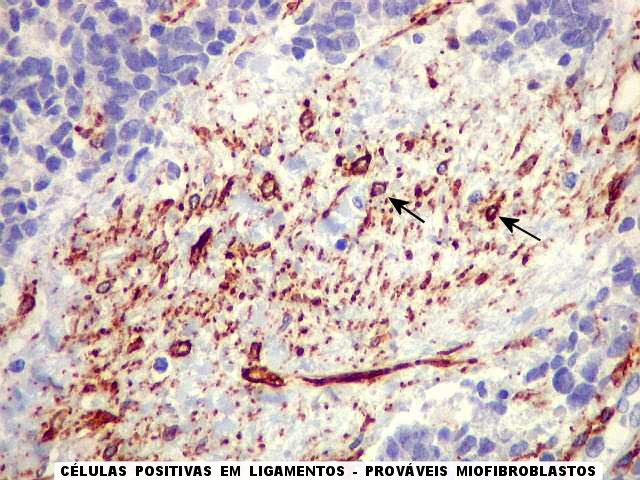
| 1A4. Positividade em ligamentos. Chamou a atenção a forte positividade de 1A4 em estruturas que consideramos ligamentos envoltos pelo tecido neoplásico, devido à orientação paralela e levemente ondulada das fibras colágenas. A marcação parecia identificar prolongamentos celulares ao longo dos feixes colágenos. Hipotetizamos que tais células corresponderiam a miofibroblastos, células de propriedades intermediárias entre fibroblastos e células musculares lisas, e cuja presença tem sido documentada em ligamentos de outras áreas corporais, especialmente no joelho (ver literatura abaixo). |
 |
|
|
Na literatura (PubMed) não encontramos referências a miofibroblastos em ligamentos da coluna vertebral. Contudo estas células são constituintes normais do ligamento cruzado anterior, e de outros ligamentos do joelho, e sofrem variações em situações patológicas, como durante reparo. Não fica claro se a quantidade aqui encontrada seria normal ou aumentada, em resposta ao tumor. Os supostos miofibroblastos reagiram para 1A4 mas foram negativos para outros anticorpos musculares pesquisados (HHF-35 e desmina). Refs. Agarwal C, Britton ZT, Alaseirlis DA, Li Y, Wang JH. Healing and normal fibroblasts exhibit differential proliferation, collagen production, alpha-SMA expression, and contraction. Ann Biomed Eng. 2006 Apr;34(4):653-9. Faryniarz DA, Chaponnier C, Gabbiani G, Yannas IV, Spector M. Myofibroblasts in the healing lapine medial collateral ligament: possible mechanisms of contraction. J Orthop Res. 1996 Mar;14(2):228-37. Hartzel DK, Arnoczky SP, Kilfoyle SJ, Stick JA. Myofibroblasts in the accessory ligament (distal check ligament) and the deep digital flexor tendon of foals. Am J Vet Res. 2001 Jun;62(6):823-7. Murray MM, Martin SD, Martin TL, Spector M. Histological changes in the human anterior cruciate ligament after rupture. J Bone Joint Surg Am. 2000 Oct;82-A(10):1387-97. Weiler A,
Unterhauser FN, Bail HJ, Hüning M, Haas NP. Alpha-smooth muscle actin
is expressed by fibroblastic cells of the ovine anterior cruciate ligament
and its free tendon graft during remodeling. J Orthop Res. 2002 Mar;20(2):310-7.
|
|
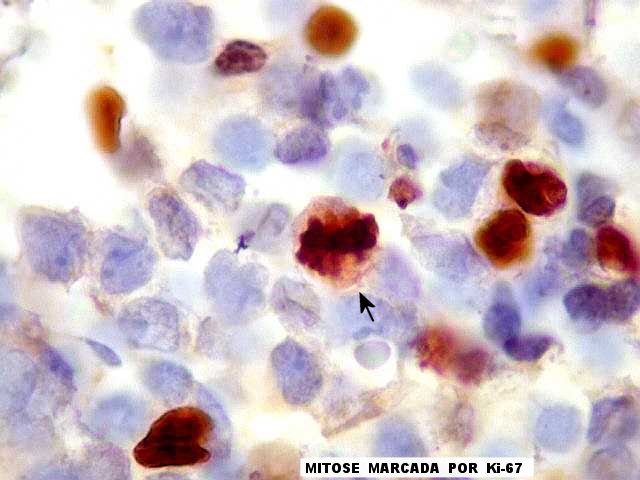
| Ki-67. Consideramos marcados cerca de 20% dos núcleos tumorais, em estimativa visual sem contagem, percentagem elevada e compatível com o rápido crescimento do tumor. Figuras de mitose são mais facilmente visualizáveis com esta técnica que com HE. |
 |
|
| Obs. Negativo também para : GFAP, NSE, NF, cromogranina, HHF-35, desmina, miogenina, myo-D1, AE1AE3, CD20, CD3, bcl-2, MPX. |
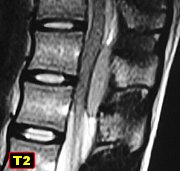
| Para mais imagens deste caso: | RM | HE, colorações especiais |
 |
 |
|
|
|
|
|
|
|
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|