|
|
|
|
|
|
|
|
| Fem. 46 a. Para história clínica e ressonância magnética, clique. Recebido um pequeno fragmento a fresco durante o ato cirúrgico, que foi utilizado em parte para esfregaço. O restante foi fixado em formol a 10% para inclusão em parafina, cortes corados por HE e imunohistoquímica. |
| Destaques da microscopia. | ||
| Esfregaço. Atipias nucleares | Capilares finos, núcleos de células endoteliais espaçados | Parafina HE. Aumento da celularidade, atipias nucleares |
 |
 |
 |
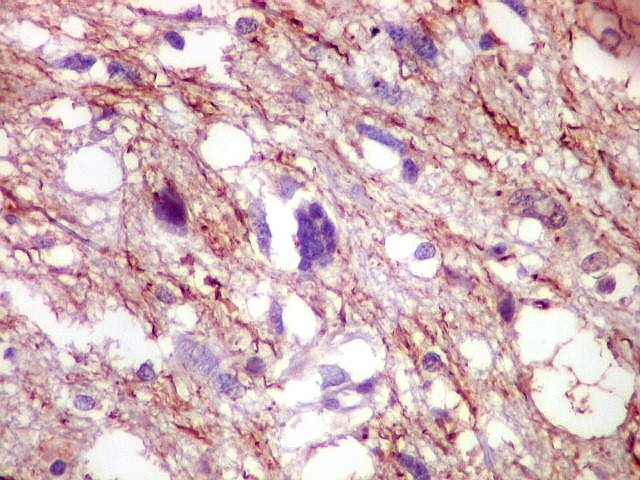
| GFAP. Positividade citoplasmática em células neoplásicas atípicas e multinucleadas. Algumas células neoplásicas são negativas. | VIM. Idem. Algumas células neoplásicas são negativas. | NF. Rarefação de axônios na substância branca. Núcleos atípicos entre axônios |
 |
 |
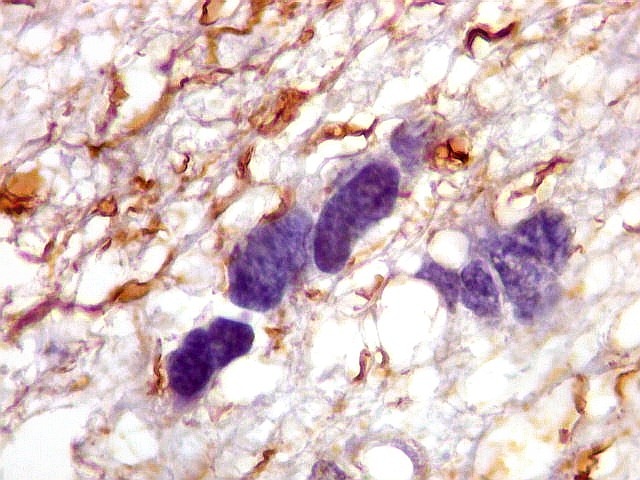 |
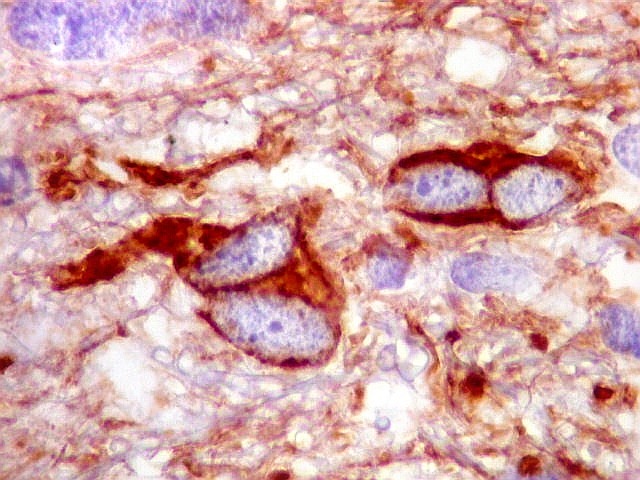
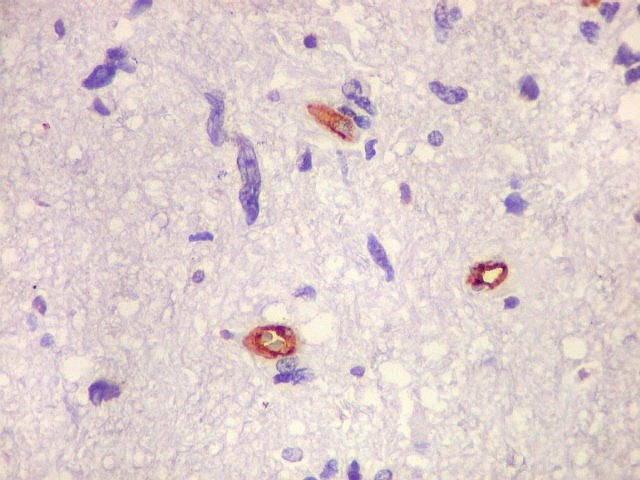
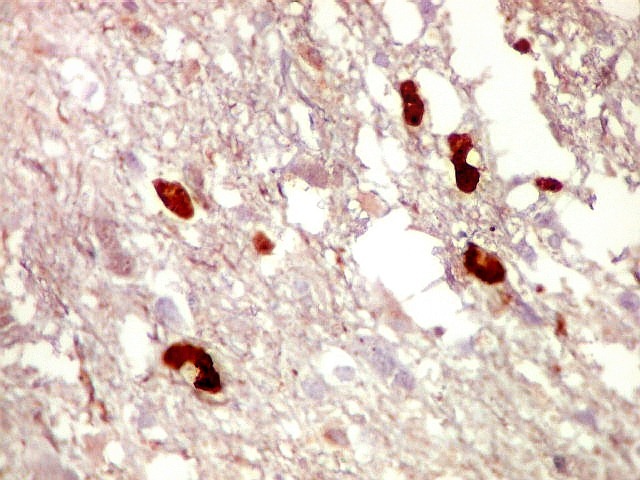
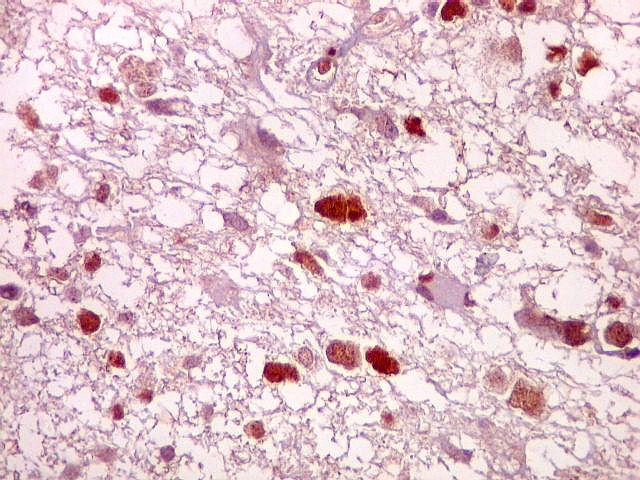
| CD34. Positivo em vasos, negativo no tumor. Capilares finos e espaçados (raras possíveis exceções) | Ki-67. Positividade em alta proporção dos núcleos das células neoplásicas. | p53. Idem. |
 |
 |
 |
|
|
||
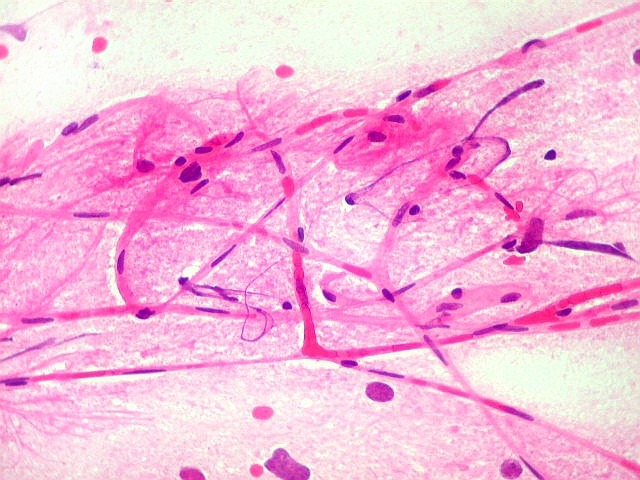
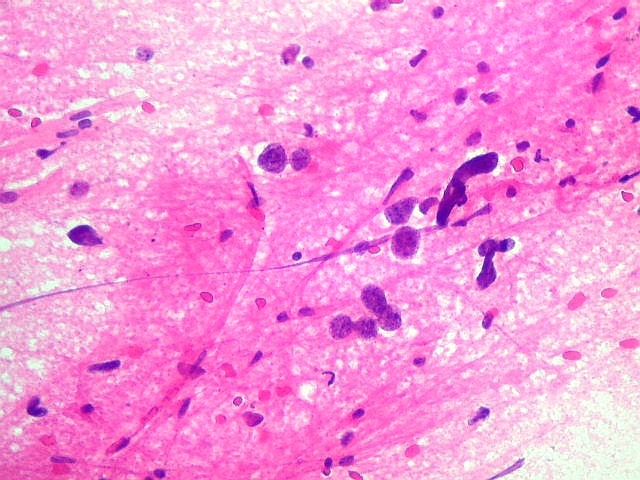
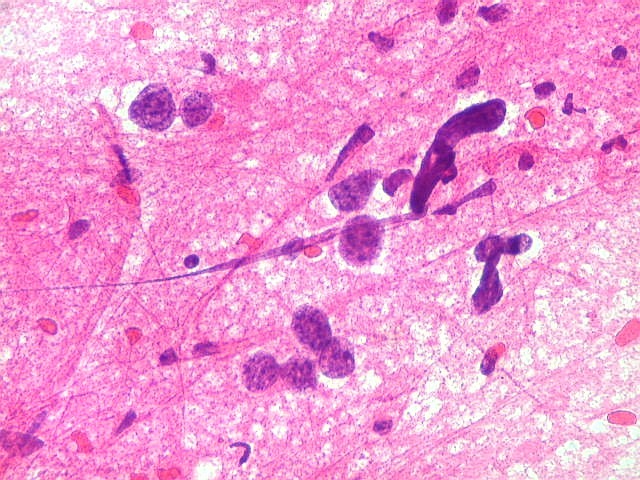
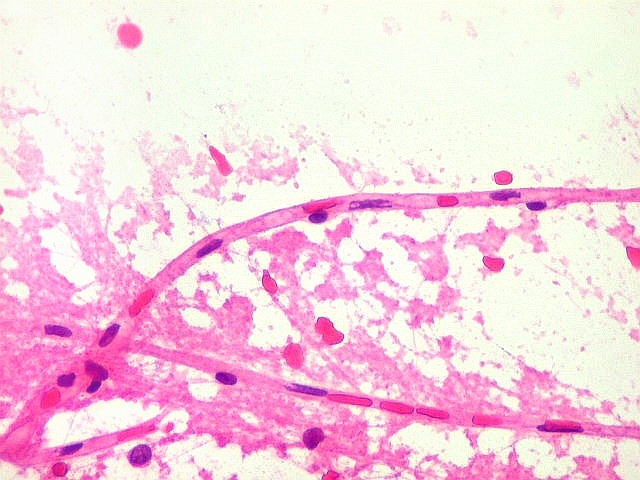
| ESFREGAÇO. A técnica do esfregaço é simples, rápida, e dá bons resultados em tecidos moles, como neoplasias neuroectodérmicas. Permite espalhar uma amostra diminuta (de cerca de 1 mm3) pela superfície de uma lâmina, extraindo informações significativas de um material que, se fosse para congelação, talvez se perdesse pelo pequeno tamanho e por formação de cristais de gelo. |
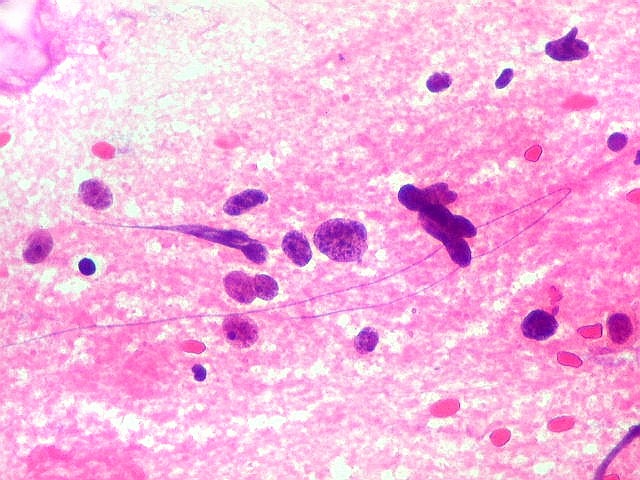
| ESFREGAÇO.
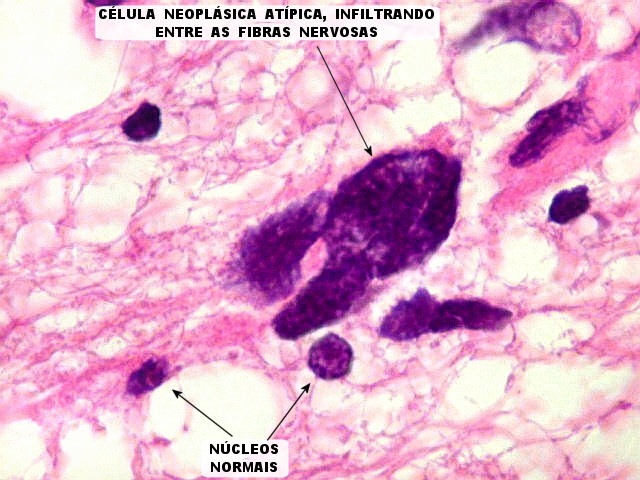
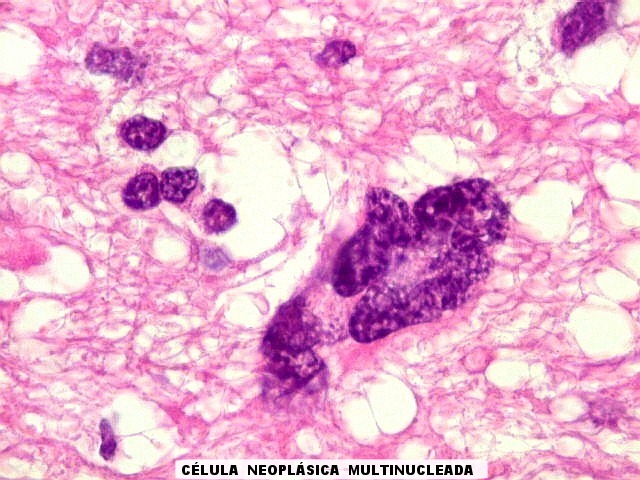
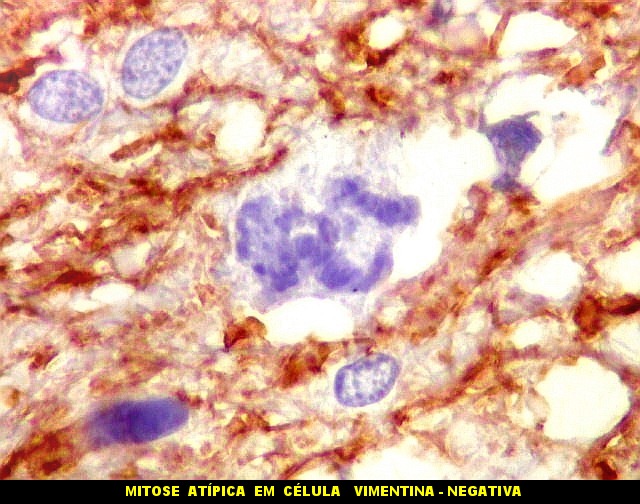
Atipias celulares. Neste exemplo, chamam a atenção as acentuadas atipias nucleares. A maioria dos núcleos exibe intensa variação de volume e cromatismo. A quantidade de citoplasma é muito escassa, correspondendo, portanto, à perda da relação núcleo citoplasma, própria das neoplasias malignas. |
 |
 |
 |
 |
 |
 |
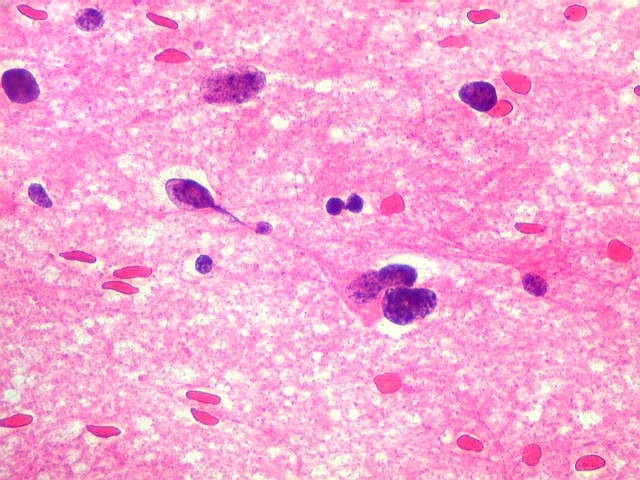
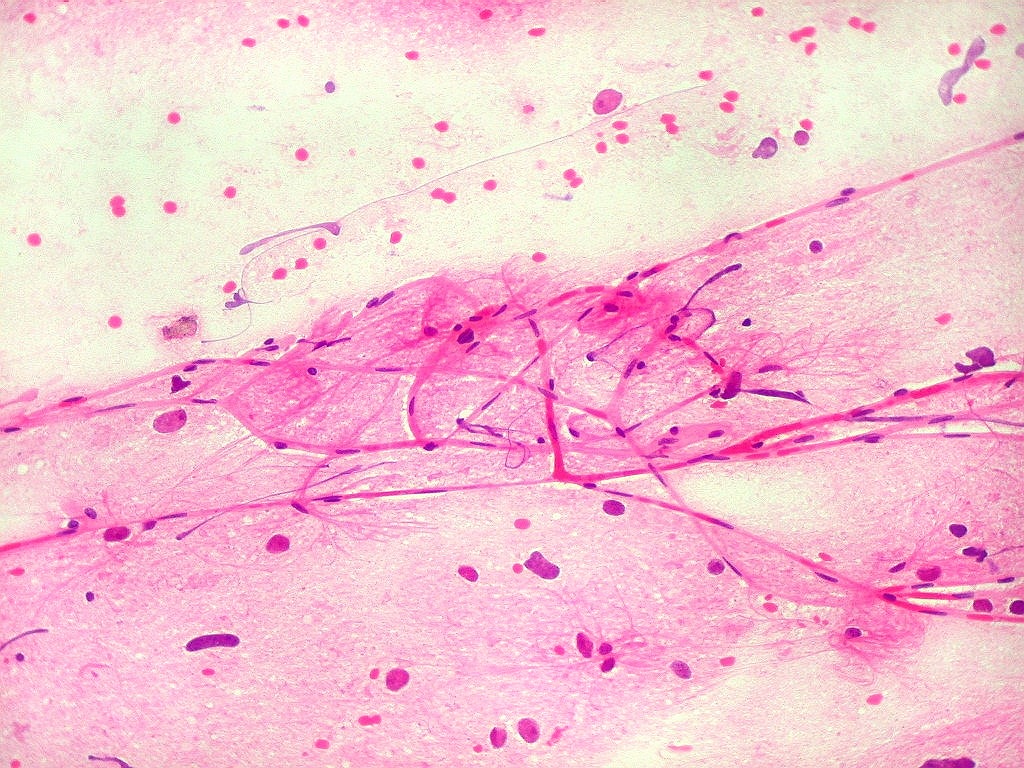
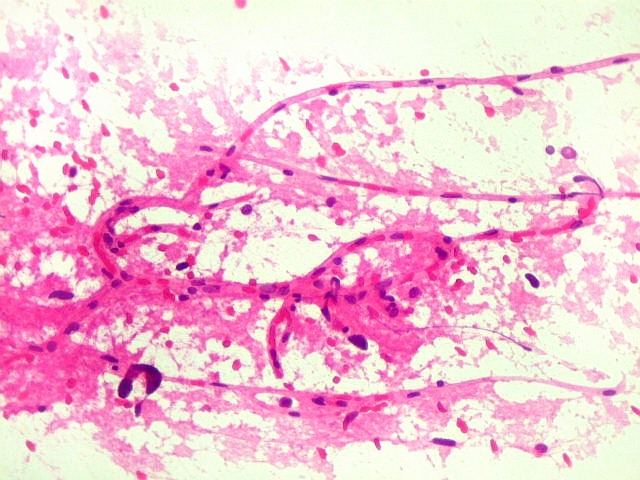
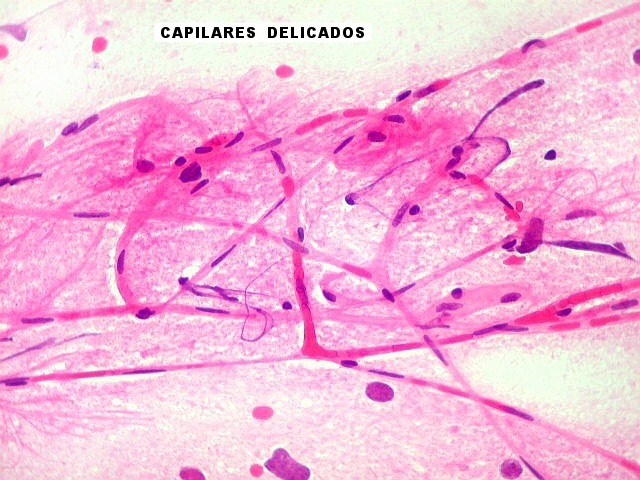
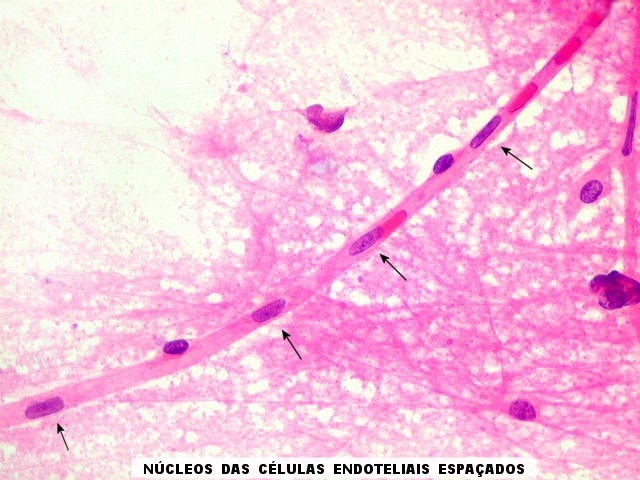
| Capilares.
Outra vantagem do esfregaço é permitir o estudo dos vasos, especialmente dos capilares, por longas distâncias. Aqui, os capilares são finos, e os núcleos das células endoteliais espaçados entre si por intervalos que vão a até cerca de 5 diâmetros nucleares. Não há tumefação nem superposição de núcleos, ou formação de enovelados chamados de pseudoglomérulos, próprios dos gliomas malignos. |
 |
 |
 |
 |
 |
|
|
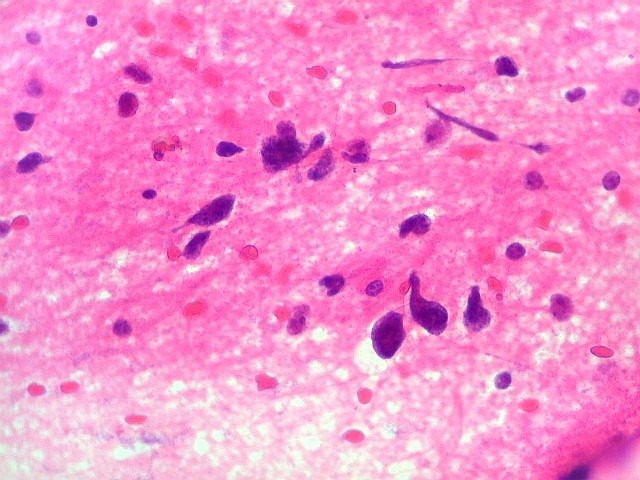
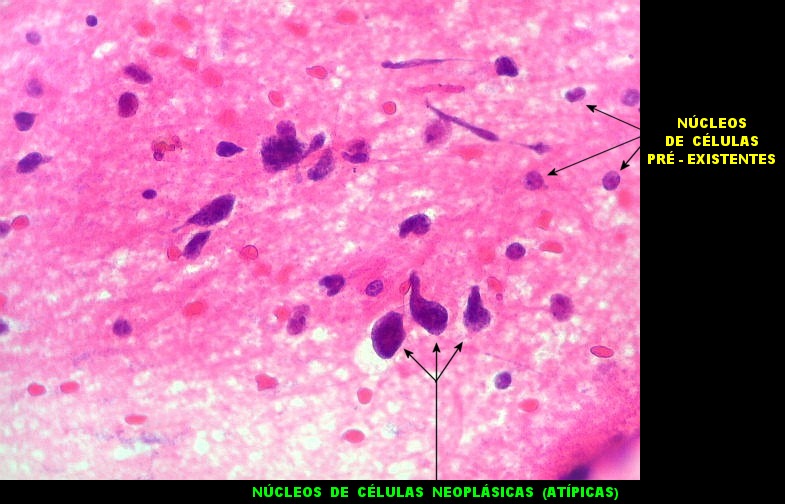
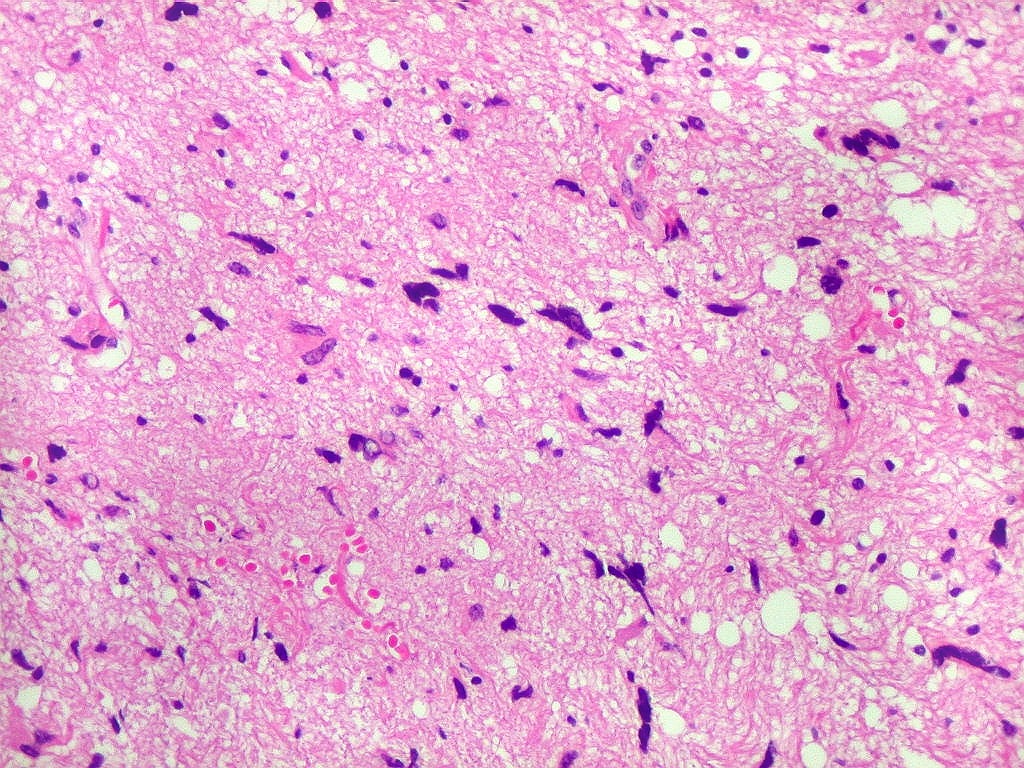
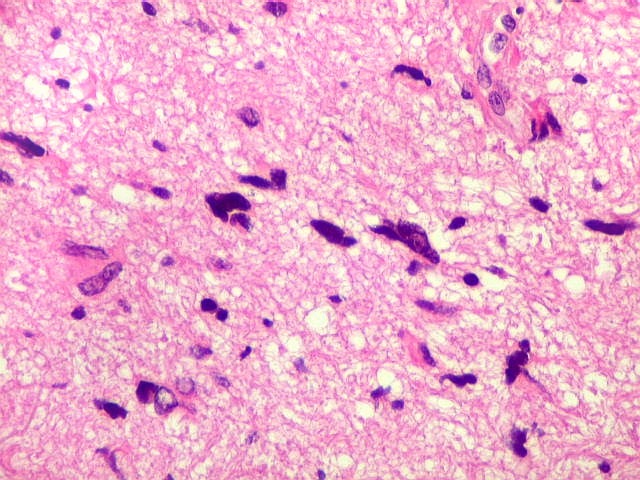
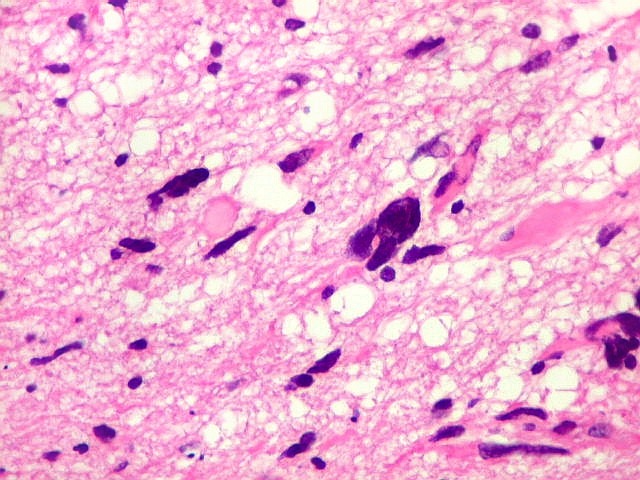
| Atipias nucleares. No corte de parafina, chama a atenção, como no esfregaço, a grande heterogeneidade dos núcleos. Grande parte são hipercromáticos, de forma irregular, e não raro agrupados. As células neoplásicas infiltram difusamente o tecido, como se esperaria de um glioma difuso. As células pré-existentes correspondem a astrócitos e oligodendrócitos, pois na substância branca não há corpos celulares de neurônios. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
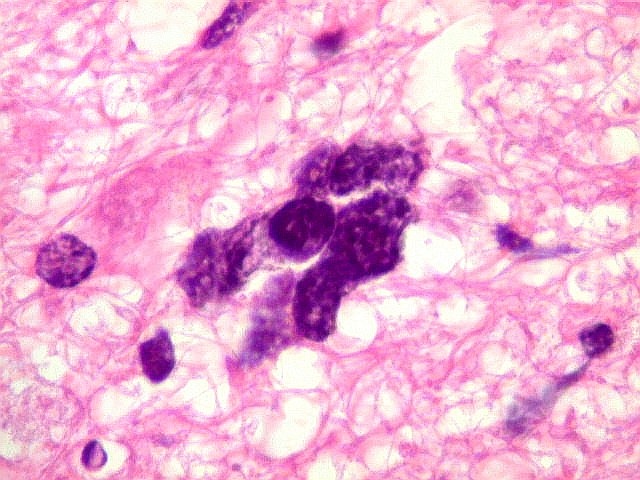 |
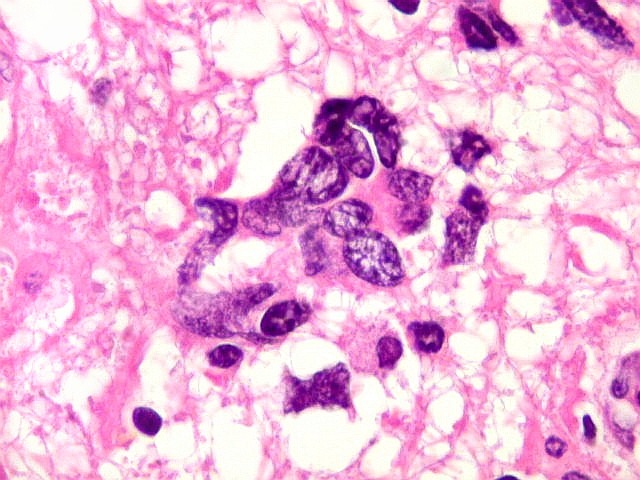
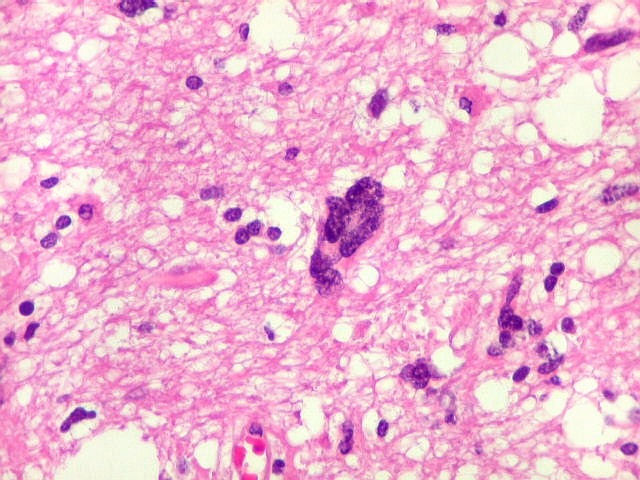
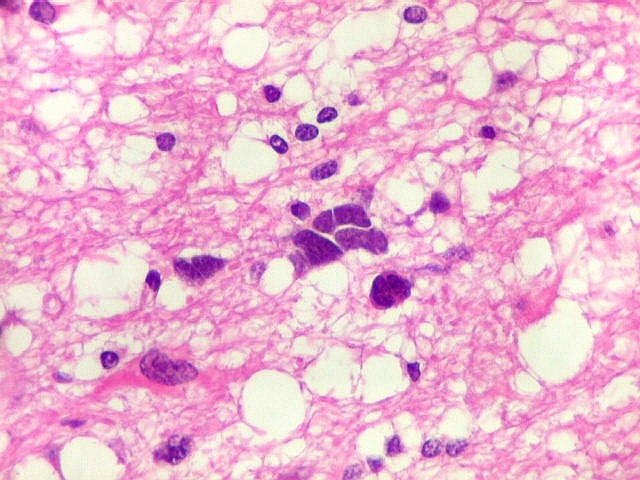
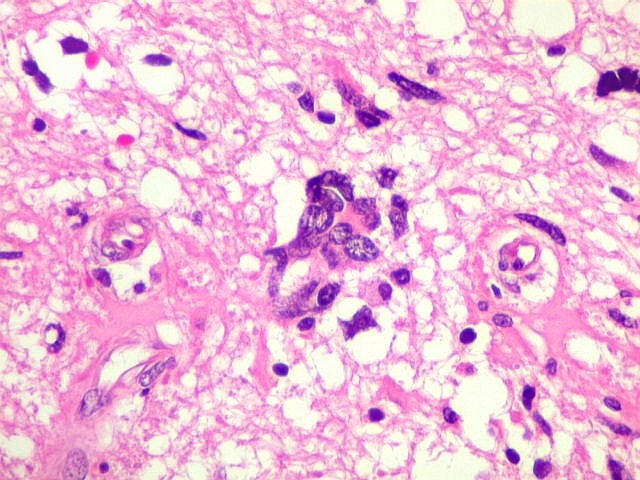
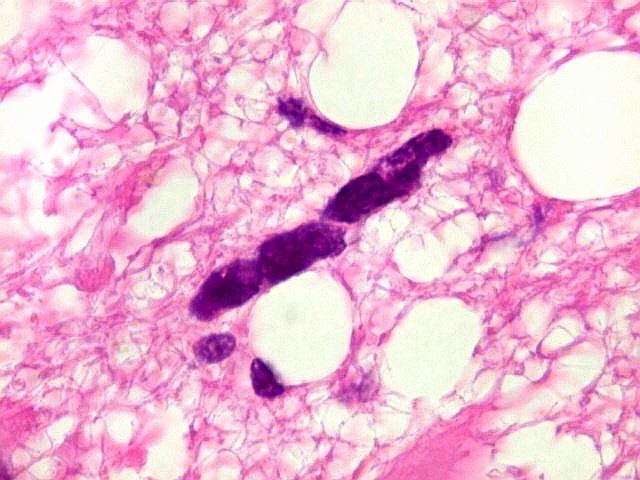
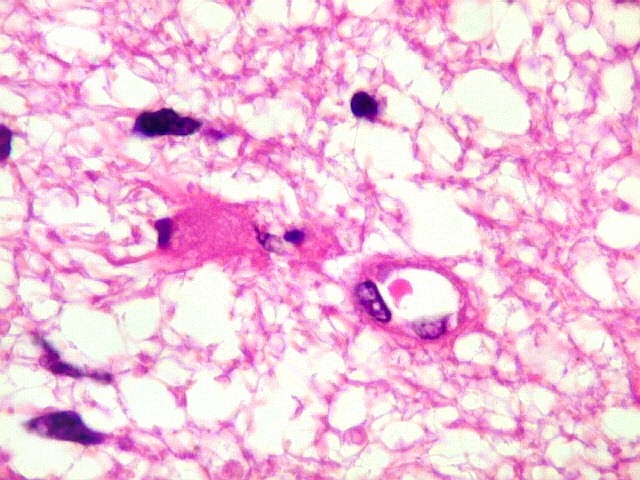
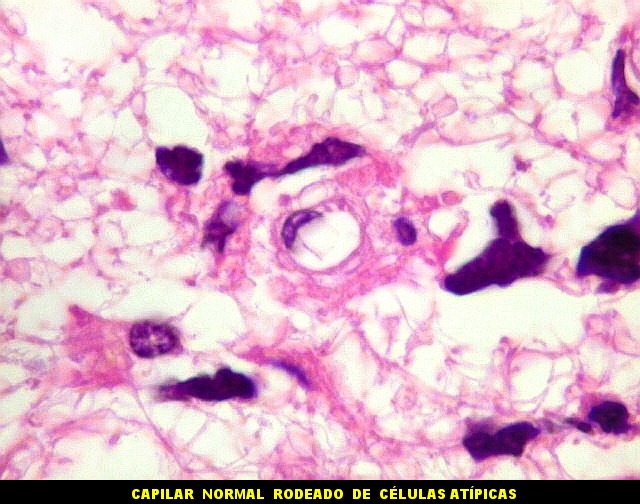
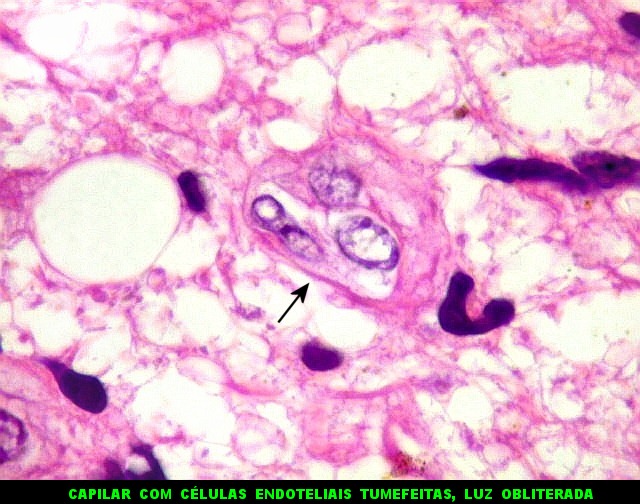
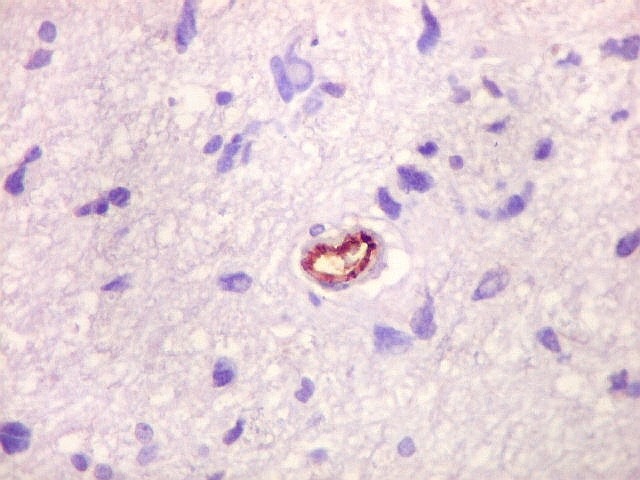
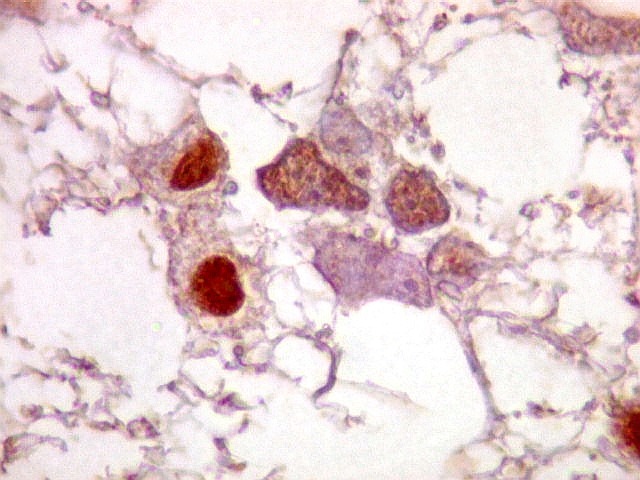
| Astrócitos pré-existentes; vasos. Alguns astrócitos autóctones do tecido são gemistocíticos, com citoplasma abundante e núcleo excêntrico. São células reativas, em princípio inespecíficas, que estão respondendo a algum tipo de agressão (no caso, a infiltração tumoral). Os capilares são na grande maioria finos, com células endoteliais delicadas. Um único exemplo de capilar com células endoteliais tumefeitas e empilhadas está demonstrado abaixo. A aparente normalidade dos capilares correlaciona-se com a ausência de impregnação por contraste em ressonância magnética. | |
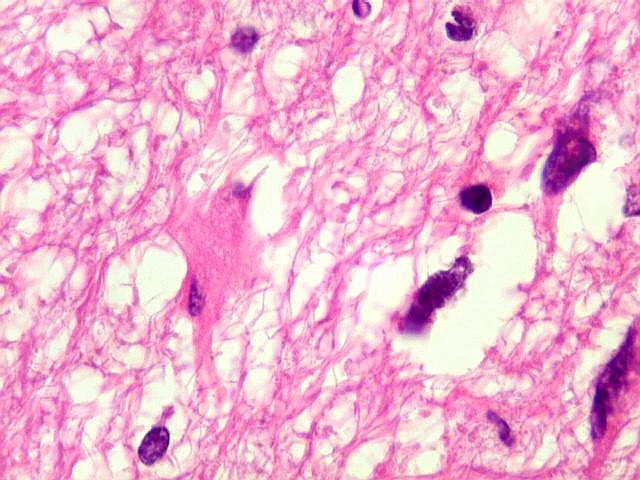 |
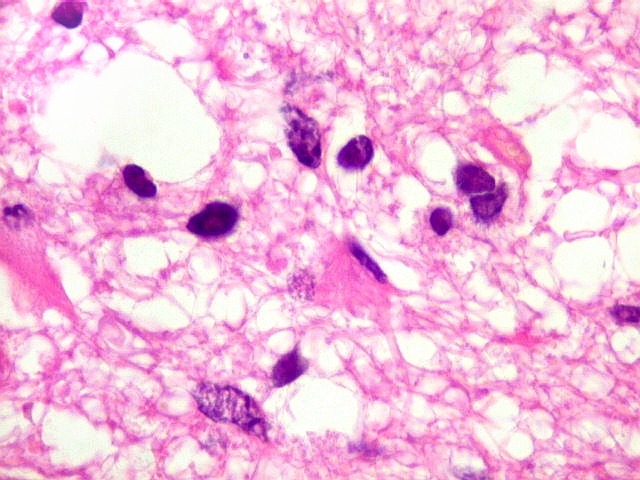 |
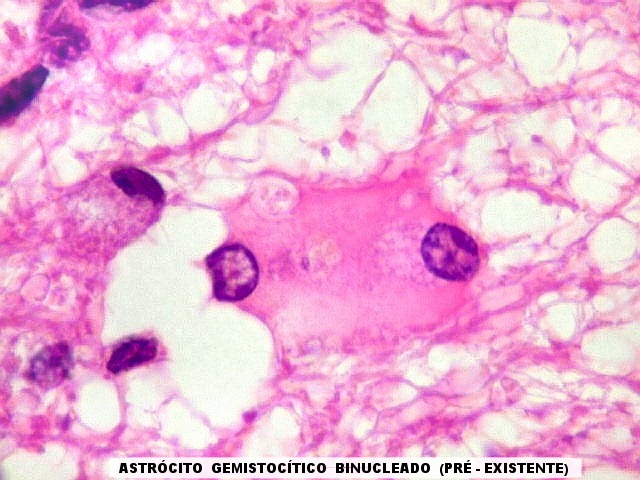 |
 |
 |
 |
|
|
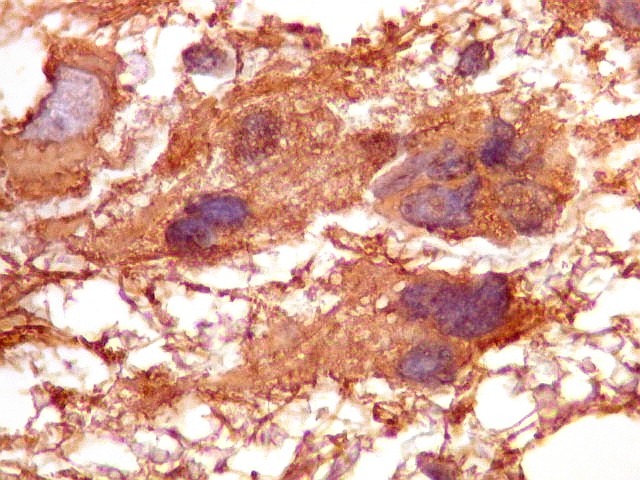
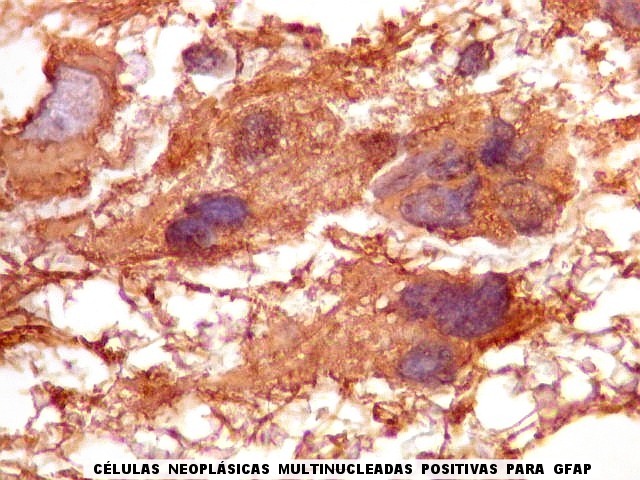
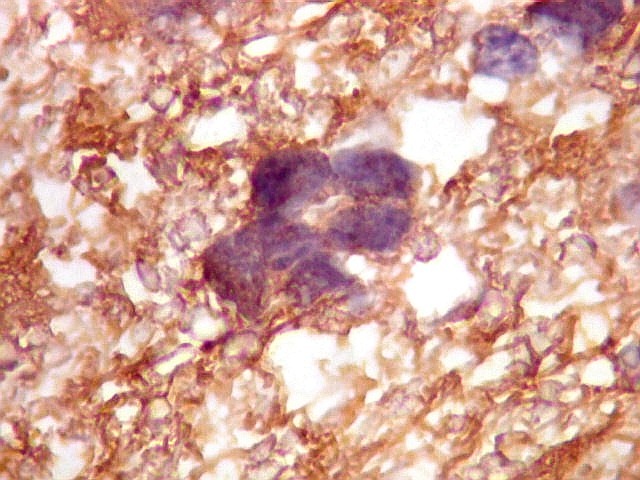
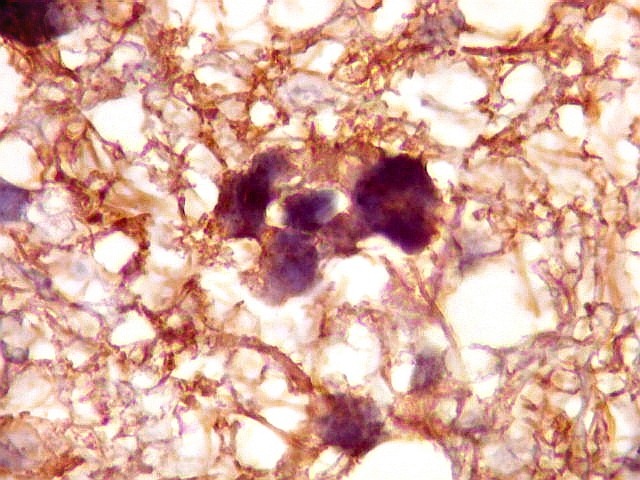
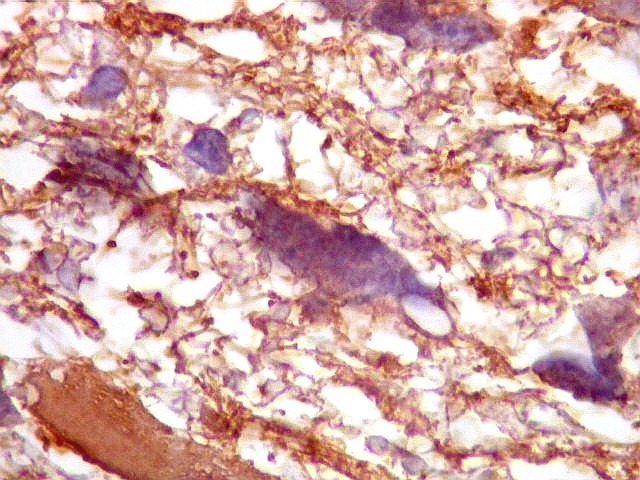
| GFAP.
Atipias celulares.
A imunohistoquímica para GFAP, uma proteína do citoesqueleto de astrócitos, é positiva no citoplasma de várias células neoplásicas, demonstrando a natureza glial das mesmas. |
 |
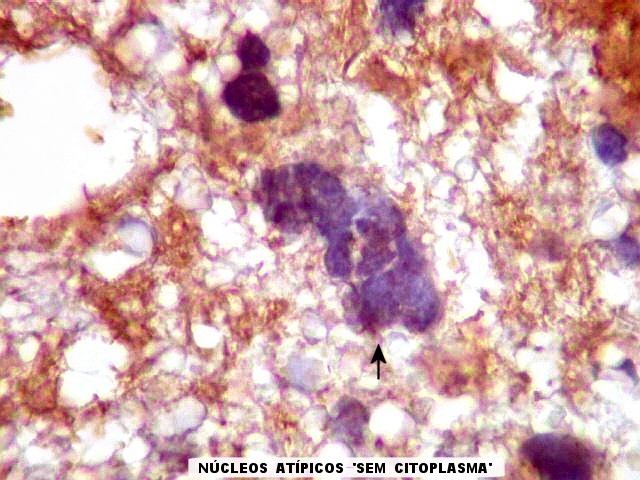
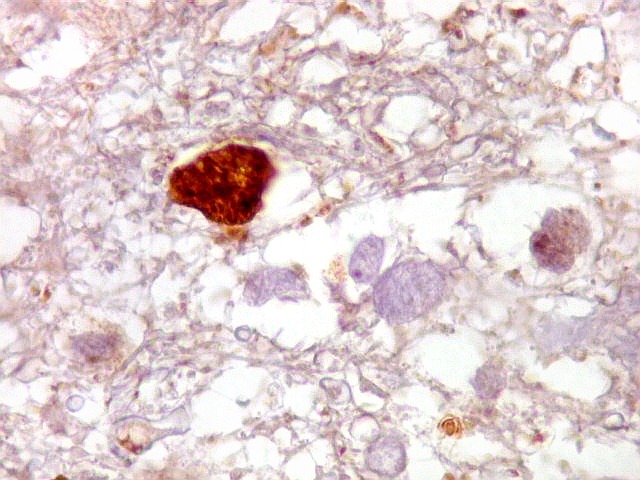
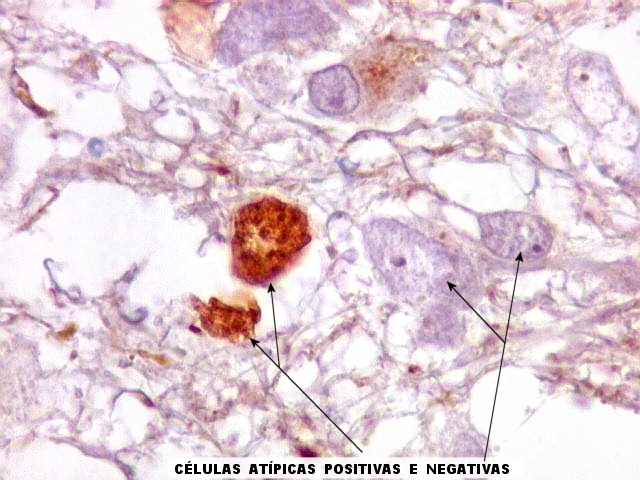
| GFAP. Atipias celulares. É de interesse, porém, que vários núcleos atípicos parecem soltos no tecido, sem citoplasma em volta. Pelo menos uma célula claramente neoplásica e com citoplasma abundante foi negativa para GFAP. É possível que algumas células tenham citoplasma tão escasso que escape detecção ou, alternativamente, não expressem GFAP. Comparar com resultados semelhantes para vimentina, abaixo. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
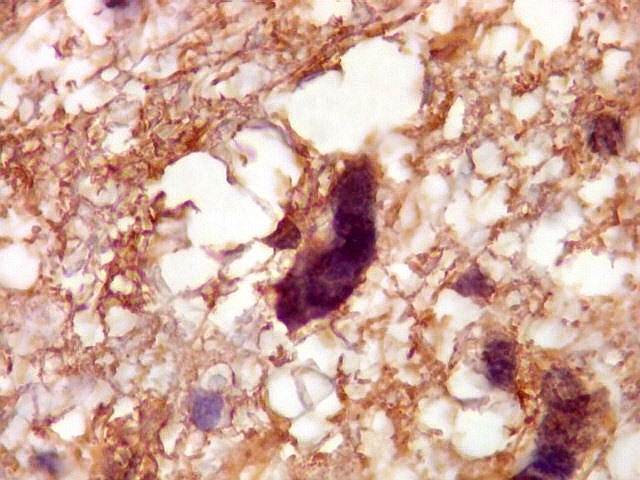
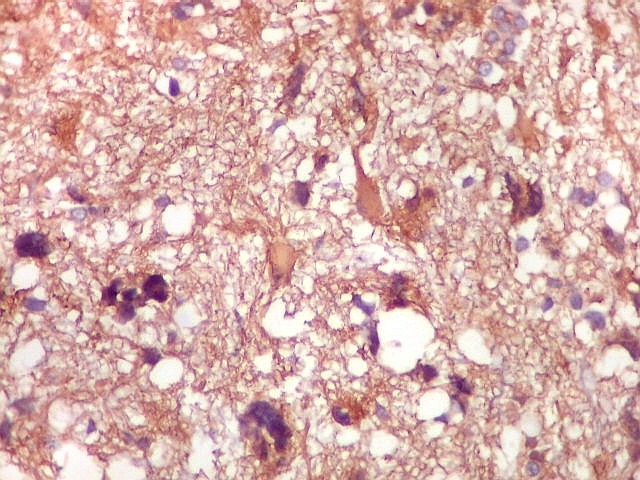
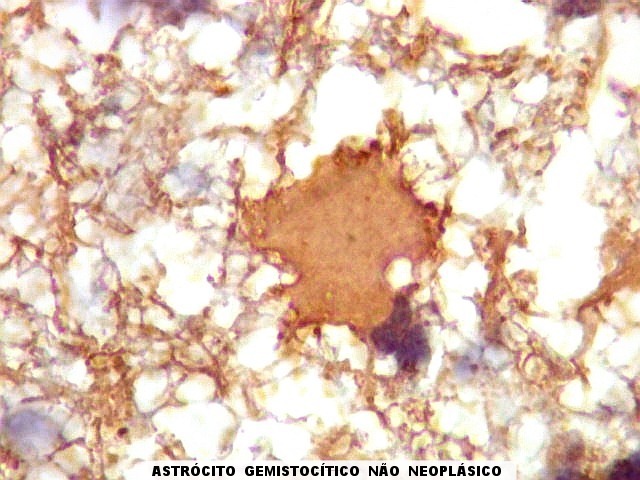
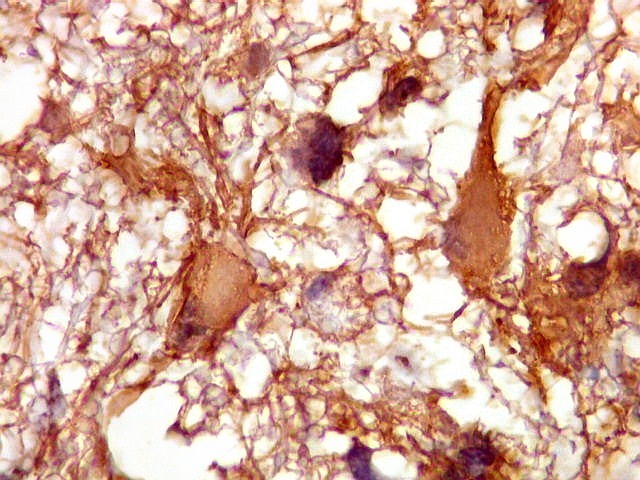
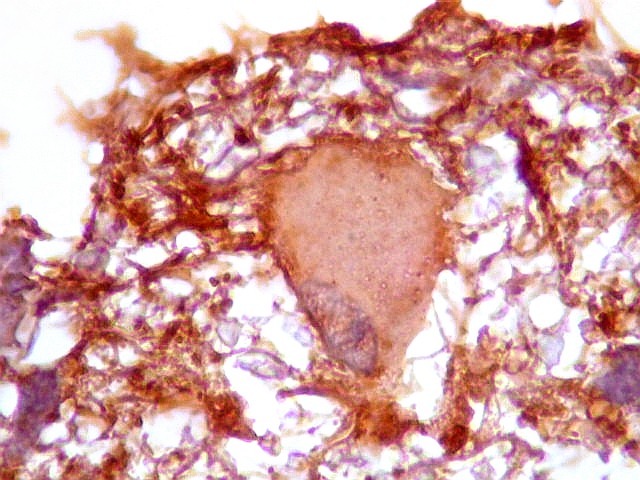
| GFAP.
Astrócitos pré-existentes.
Astrócitos pré-existentes são, em grande parte, formas gemistocíticas com citoplasma abundante, GFAP-positivo, e núcleos pequenos na periferia. |
 |
 |
 |
 |
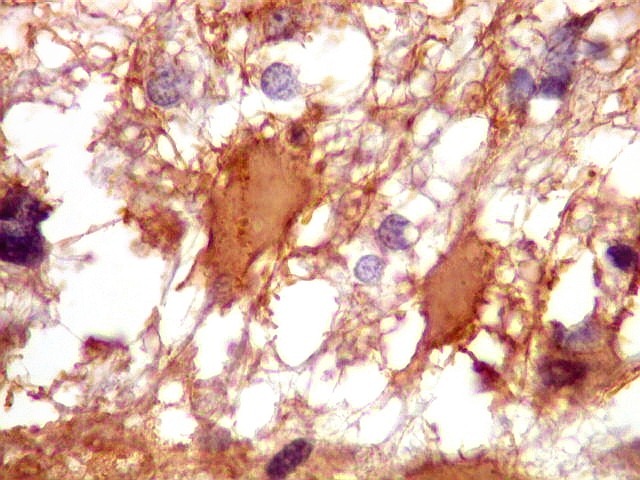 |
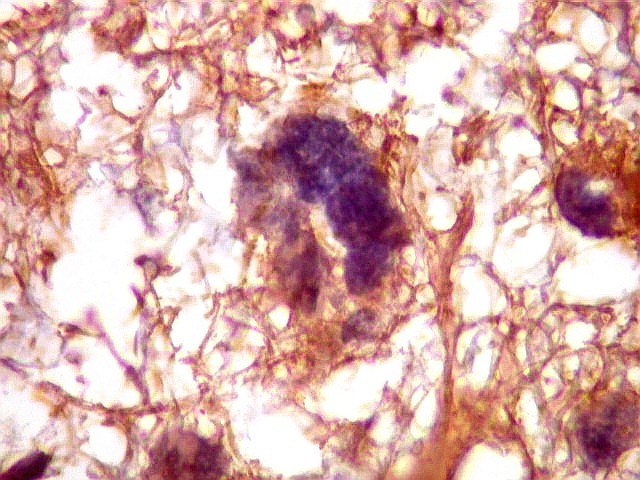
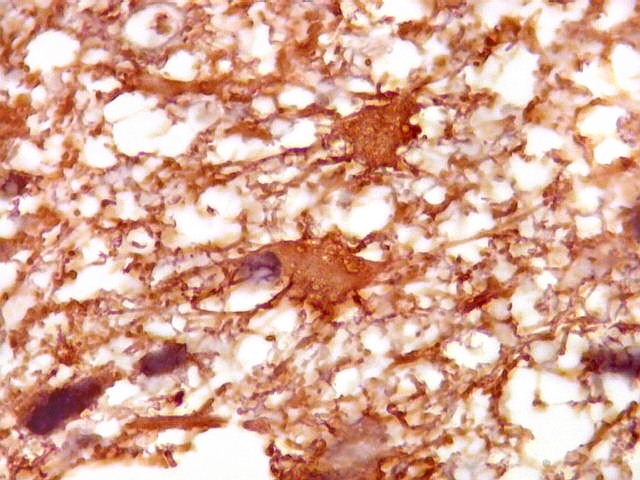
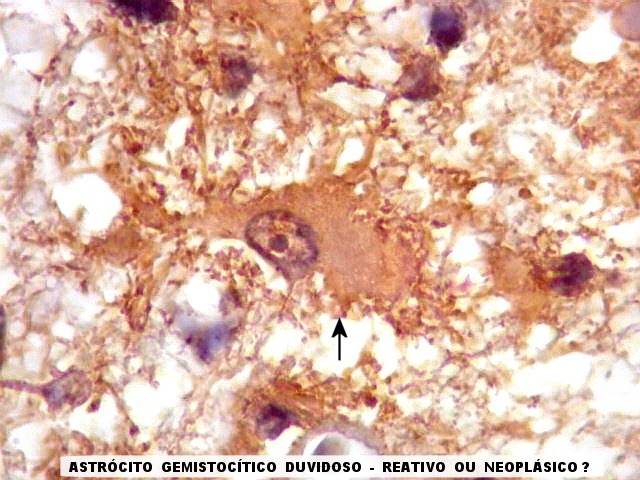
| Astrócitos de natureza incerta. Há algumas células com feições gemistocíticas (citoplasma abundante, núcleo periférico), mas que têm núcleos grandes demais para astrócitos apenas reativos e, inclusive, nucléolo proeminente. Fica a dúvida se seriam células pré-existentes excepcionalmente reativas ou neoplásicas bem diferenciadas. | |
 |
 |
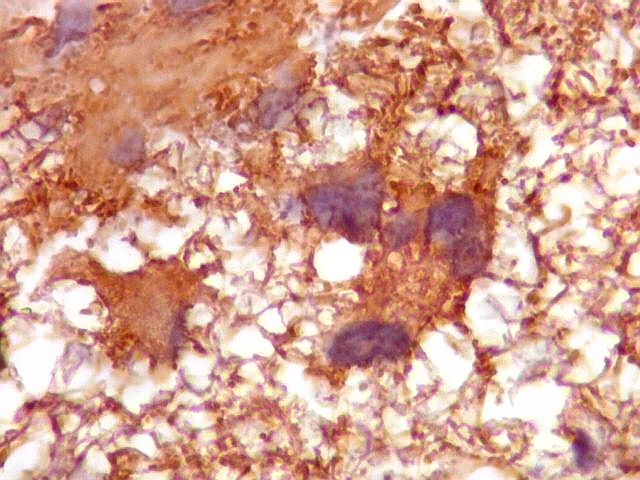
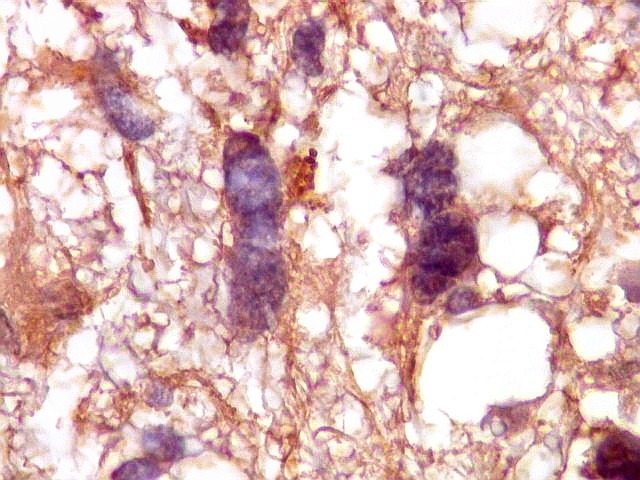
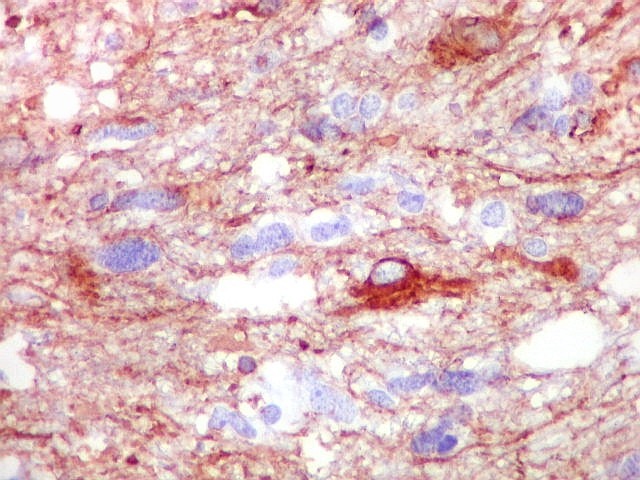
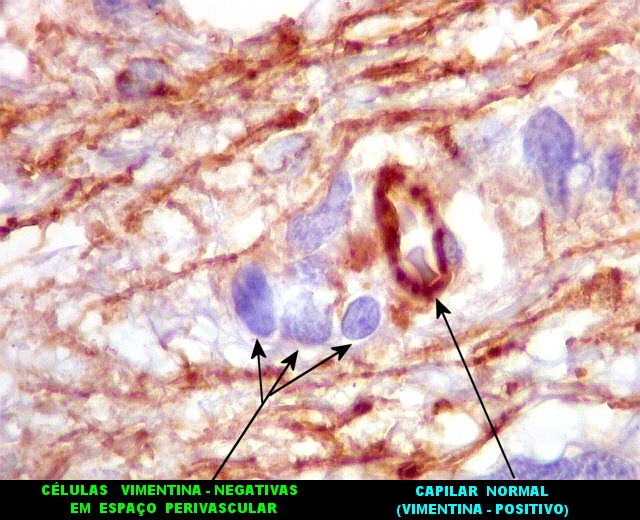
| VIM.
Vimentina, um filamento intermediário ubiquitário, largamente expressado em astrócitos, deu resultados semelhantes aos com GFAP acima. Parte das células neoplásicas tinham citoplasma visível e até abundante, enquanto em outras não se observava citoplasma, só o núcleo aparentemente solto no tecido. |
 |
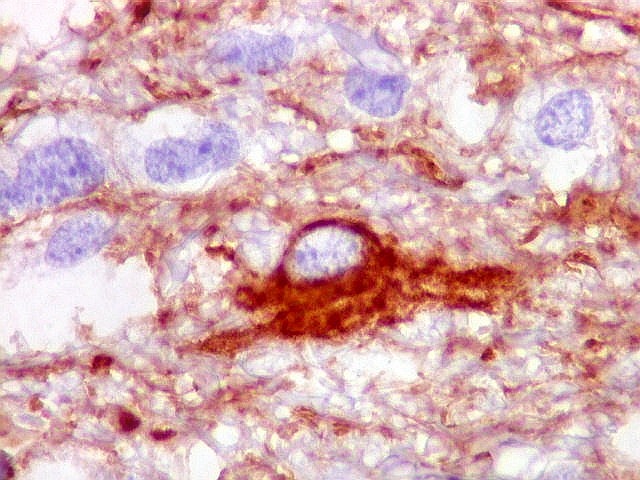
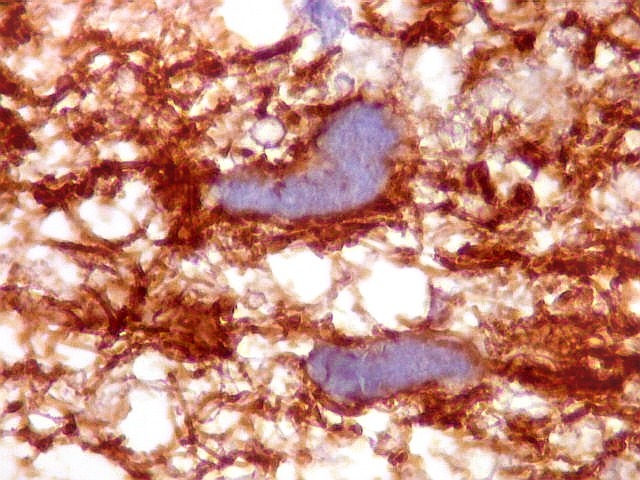
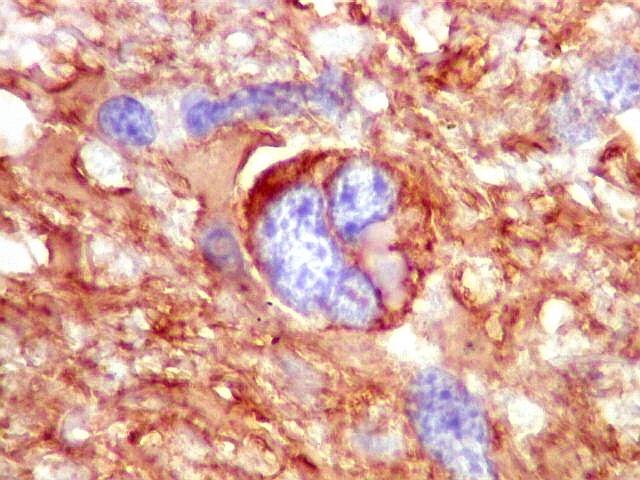
| VIM.
Células
atípicas com citoplasma demonstrável.
Muitas células neoplásicas expressam fortemente vimentina no citoplasma. |
 |
 |
 |
 |
 |
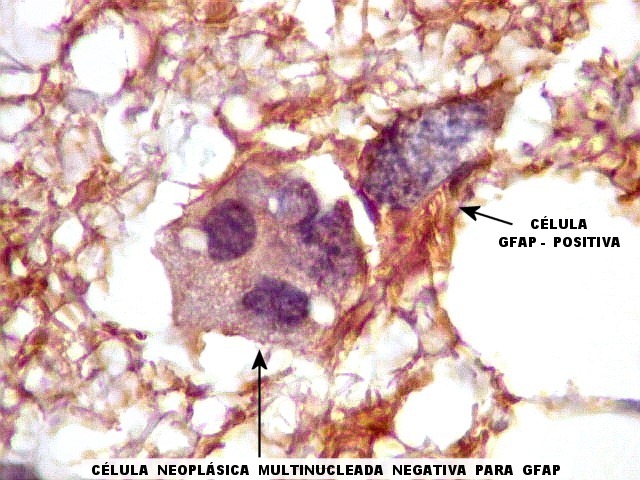
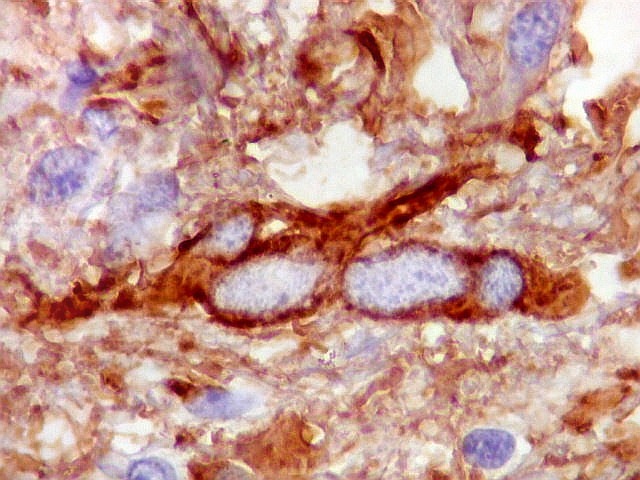
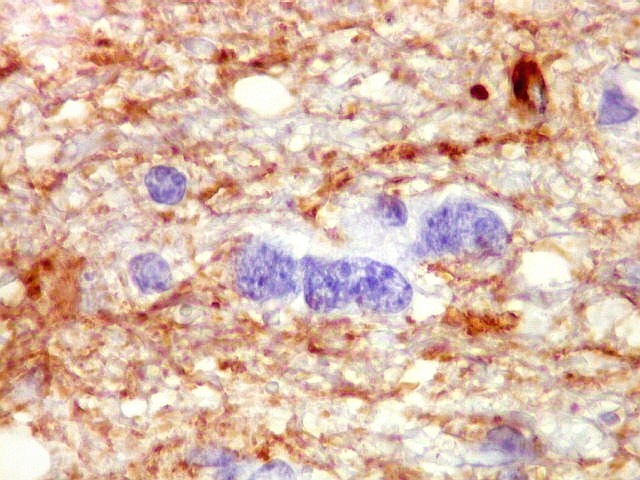
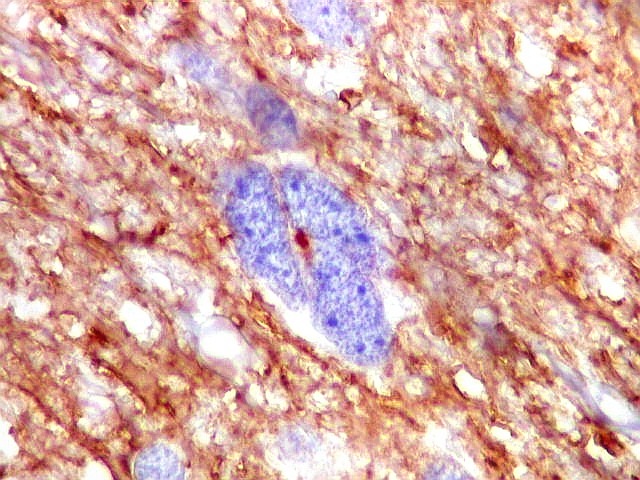
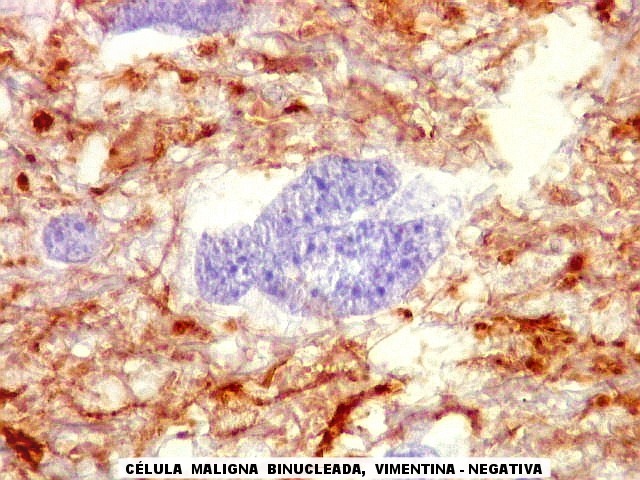
| VIM.
Células
atípicas sem citoplasma demonstrável.
Como não há células viáveis sem citoplasma, fica como mais provável que estas células altamente malignas não expressavam vimentina. |
 |
 |
 |
 |
 |
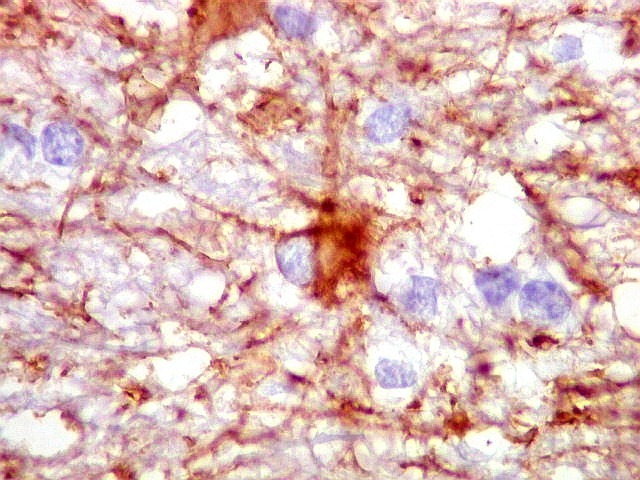
| VIM.
Astrócitos
pré-existentes.
Aspecto gemistocítico, como já comentado com GFAP, acima. São sempre vimentina positivos. |
 |
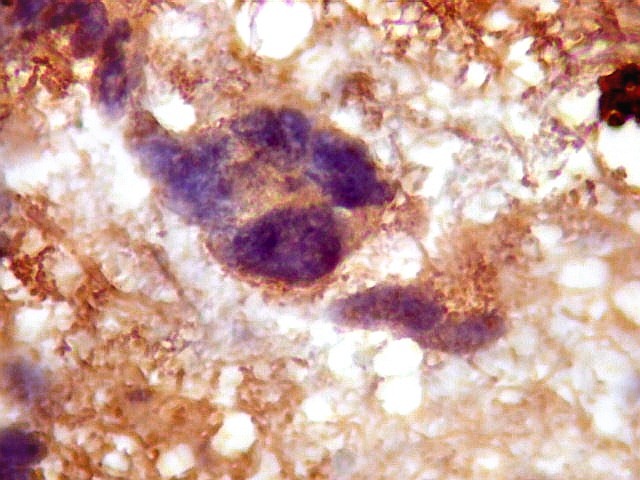
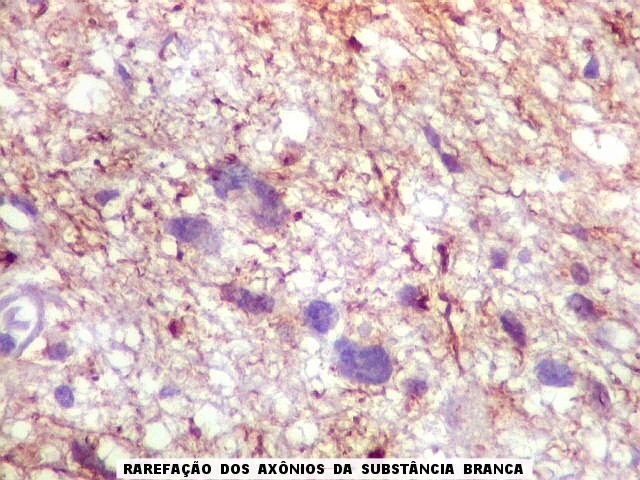
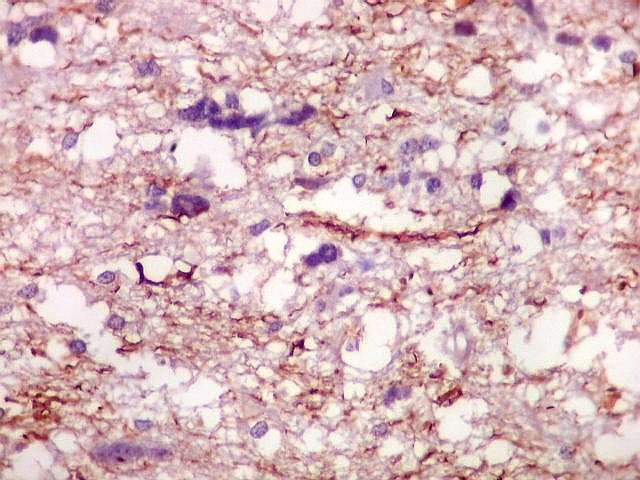
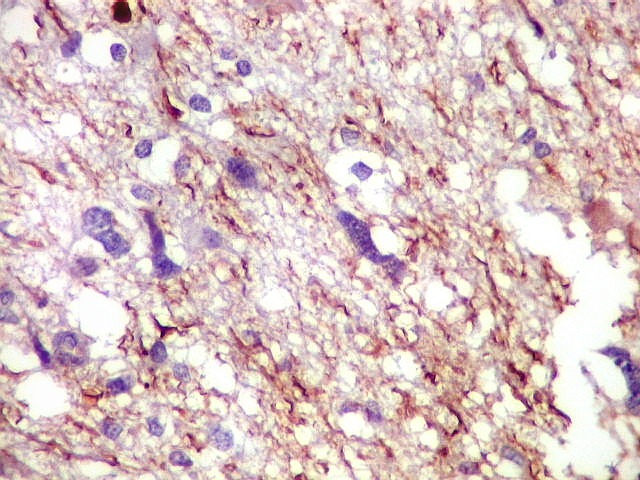
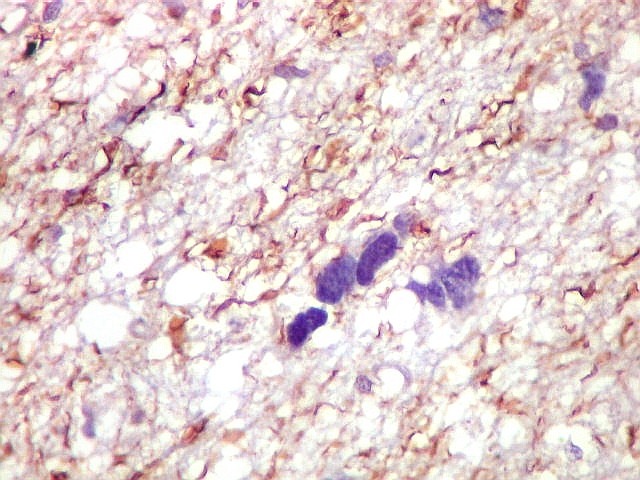
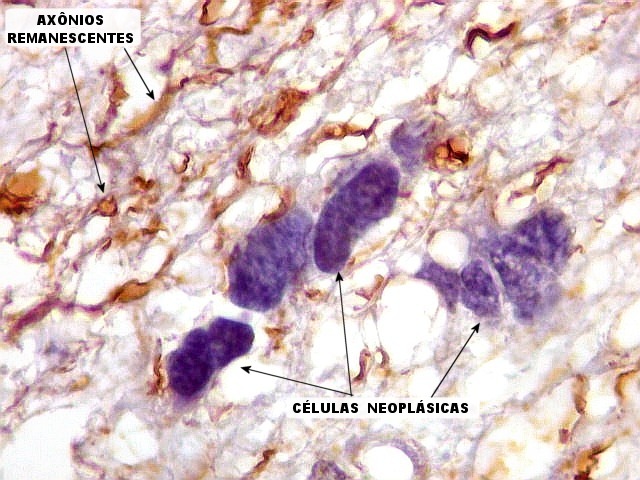
| NF. Proteína de neurofilamento é o anticorpo de escolha para demonstração de axônios, tanto em tecido nervoso central como em nervos periféricos. Aqui, observa-se rarefação dos axônios da substância branca, provavelmente por conta de compressão pelas células neoplásicas. Estas são encontradas irrestritamente entre os axônios remanescentes. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
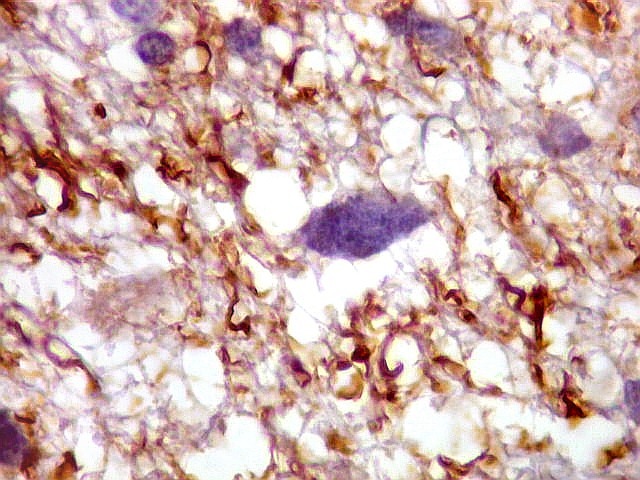 |
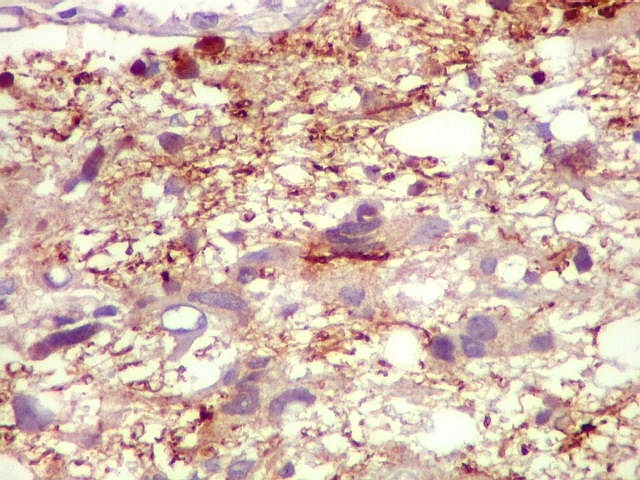
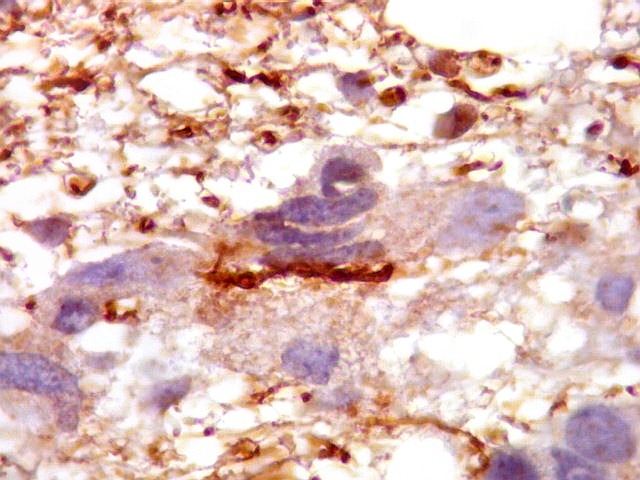
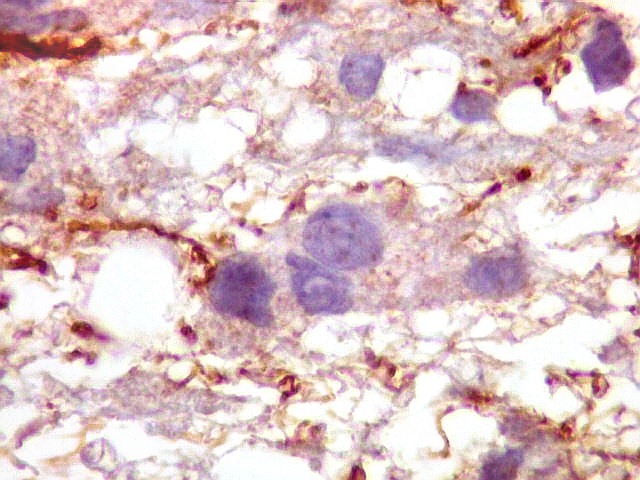
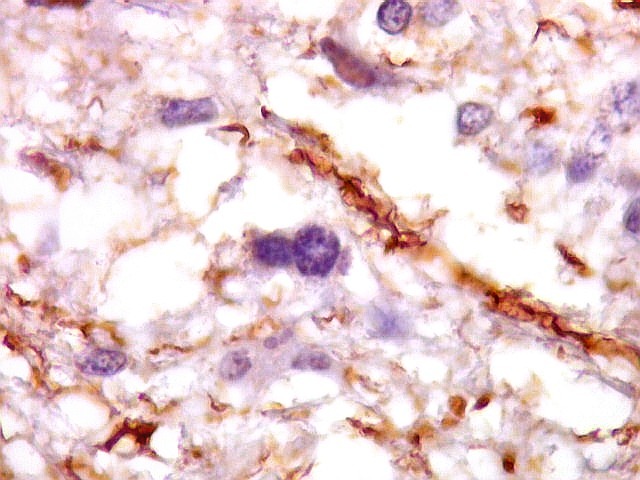
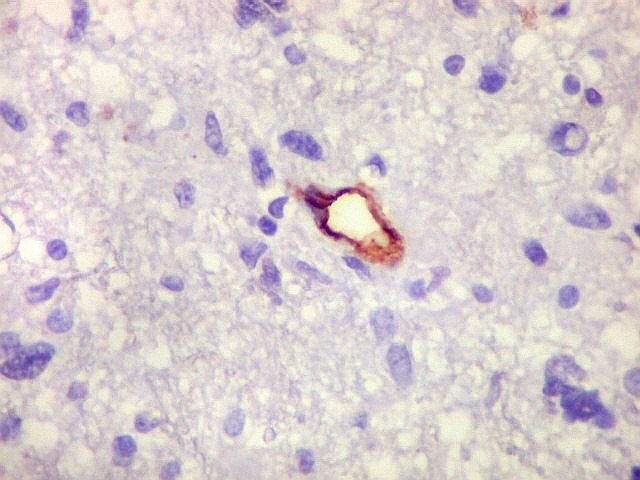
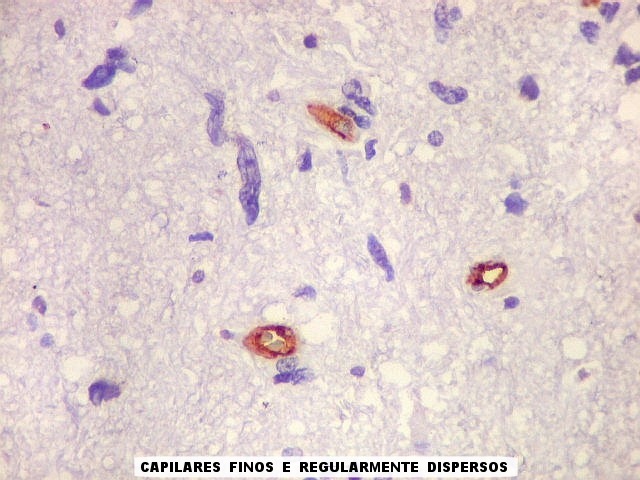
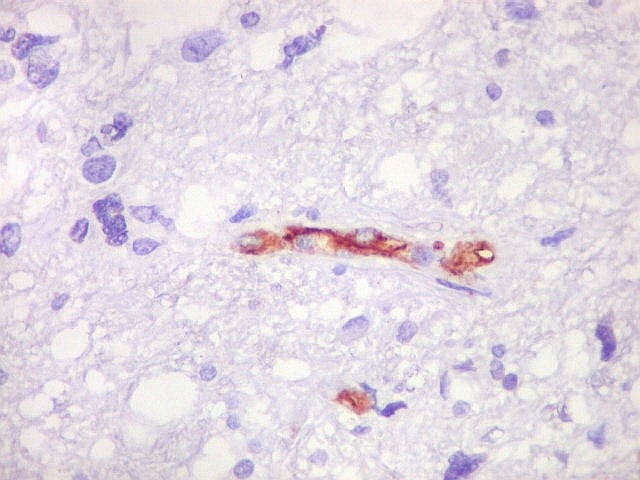
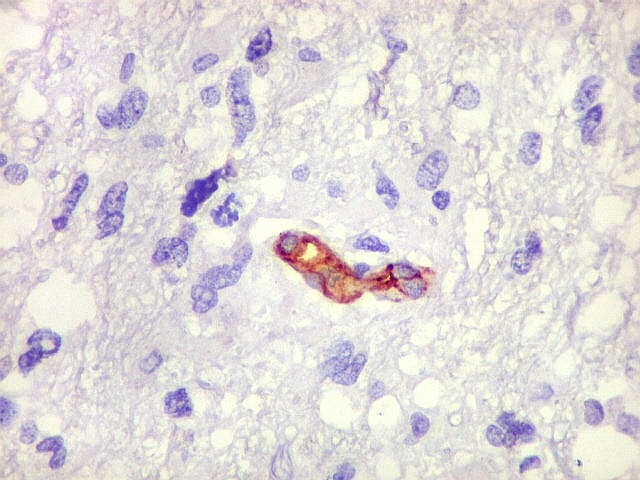
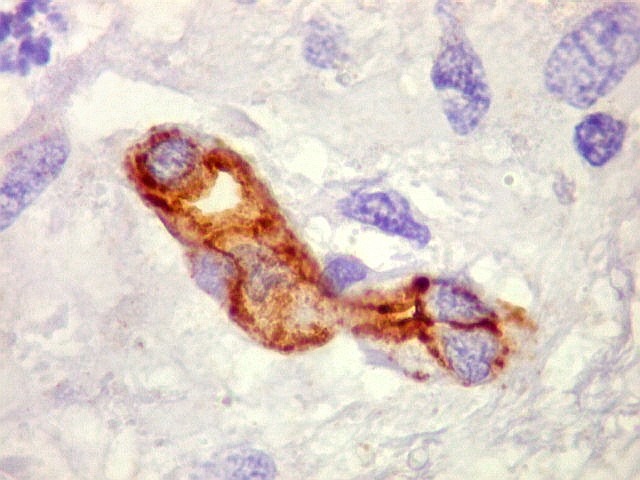
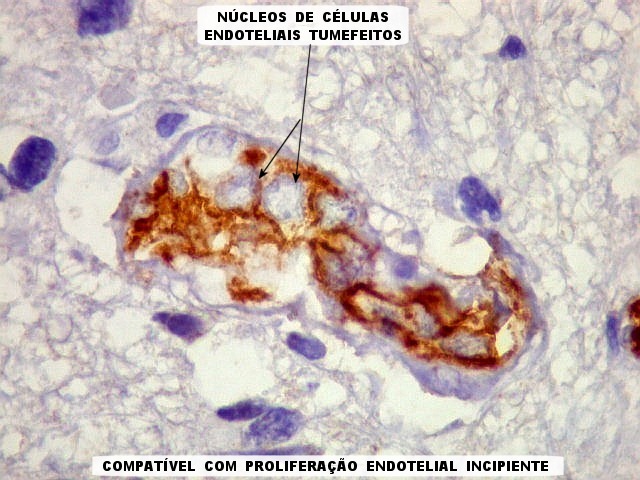
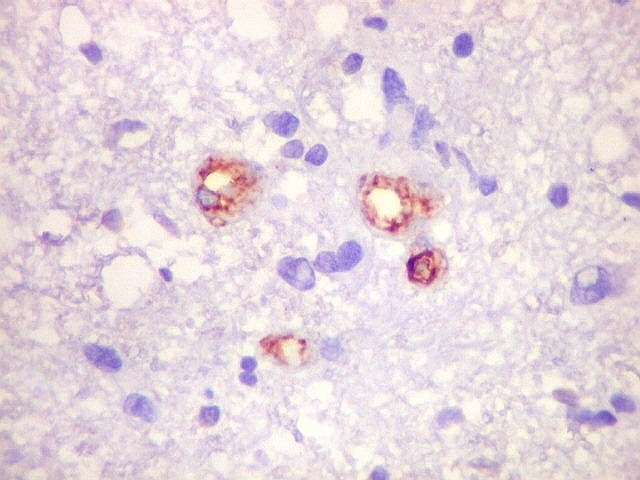
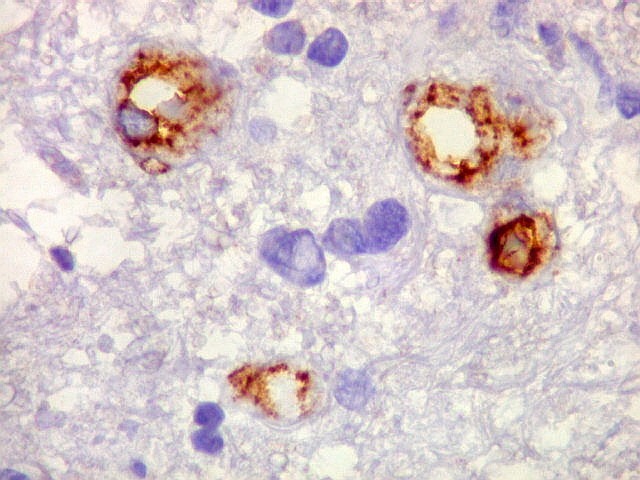
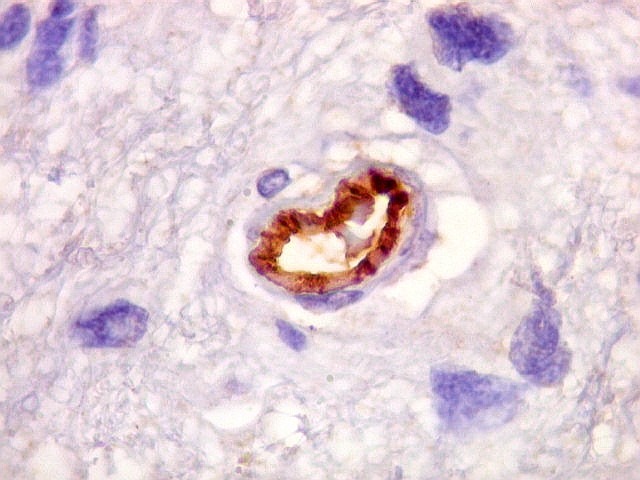
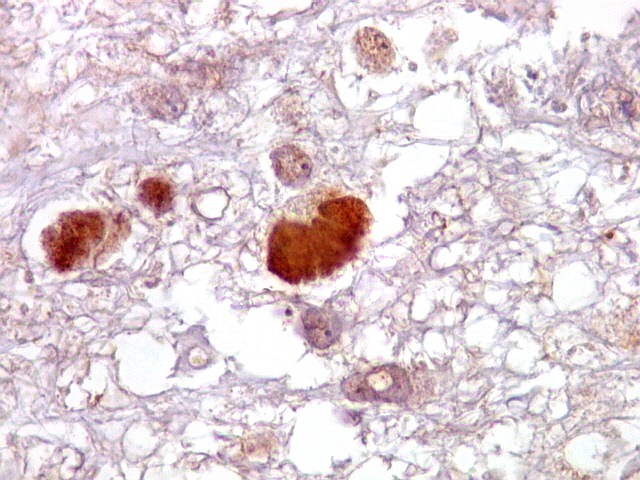
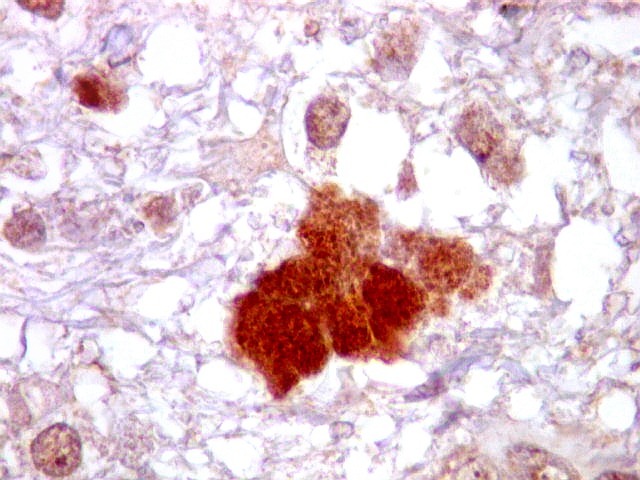
| CD34.
Este anticorpo demonstra com vantagem os capilares. Aqui confirma a impressão no esfregaço e na parafina de que os vasos são finos e regularmente dispersos. Porém, há ocasionais imagens suspeitas de proliferação endotelial incipiente, como já notado em HE. |
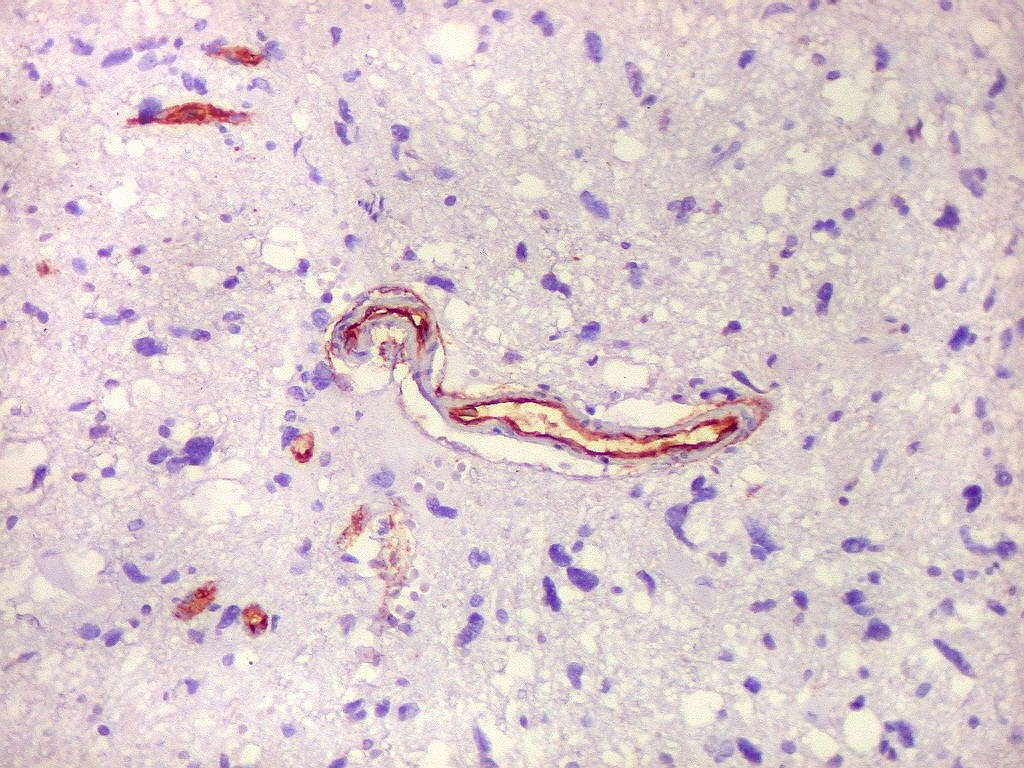 |
| CD34. As células neoplásicas são negativas para este marcador. Para positividade de CD34 em tumores neuroectodérmicos, clique. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
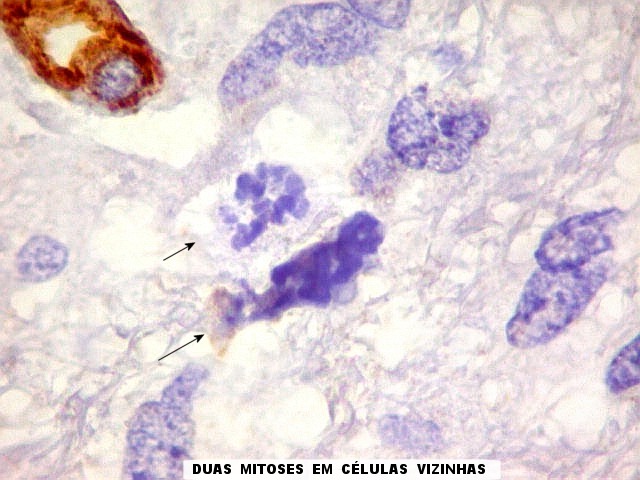 |
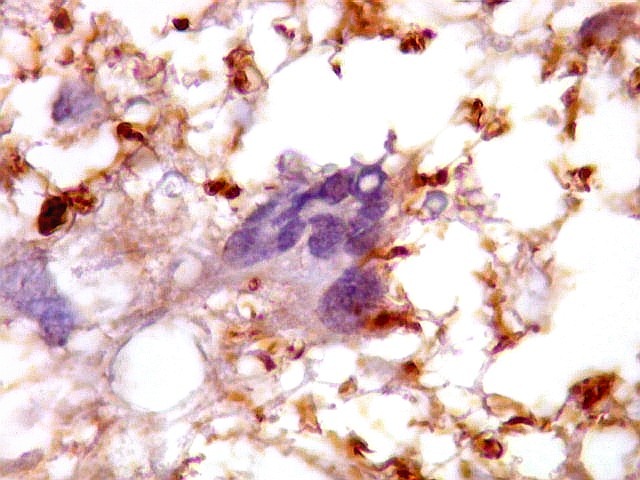
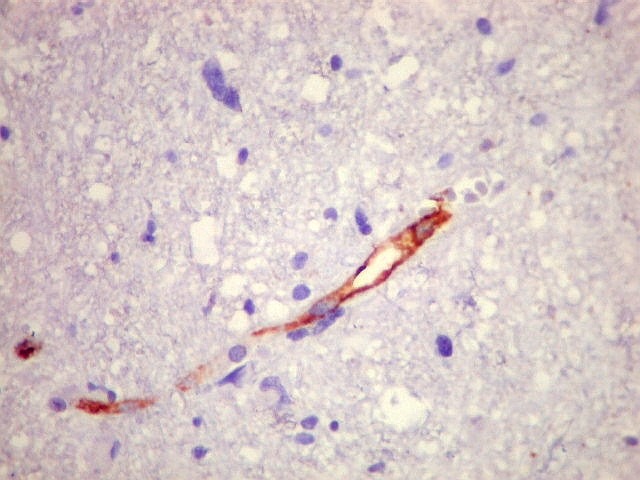
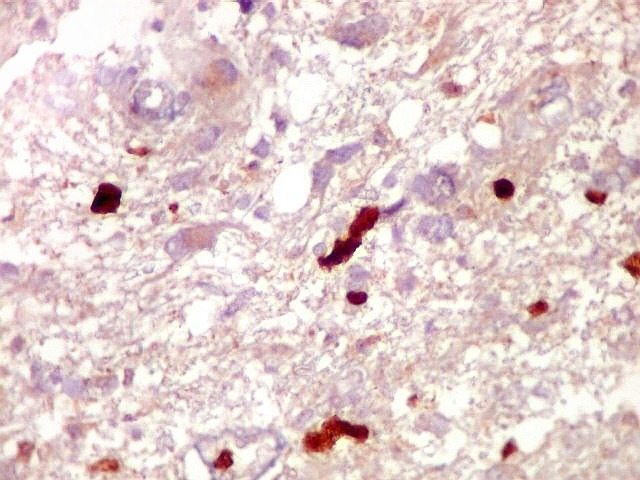
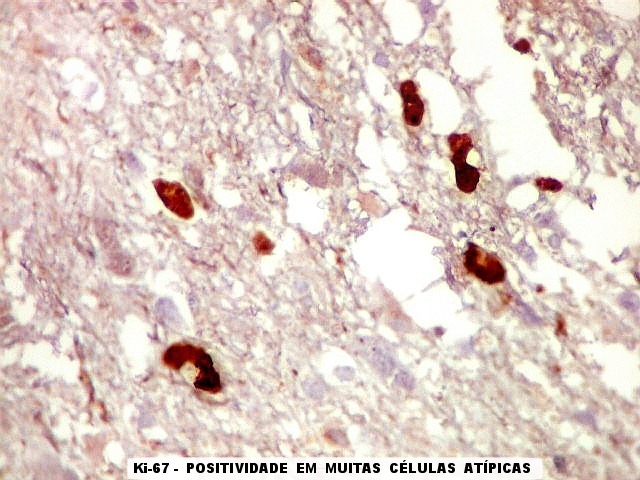
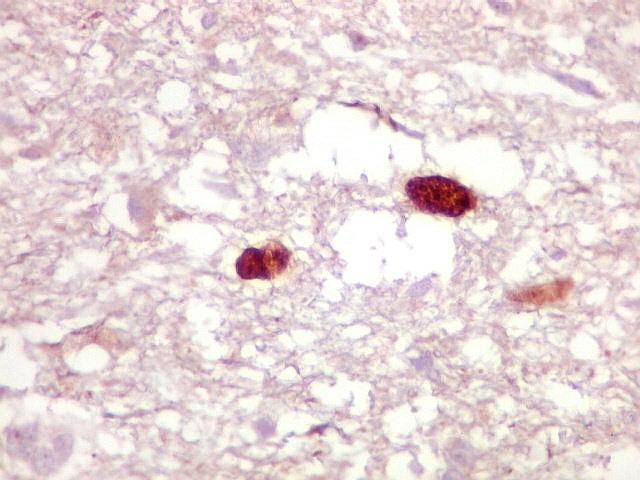
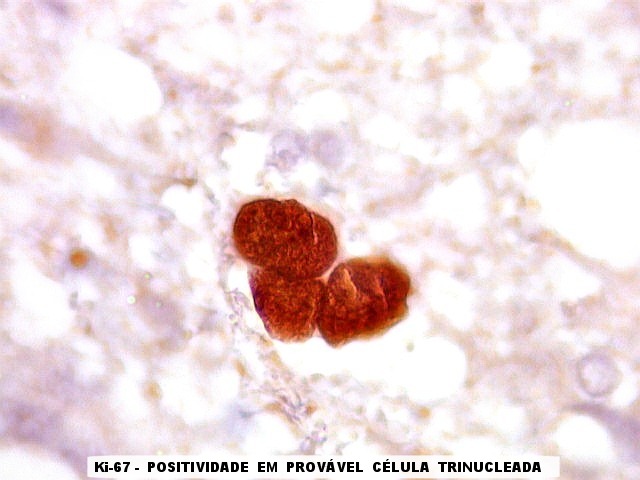
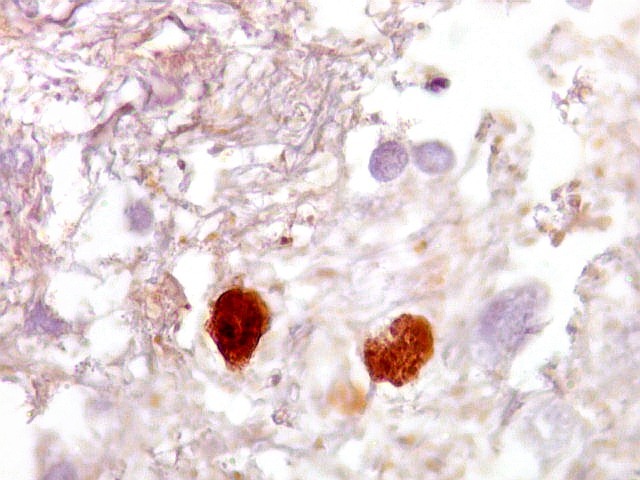
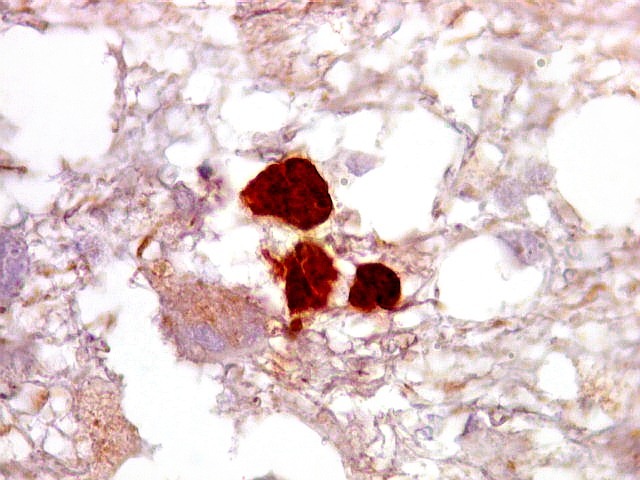
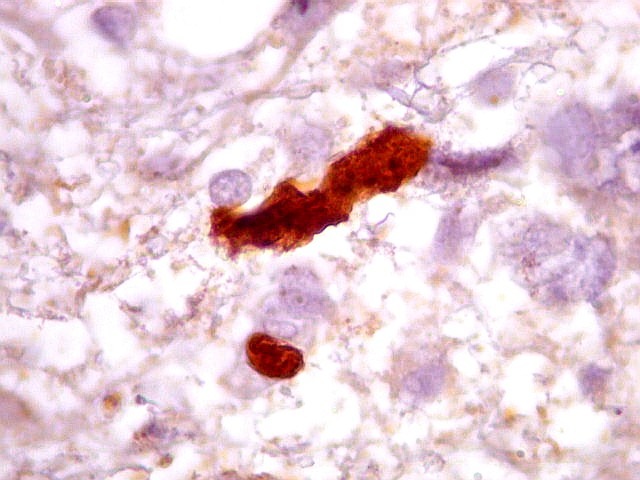
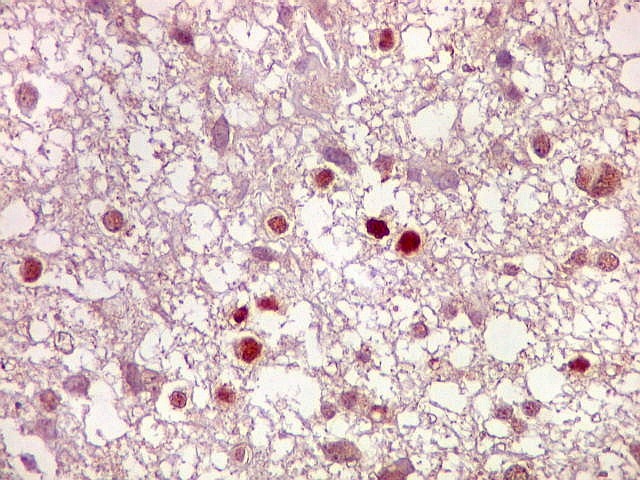
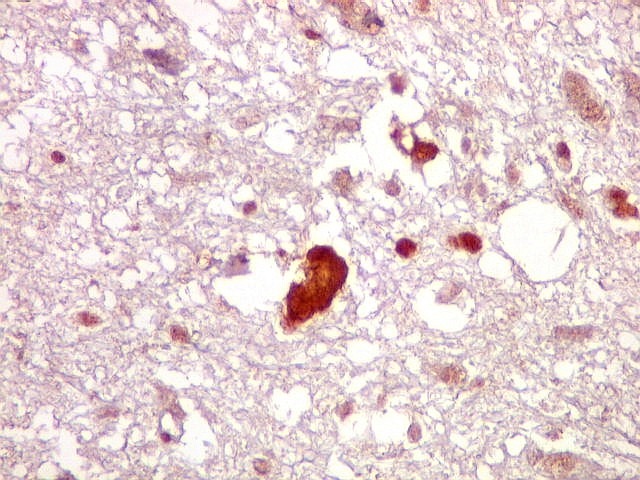
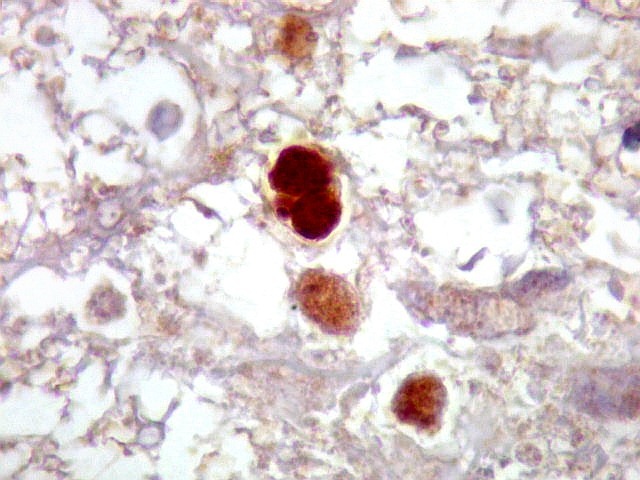
| Ki-67.
Este marcador de células em proliferação foi positivo em numerosas células atípicas, provavelmente na maioria, embora não em todas. Há alguns núcleos claramente anormais não marcados. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
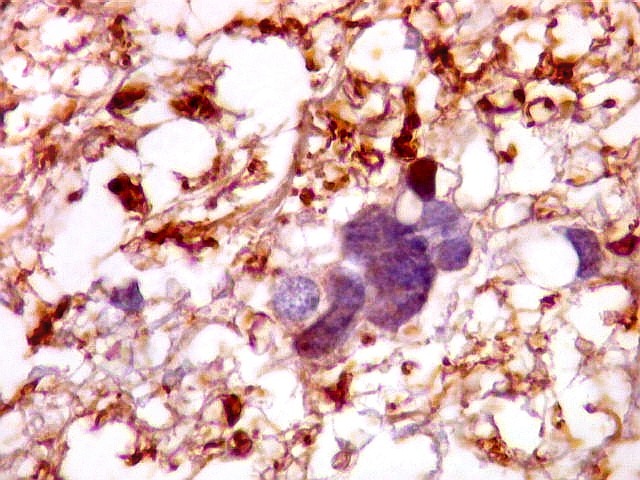
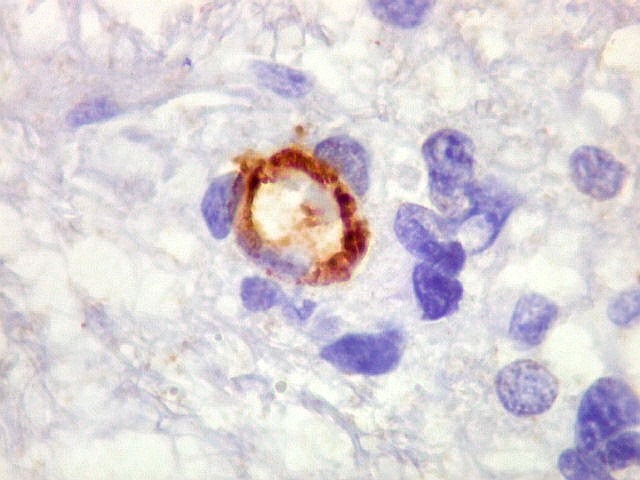
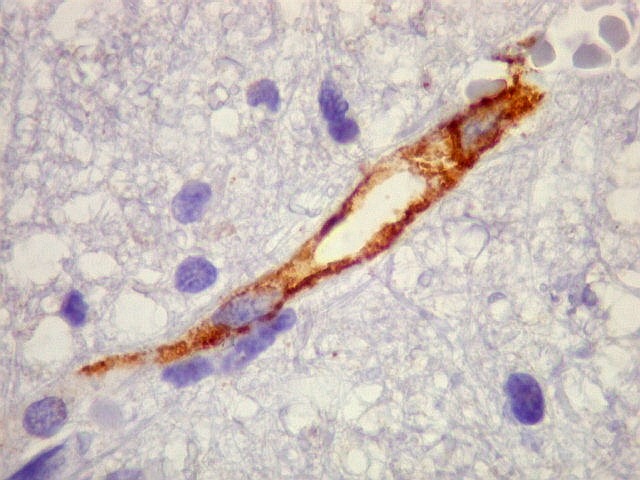
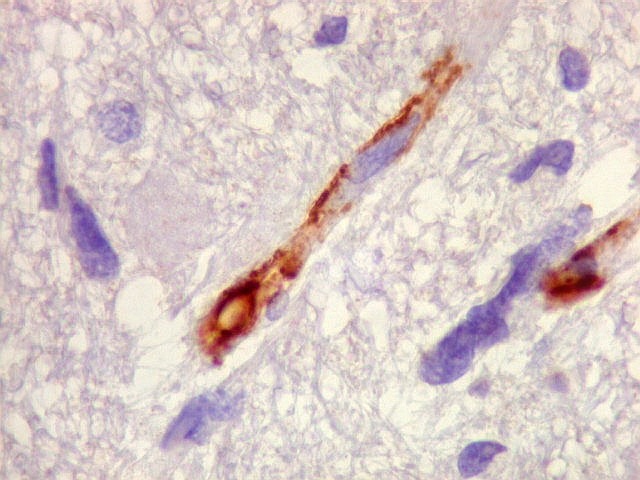
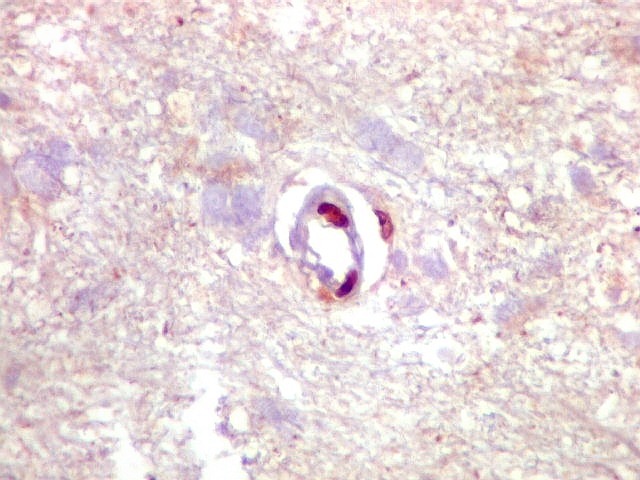
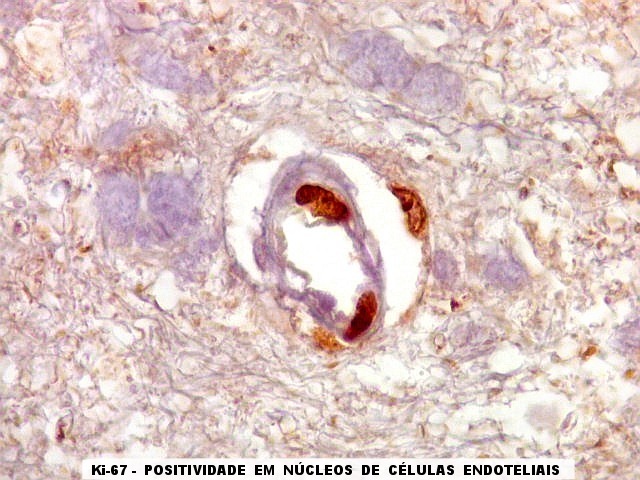
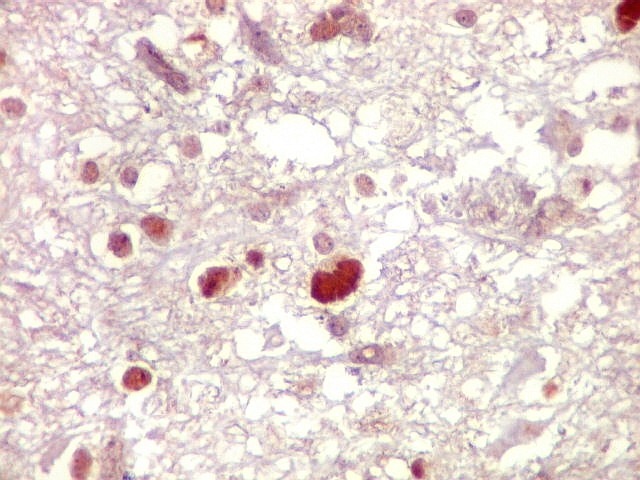
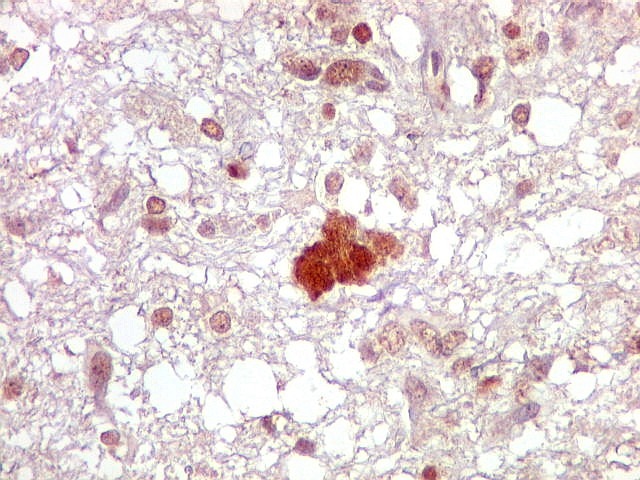
| Ki-67. Vasos. É digno de nota que alguns núcleos de endotélio são positivos, indicando tendência proliferativa também nestas células. Vem em apoio ao já notado em HE e CD34, de que alguns capilares estão iniciando o processo de hiperplasia endotelial próprio dos gliomas de alto grau. Capilares cerebrais normais não expressam Ki-67. | |
 |
 |
 |
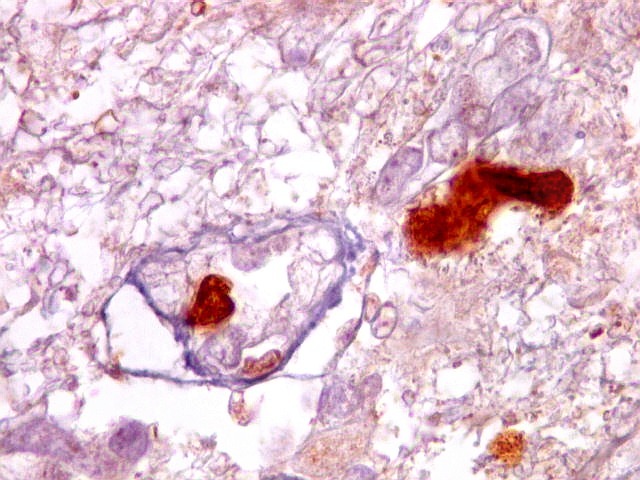 |
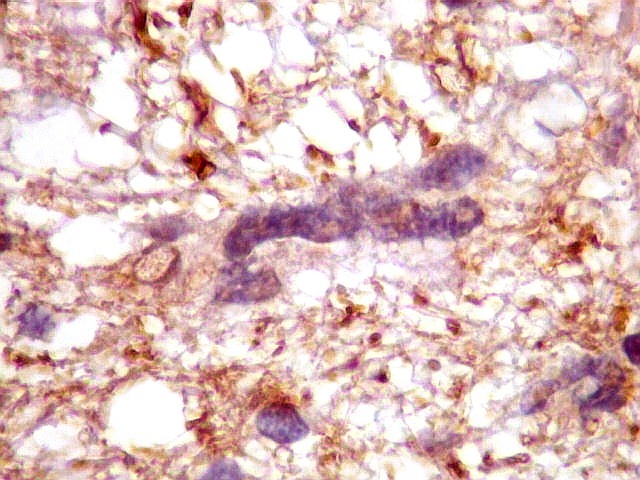
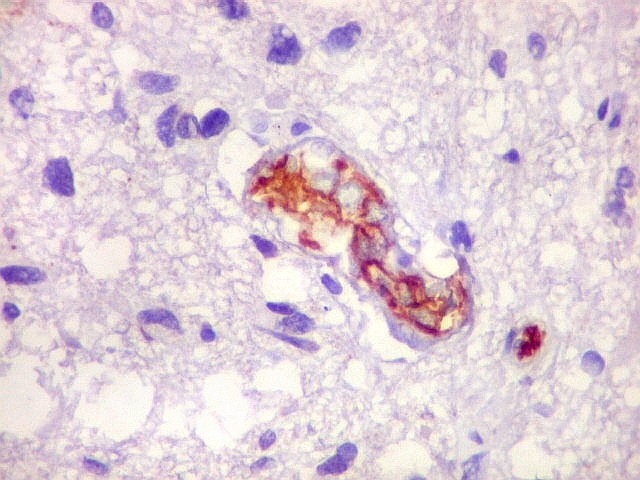
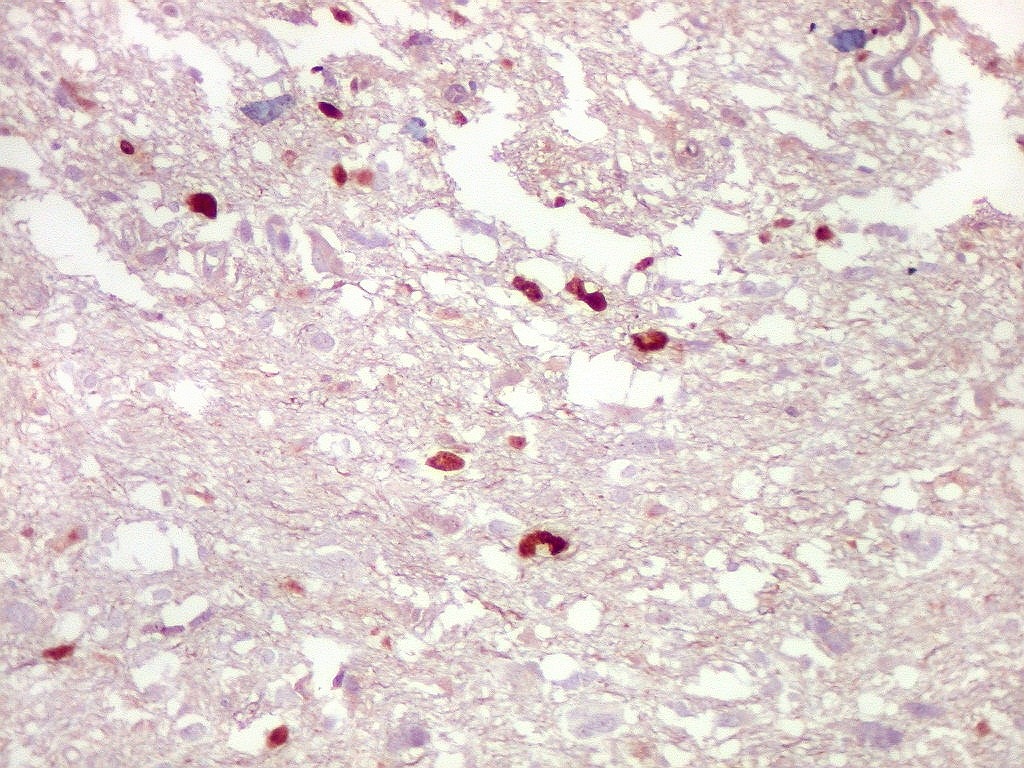
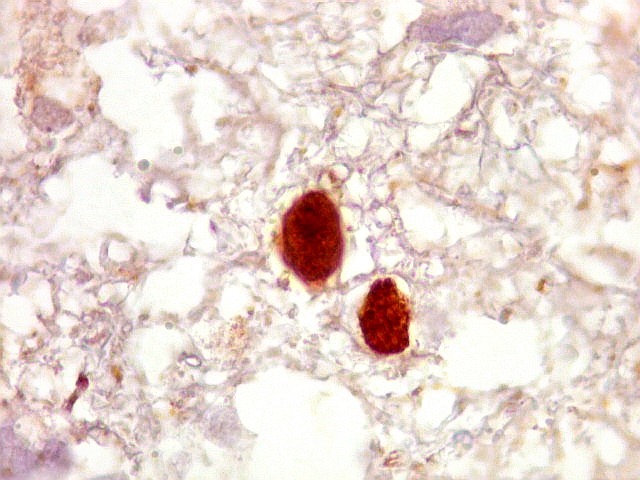
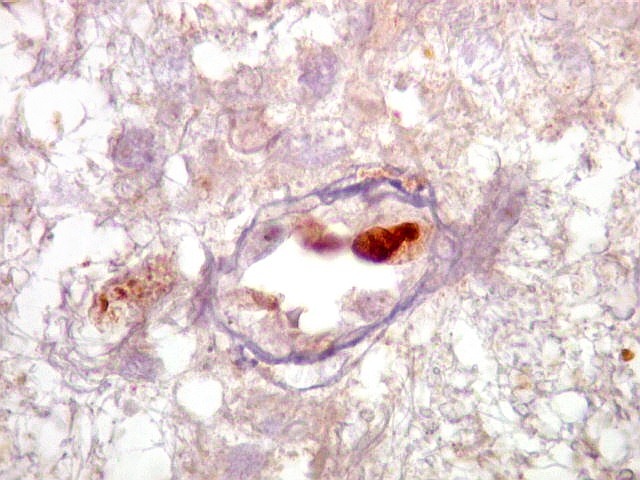
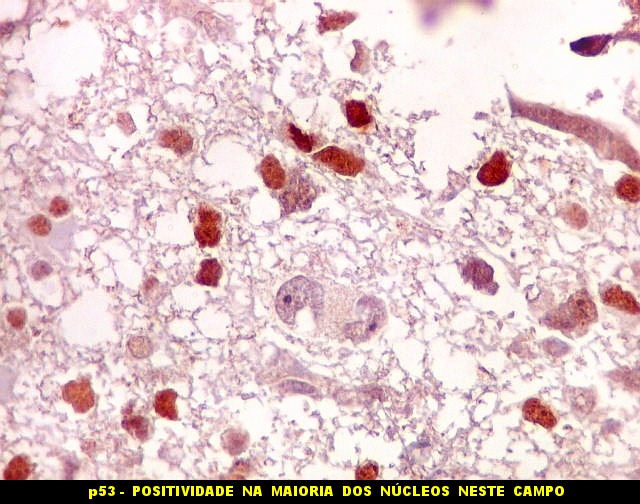
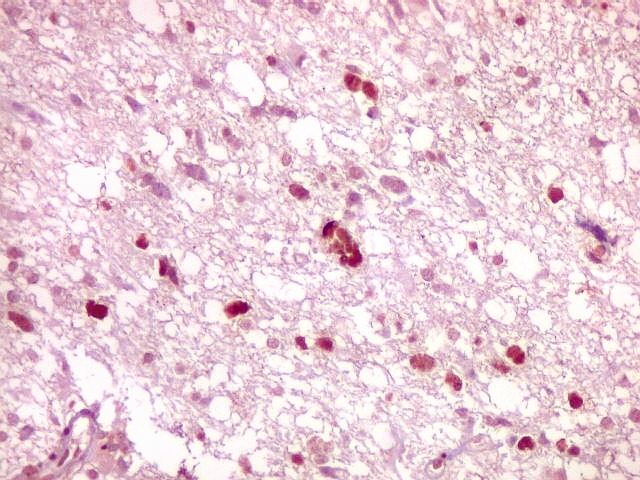
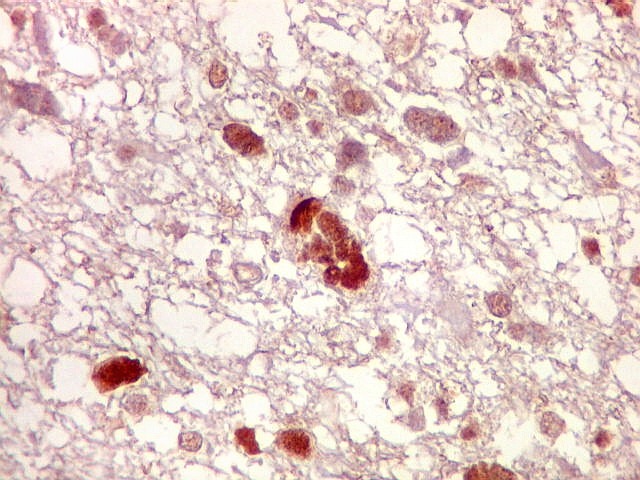
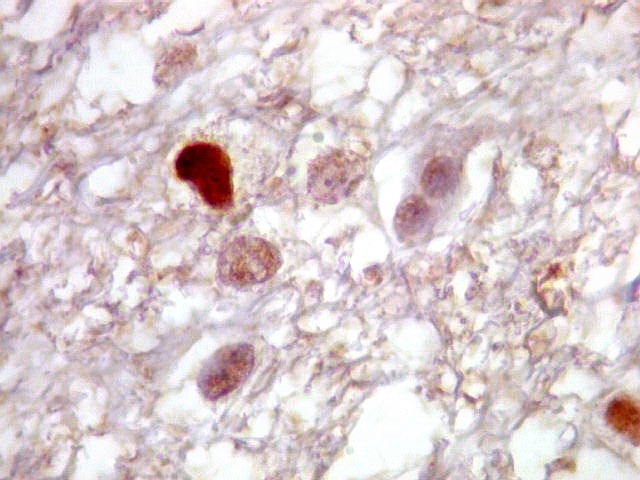
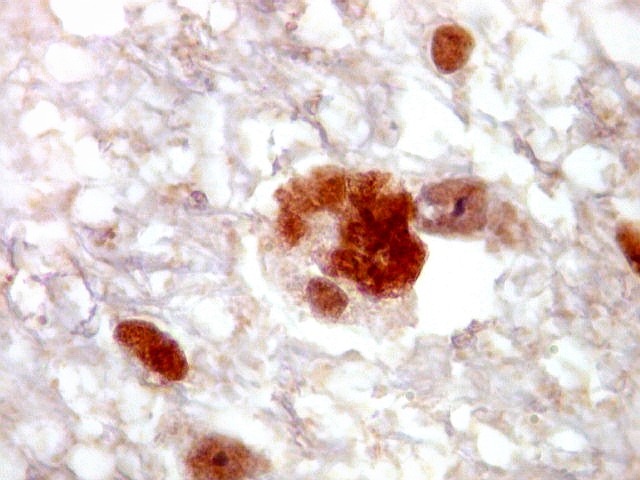
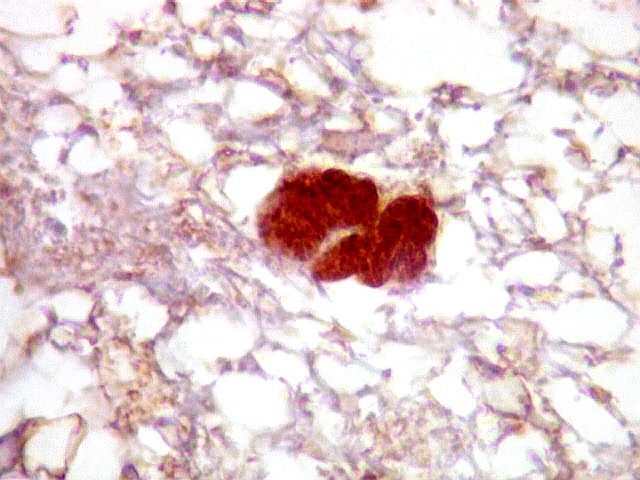
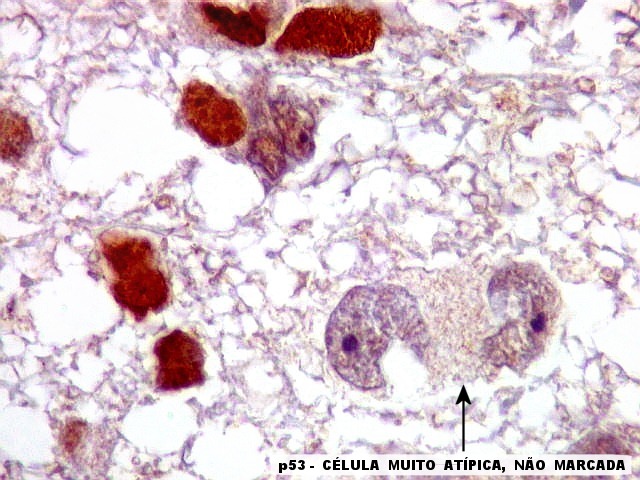
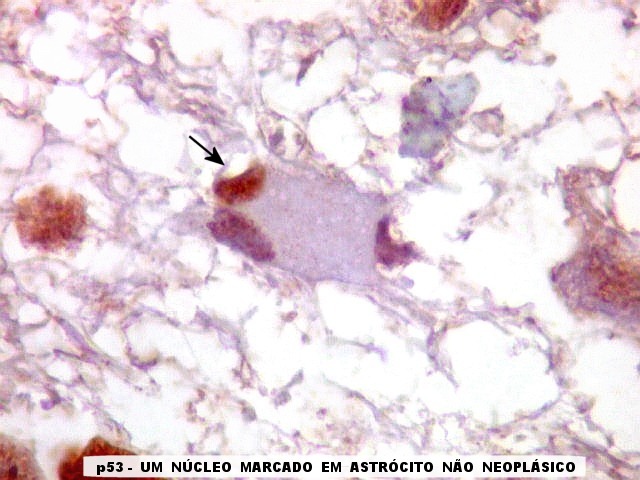
| p53.
Há marcação da maioria dos núcleos das células neoplásicas, e até de alguns núcleos que, por seu tamanho, seriam compatíveis com a normalidade. Há ainda células claramente neoplásicas negativas. A alta proporção de células positivas é fortemente sugestiva de que uma mutação do gene p53 (o 'guardião do genoma') deve ter tido papel importante na gênese do presente tumor. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| Gliomatose
cerebral.
Definição. Glioma difuso, geralmente astrocitoma, com crescimento caracterizado por infiltração excepcionalmente extensa de uma grande região do sistema nervoso central. Envolve pelo menos três lobos cerebrais, geralmente de ambos lados, e, freqüentemente, estruturas cerebrais profundas, tronco cerebral, cerebelo e até a medula espinal. O padrão fenotípico é mais comumente astrocitário, mas pode ser de oligodendroglioma ou oligoastrocitoma. Graduação. Trata-se de tumor agressivo, com comportamento biológico correspondendo ao grau III da OMS na maioria dos casos. Histórico. O termo gliomatose foi cunhado por Nevin em 1938 para denotar envolvimento extenso de grandes áreas cerebrais por células gliais, na ausência de massa neoplásica. Há quem reconheça dois tipos de gliomatose, primária e secundária. A primária é a que se inicia como infiltração difusa, sem evidência de tumor antecedente (gliomatose cerebral clássica). A secundária viria da disseminação de um tumor de baixo grau pré-existente. Incidência. Em uma série de 151 pacientes, a idade variou de recém-nascidos a 83 anos, com pico entre 40 e 50 anos, e ambos sexos igualmente afetados. Localização. As áreas mais acometidas são os hemisférios cerebrais (76%), mesencéfalo (52%), ponte (52%), tálamos (43%), núcleos da base (34%), cerebelo (29%), bulbo (13%), hipotálamo, nervos ópticos, quiasma, e medula espinal (9% cada). Nos hemisférios cerebrais o centro semioval é sempre envolvido, o córtex em 19%, e leptomeninges 17%. Em 77% a lesão é bilateral, com preferência pelo hemisfério direito. Clínica. É altamente variável na dependência dos locais comprometidos. Há alterações no estado mental, demência, letargia, crises convulsivas, cefaléia, sintomas piramidais, distúrbios da marcha, disfunções de nervos cranianos, déficits espinocerebelares, sensitivos, parestesias, distúrbios visuais, e sinais e sintomas da hipertensão intracraniana. Neuroimagem. Em ressonância magnética, há aumento difuso de volume das estruturas envolvidas, sem destruição de tecido ou formação de massa delimitada. Nas seqüências com TR (tempo de repetição) longo (T2 e FLAIR), o hipersinal revela a extensão da lesão melhor que qualquer outro método. FLAIR permite máximo contraste, devido à maior sensibilidade e à supressão do ruído de fundo do líquor dos ventrículos e cisternas. Pode-se usar espectroscopia de prótons para identificar áreas de celularidade mais alta, aumentando as chances de positividade da biópsia estereotáxica. Macro. As áreas afetadas são mais firmes e tumefeitas, com preservação da anatomia macroscópica, mas com borramento dos limites entre substância branca e cinzenta. Micro. Aumento de celularidade, com proliferação de pequenas células gliais fusiformes, com núcleos alongados (podem lembrar micróglia). Pode haver células maiores com núcleos pleomórficos e hipercromáticos, e variações entre áreas do mesmo tumor. Pode haver formas gemistocíticas, ou outras sugestivas de oligodendrócitos. Neurônios e axônios estão geralmente intactos, mas pode haver perda das bainhas de mielina. Atividade mitótica é tipicamente baixa, proliferação vascular e necrose geralmente ausentes na fase inicial. Podem aparecer mais tarde com o evoluir da doença. Imunohistoquímica. Células são geralmente reativas para GFAP, S-100 e vimentina, mas parte ou a maioria podem ser negativas. Ki-67 pode variar de <1 a 30%. Histogênese. Os dados favorecem a monoclonalidade das células gliomatosas, correspondendo a um glioma difuso com excepcional capacidade infiltrativa. Prognóstico. Fatores favoráveis são idade mais jovem, melhor índice de performance de Karnofsky quando do diagnóstico e graus mais baixos na classificação da OMS para gliomas difusos. Fonte.
|
| Preparados imunohistoquímicos nesta página pelo técnica do Laboratório de Pesquisa do Depto de Anatomia Patológica da FCM-UNICAMP, Sra. Ana Cláudia Sparapani Piaza. A ela, nossos sinceros agradecimentos. |
| Para RM desta paciente, clique » | 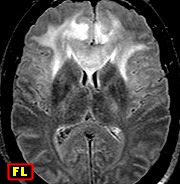 |
| Textos sobre gliomatose
cerebral (1) (2) |
Características de imagem
dos astrocitomas difusos |
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|