| Carcinoma
adenóide cístico
Definição
– tumor invasivo, composto por células basalóides com diferenciação
predominante para células mioepiteliais, acompanhada por algumas
estruturas ductais (epiteliais) esparsas. Termo antigo – cilindroma (indesejável
por se prestar a confusão com o tumor benigno de glândulas
écrinas da pele com o mesmo nome). É o 5º tumor maligno
mais comum de glândulas salivares.
Clínica.
Ocorre mais freqüentemente na 4ª – 6ª décadas, predomínio
no sexo feminino 3:2. Os locais de origem mais comuns são parótidas,
glândulas submandibulares e pálato. Localizações
menos comuns incluem glândulas lacrimais, glândulas mucosas
do trato respiratório superior, pulmões, TGI, pele, mama,
próstata e trato genital feminino inferior. A queixa mais
freqüente é massa de crescimento lento. Há forte tendência
a invasão perineural.
Anatomia Patológica.
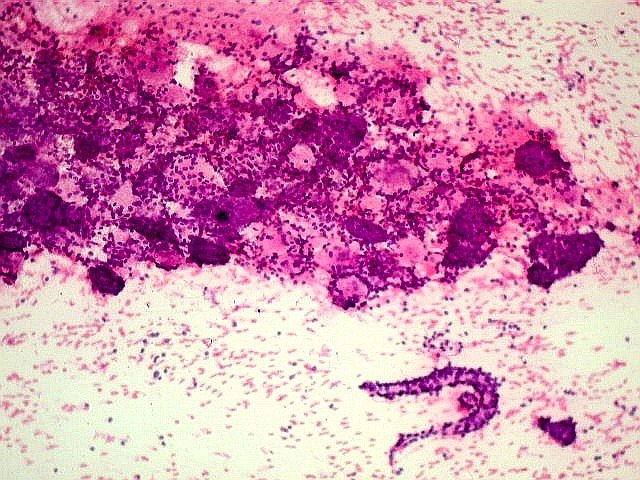
Macroscopicamente o tumor parece bem delimitado, mas isto é enganoso,
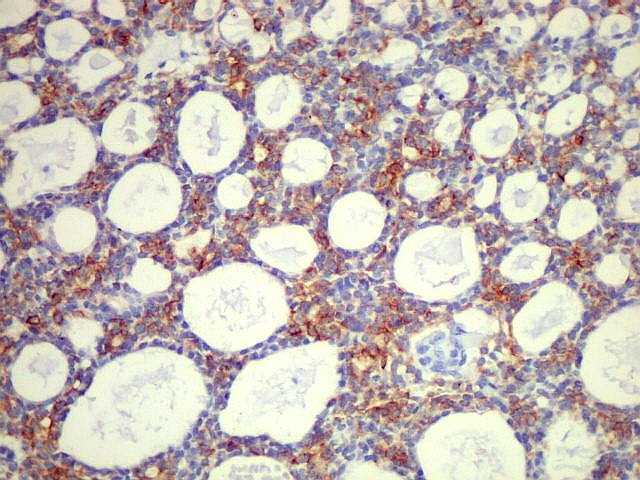
porque há infiltração na microscopia. Histologicamente,
o tumor pode assumir os padrões cribriforme, tubular ou sólido,
em proporções variáveis em cada caso.
O padrão
cribriforme é o mais
típico. As células neoplásicas basalóides constituem
a maior parte da população e mostram diferenciação
predominante para células mioepiteliais (abluminais). O núcleo
é escuro, arredondado, com pouco pleomorfismo, e o citoplasma é
escasso, com limites mal definidos. Em meio às células basalóides
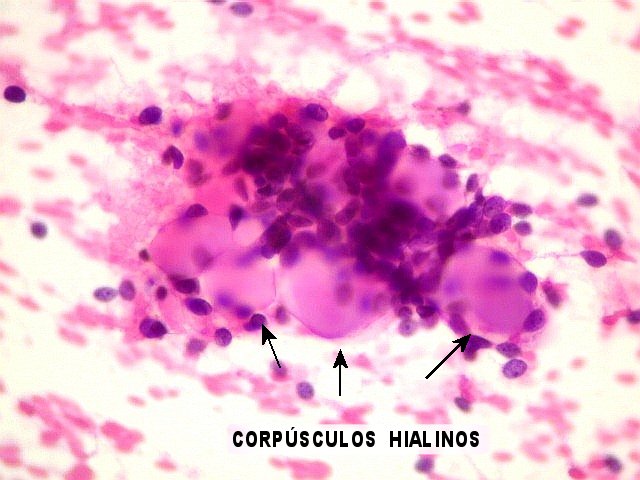
observam-se espaços arredondados bem delimitados, dando aspecto
em queijo suíço ou rendilhado. A maioria destes espaços
císticos não são luzes glandulares, mas representam
invaginações do estroma (pseudocistos) contendo material
hialino ou mixóide. O material hialino (eosinófilo) é
PAS + e diastase-resistente, e em microscopia eletrônica corresponde
a produção excessiva de membrana basal. O material
mixóide é basófilo, do tipo substância fundamental
(positivo para Alcian blue) e é constituído por glicosaminoglicans,
principalmente condroitin sulfato e heparan sulfato. Em meio às
células basalóides, há também luzes glandulares
verdadeiras, forradas por células cubóides baixas do tipo
epitelial. Estas luzes são muito menores que os espaços císticos
preenchidos por material estromal e circundados por células do tipo
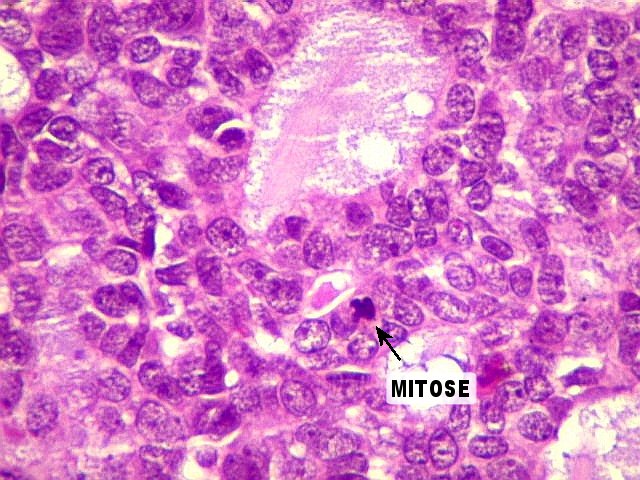
mioepitelial. No padrão cribriforme, figuras de mitose são
escassas ou ausentes.
No padrão
tubular, há túbulos
forrados por camada única de células epiteliais ou por uma
ou mais camadas de células basalóides. Aqui também
há poucas mitoses ou áreas de necrose.
No padrão
sólido há maior
incidência de atipias nucleares, figuras de mitose e áreas
de necrose, representando um tumor mais agressivo.
Invasão
perineural é uma importante característica do carcinoma adenóide
cístico, embora não patognomônica.
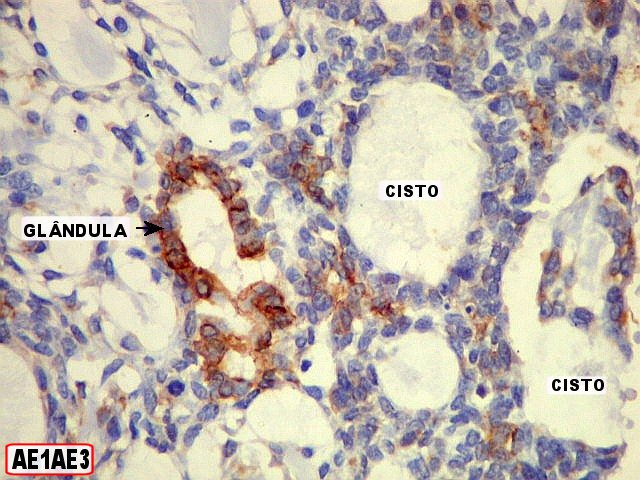
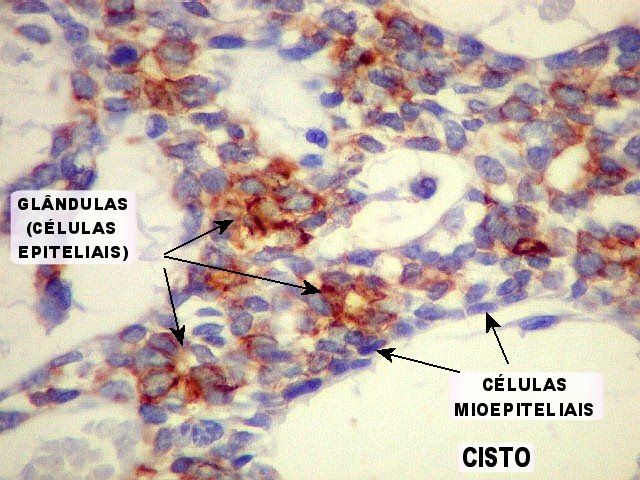
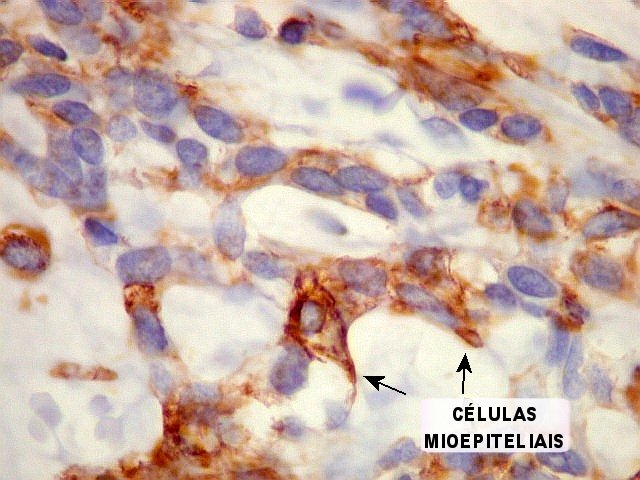
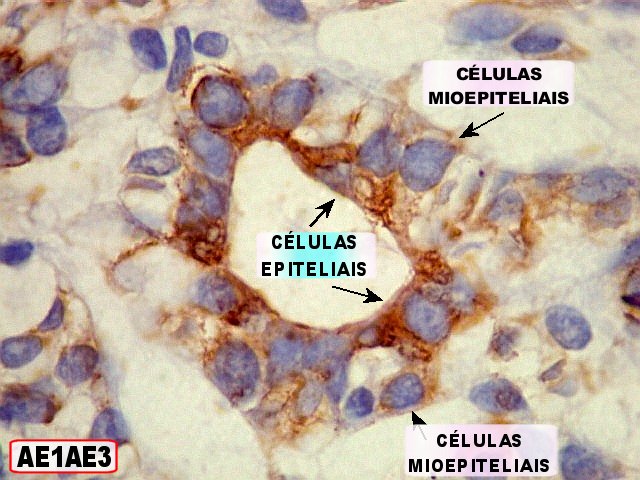
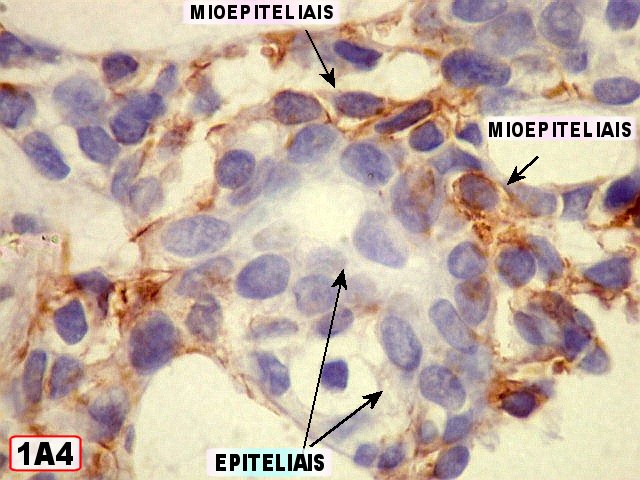
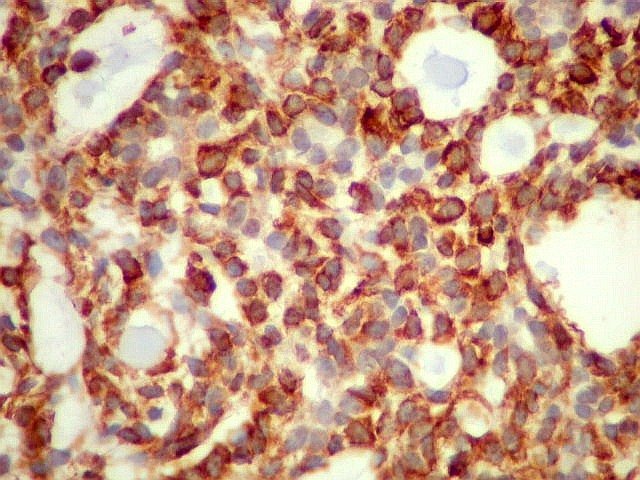
Imunohistoquímica
– confirma o predomínio da diferenciação mioepitelial
das células basalóides, que expressam actina de forma variável
(1A4, HHF-35), vimentina e proteína S-100 (focal). A maioria das
células que circundam os lumes cribriformes expressam padrão
mioepitelial. As células ductais epiteliais expressam queratina
(AE1AE3, CK7), CEA e EMA, mas não actina, vimentina ou S-100. O
material hialino do estroma pode ser demonstrado com anticorpos para colágeno
tipo IV e laminina.
Prognóstico.
Embora o comportamento do tumor seja geralmente indolente, o prognóstico
a longo prazo é mau, com múltiplas recidivas e metástases,
mesmo para os tumores considerados de grau histológico baixo. A
maioria dos pacientes morre devido ao tumor. Sobrevida de 5 anos é
60-75% e de 10 anos 30-40%. Metástases distantes a pulmões
ou ossos são mais comuns que metástases regionais a linfonodos.
O prognóstico é influenciado pelo grau histológico
que, por sua vez, correlaciona-se à proporção entre
os tipos histológicos. Os padrões cribriforme e tubular representam
graus mais baixos. O padrão sólido se associa a tumores maiores,
recidiva mais freqüente e precoce e maior número de metástases.
Este padrão parece originar-se dos outros dois por acúmulo
de mutações nos genes p53 e Rb. Carcinomas com maior proporção
de áreas sólidas (>30%) têm sobrevida de 5 anos de
apenas 14%, em comparação com 92% para tumores sem componente
sólido significativo.
Outros fatores
negativos são tumores grandes (>2-4 cm), estágio clínico
avançado, localização em glândulas menores,
margens comprometidas, invasão óssea e alto índice
de marcação por Ki-67.
Fontes
-
Cheuk W, Chan
JKC: Salivary gland tumors. in Fletcher CDM (ed) Diagnostic
Histopathology of Tumors. 2nd Ed. Churchill-Livingstone, London,
2000.
-
Ellis GL, Auclair
PL: Tumors of the Salivary Glands. AFIP Atlas of Tumor Pathology. 3rd Series,
Fascicle 17. Armed Forces Institute of Pathology, Washington, DC,
1996.
|