| Glioma
cordóide do terceiro ventrículo
Definição.
Tumor glial raro, não invasivo e de crescimento lento, situado no
IIIº ventrículo de adultos, constituído por células
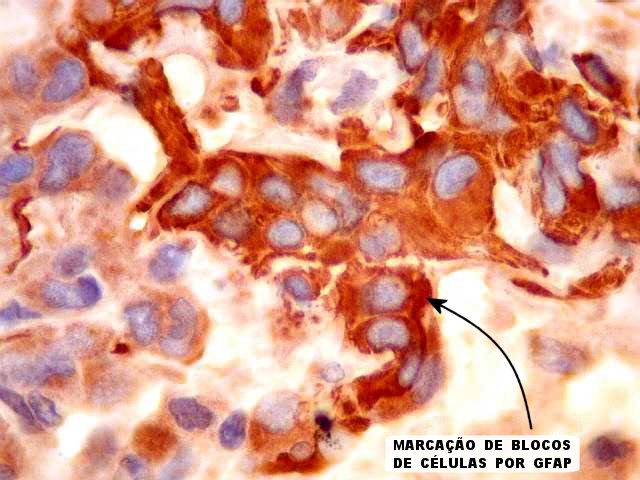
epitelióides que expressam GFAP, em meio a um estroma mucinoso que
contém focos de infiltrado linfoplasmocitário. Grau histológico
OMS II. Separado como entidade em 1998, com base numa série
de 8 casos, por Brat et al. Já foram descritos cerca de 45 casos.
Incidência.
Em adultos, predominantemente entre os 35 e 60 anos, com predomínio
2:1 no sexo feminino. Há só um caso na idade pediátrica
(12 anos).
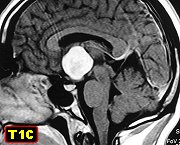
Localização.
Tumores da linha média, situados na porção anterior
do IIIº ventrículo. Tumores maiores podem preencher todo o
IIIº ventrículo. A origem parece ser na região da lamina
terminalis (assoalho do IIIº ventrículo próximo
ao quiasma óptico).
Clínica.
Sinais de hidrocefalia obstrutiva, como cefaléia, náuseas,
ataxia. Pode haver disfunção endócrina ou distúrbios
visuais.
Neuroimagem.
Lesão arredondada, bem circunscrita, de 2 - 4 cm, sólida,
homogênea, com impregnação difusa por contraste.
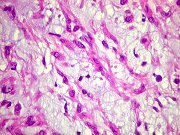
Microscopia.
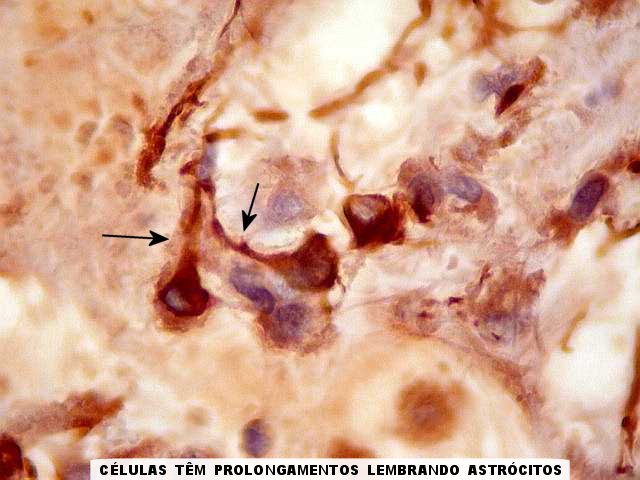
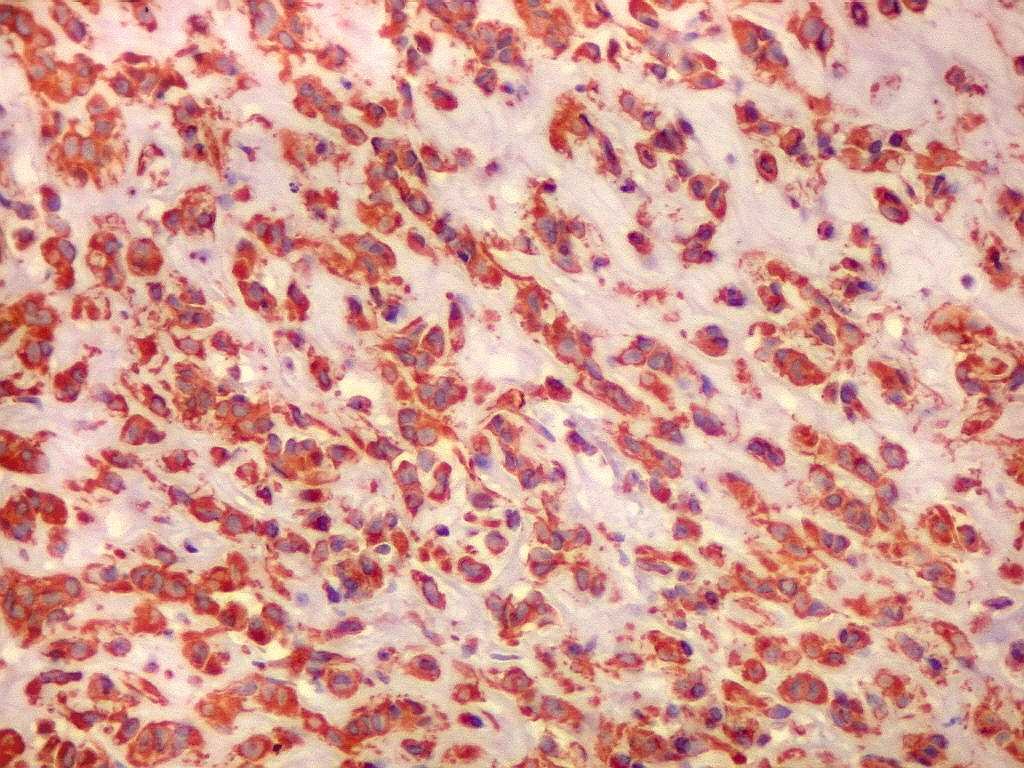
As células tumorais, de derivação glial, são
tipicamente epitelióides, com citoplasma róseo abundante
de limites nítidos. Têm contorno poligonal ou arredondado
e podem formar prolongamentos. Os núcleos são relativamente
uniformes, com poucas atipias. Não se observam mitoses, áreas
de necrose ou proliferação vascular. As células
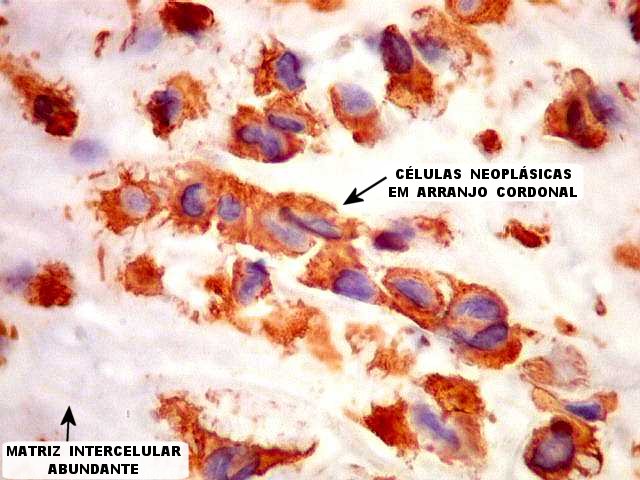
dispõem-se em arranjo sólido, ou formam agrupamentos ou cordões
em meio a estroma mucinoso levemente basófilo e de variável
quantidade. Consistentemente, observa-se infiltrado inflamatório
crônico linfoplasmocitário focal, com freqüentes corpos
de Russell. O tumor não tende a infiltrar estruturas vizinhas.
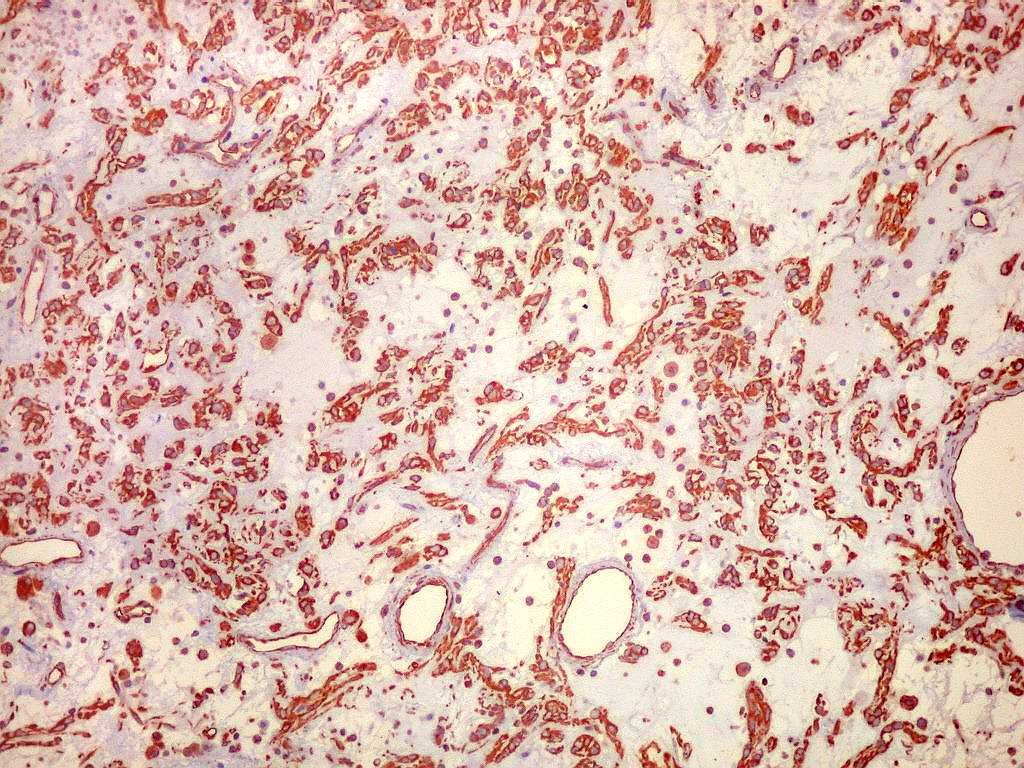
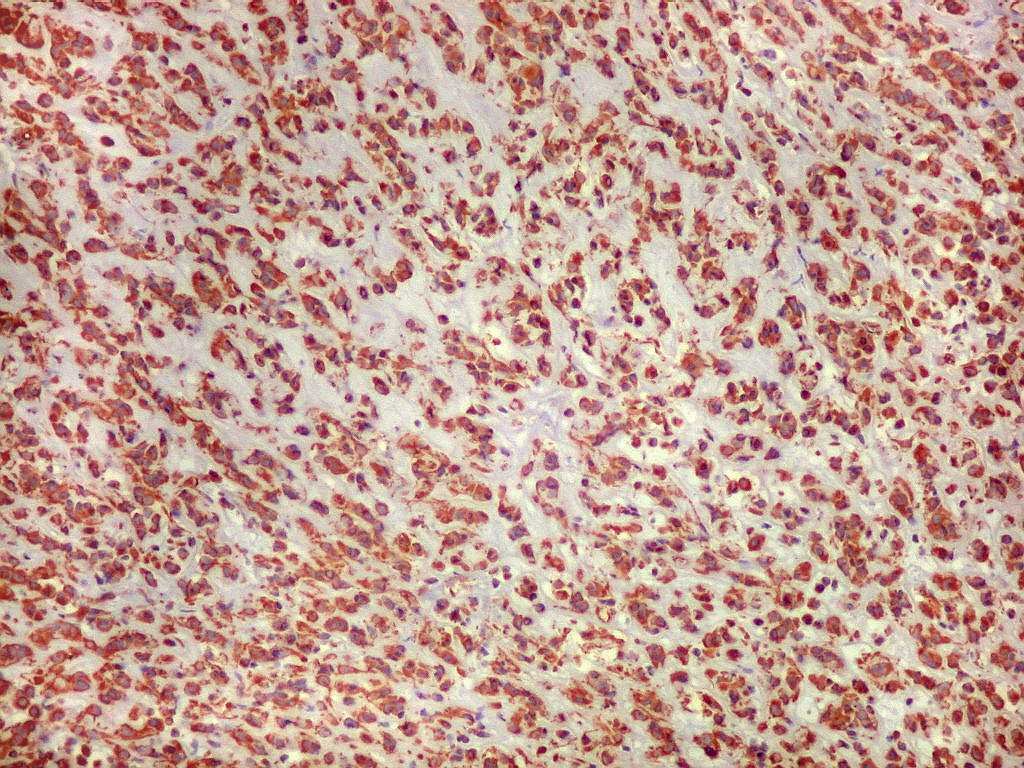
Imunoistoquímica.
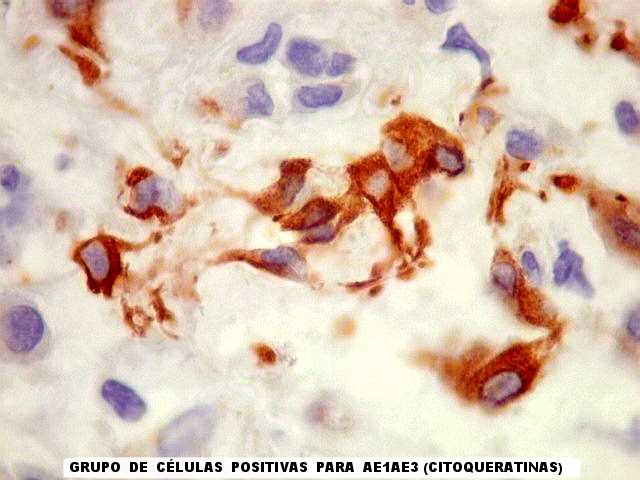
As células neoplásicas são forte e difusamente reativas
para GFAP e vimentina. S-100 dá
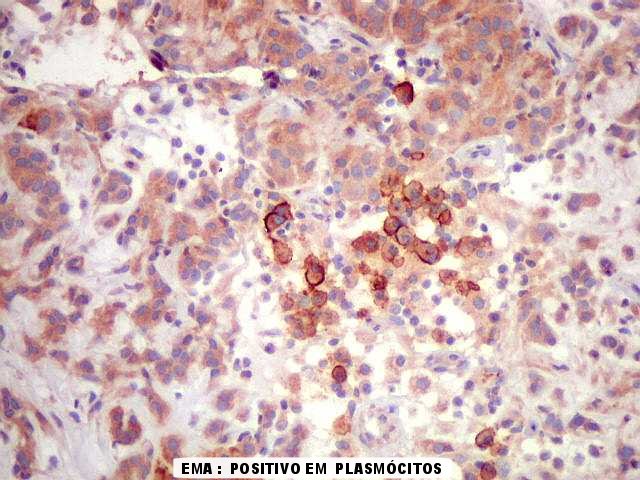
positividade variável. EMA pode ser positivo
focalmente, mas é mais forte nos plasmócitos do infiltrado
estromal. Ki-67 (Mib-1) varia entre 0 e 1,5%.
Ultraestrutura.
Pode mostrar microvilos apicais, lumens intracelulares e hemidesmossomos,
que são próprios de ependimomas.
Apóia a origem do tumor em epêndima, possivelmente do órgão
subcomissural ou da lamina terminalis.
Diagnóstico diferencial.
Prognóstico.
Histologicamente, o tumor é de baixo grau. O principal problema
é o sítio desfavorável à remoção
cirúrgica completa, e adesão a estruturas hipotalâmicas.
Em metade dos casos o tumor volta a crescer após remoção
incompleta. Cerca de 20% dos pacientes morrem após a cirurgia, ou
de recidiva tumoral. A principal morbidade associada à ressecção
é disfunção hipotalâmica.
Fontes:
Brat DJ,
Scheithauer BW, Staugaitis SM, Cortez SC, Brecher K, Burger PC – Third
ventricle chordoid glioma: a distinct clinico-pathological entity.
J Neuropathol Exp Neurol 57: 283-90, 1998.
Brat DJ,
Scheithauer BW. Chordoid glioma of the third ventricle. In
WHO Classification of Tumours of the Central Nervous System. 4th Ed.
Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, editors. International
Agency for Research on Cancer, Lyon, 2007. pp 90-1.
Burger,
PC, Scheithauer BW, Vogel FS. Surgical Pathology of the Nervous System
and its Coverings. 4th Ed. Churchill Livingstone, New York, 2002.
p. 256-8. |