|
|
3. Imunohistoquímica para antígenos neuronais, CD34, Ki-67 |
|
|
|
3. Imunohistoquímica para antígenos neuronais, CD34, Ki-67 |
|
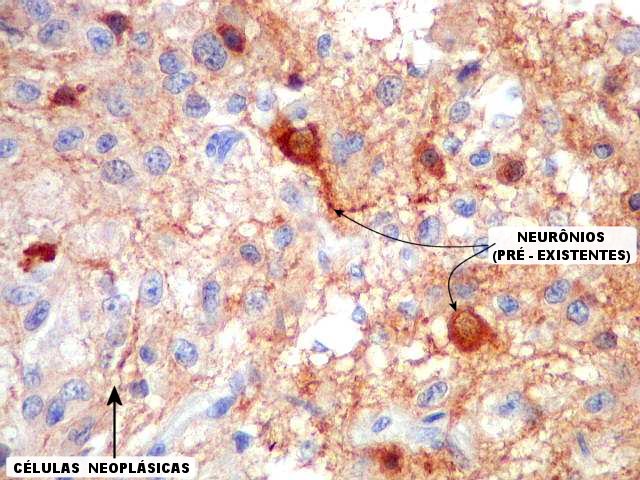
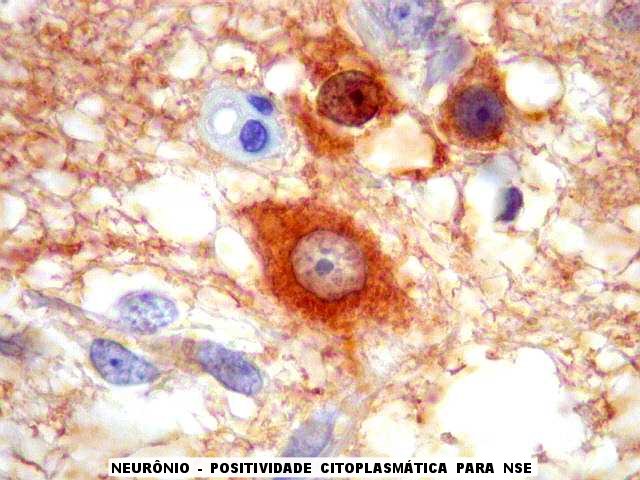
| NSE. Este antígeno (neuron specific enolase), embora de baixa especificidade, é útil para destacar neurônios contra outros elementos do tecido. O tecido neoplásico em si é negativo, exceto em algumas áreas (última fileira de fotos). Os neurônios são normais e provavelmente pertencem a núcleos cerebrais profundos, como o tálamo, a julgar pela morfologia, já que são células multipolares. Não são neurônios corticais, onde a forma é piramidal. |
| Interface tumor - tecido nervoso. Embora a neoplasia seja bem delimitada, há uma estreita margem onde infiltra o tecido nervoso adjacente. Isto é demonstrado pela presença de neurônios (aqui marcados por NSE) em meio às células neoplasicas. Aspecto semelhante é observado com NF (neurofilamento) e SNF (sinaptofisina) nos quadros abaixo. | |
 |
|
 |
|
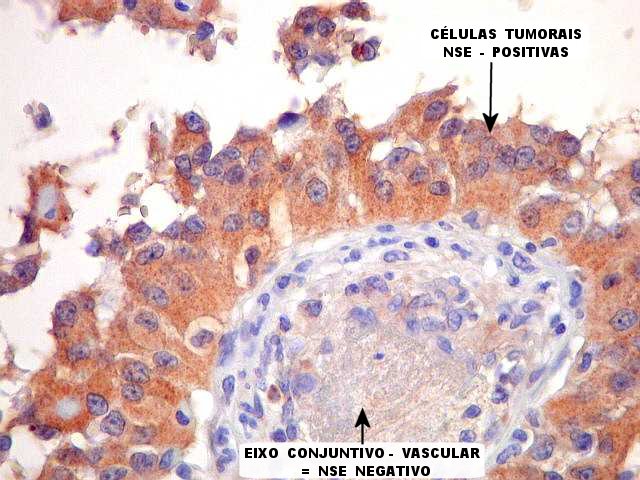
| Nesta área, as células neoplásicas foram positivas para NSE no citoplasma. Comparar com a negatividade do eixo conjuntivo-vascular. | |
 |
|
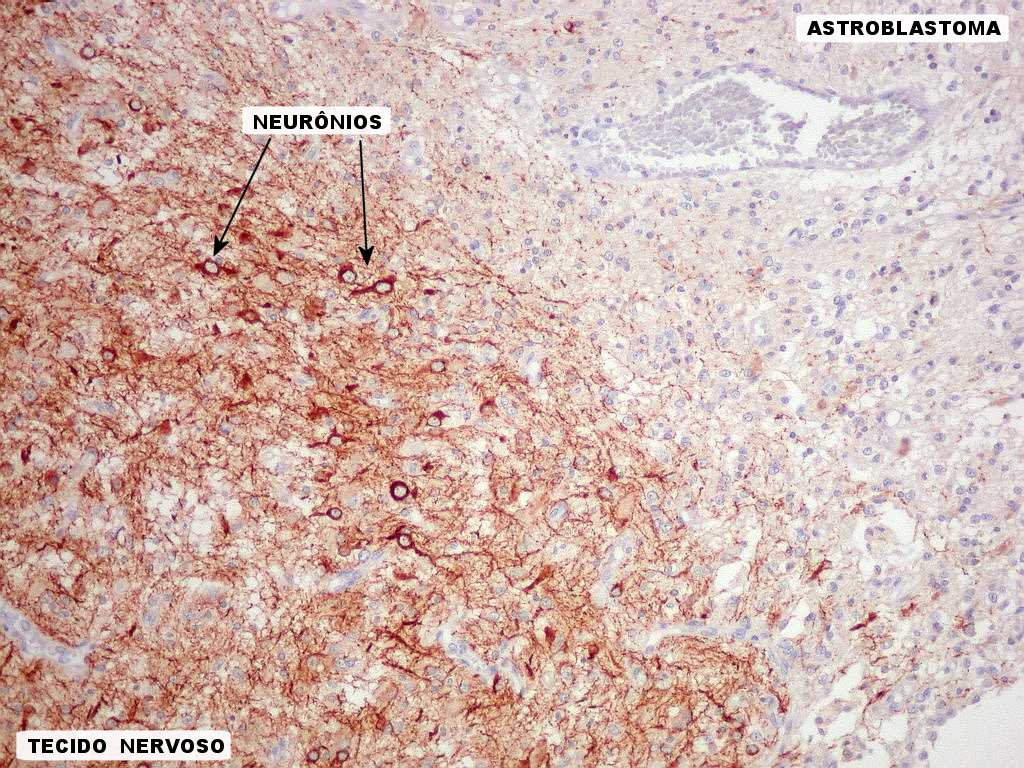
| NF. Interface tumor - tecido nervoso. NF (proteína de neurofilamento) é um marcador para neurônios mais específico e menos sensível que NSE. Marca corpos celulares e axônios. Aqui, novamente, vemos que a interface entre o tumor (negativo) e o tecido nervoso (positivo, à E nas fotos), é nítida e a infiltração neoplasica é estreita ou inexistente. |
 |
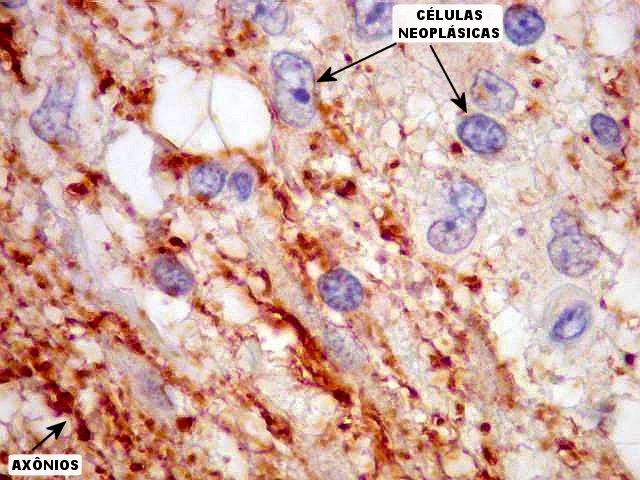 |
| NF. Neurônios. Neurônios multipolares normais nas proximidades do tumor são elegantemente demonstrados por NF. |
 |
 |
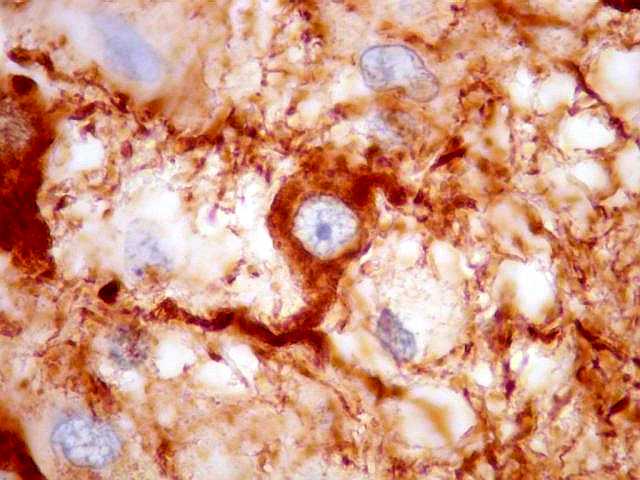 |
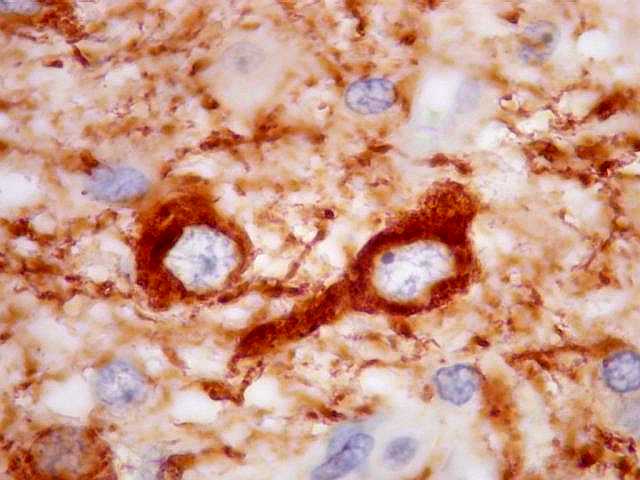
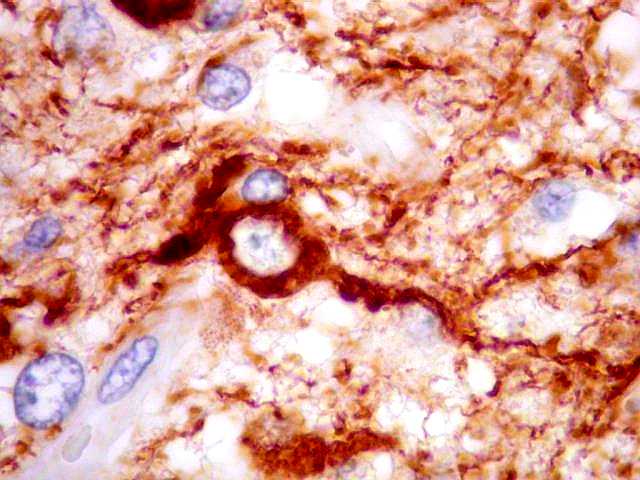
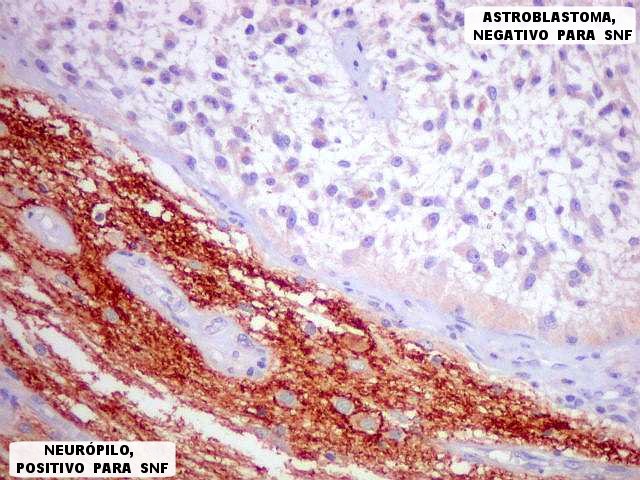
| SNF. Interface tumor - tecido nervoso. SNF (sinaptofisina) é uma proteína presente em vesículas sinápticas e demonstra o neurópilo (tecido entre os corpos celulares dos neurônios). Aqui vemos o limite nítido entre o tecido nervoso, fortemente positivo para SNF, e o tumor, que é negativo. |
| Em áreas, observa-se mistura entre tecido nervoso positivo e células tumorais negativas. Pode corresponder a um corte tangencial pela periferia do tumor e sua interface com o cérebro. |
 |
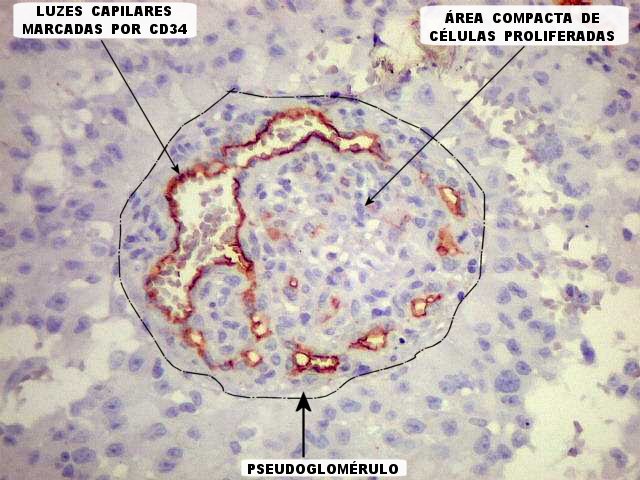
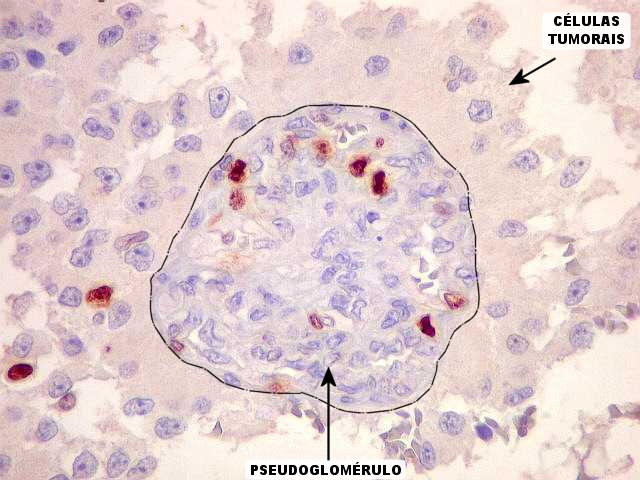
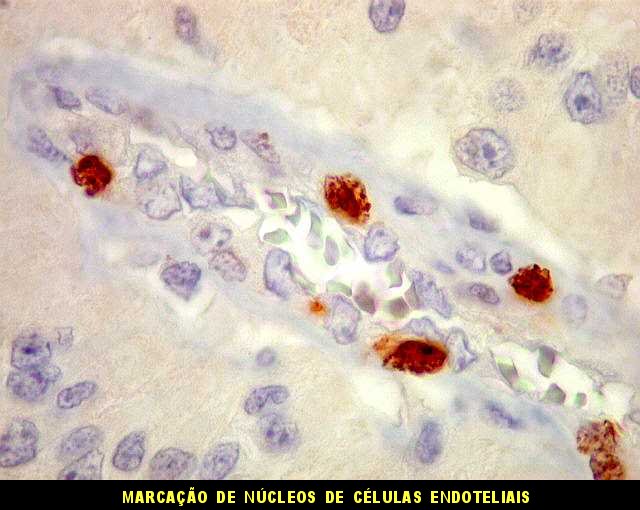
| CD34. Este marcador de vasos mostra uma rede bem distribuída de finos capilares pelo astroblastoma, mas também focos de proliferação endotelial e formação de pseudoglomérulos. |
 |
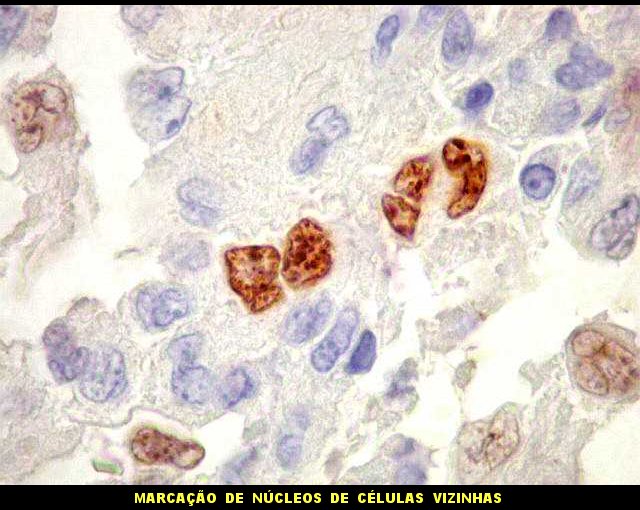
| Ki-67. Há marcação de número modesto de células, que estimamos visualmente entre 3 e 5%, compatível com tumor de baixo grau (propusemos grau II para o presente exemplo). |
| Ki-67 - positividade em células tumorais. Chama a atenção a freqüência de núcleos marcados aos pares. Podem representar células filhas de uma mesma divisão. | |
 |
|
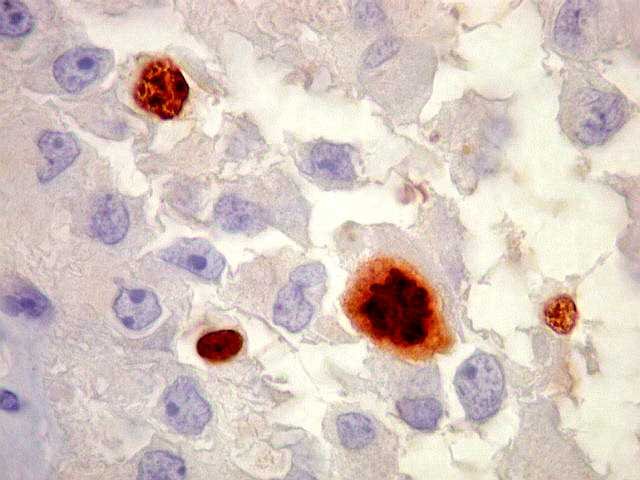
| Mitoses. Poucas eram vistas, quase todas típicas. É mais fácil identificar mitoses com Ki-67 que com HE. | |
 |
|
| Ki-67 - positividade em vasos. Há uma notável proporção de células marcadas em vasos, indicando que estão sob contínua estimulação a proliferar. Presumivelmente, o fenômeno é análogo ao observado em glioblastomas, mas também em astrocitomas pilocíticos. Deve ser resultado da estimulação hormonal das células vasculares, endotelais ou não, através de hormônios como o VEGF (vascular endothelial growth factor) produzido pelas células neoplásicas. Isto resulta em enovelados de vasos ou vasos com múltiplas pequenas luzes, que chamamos pseudoglomérulos. Contudo, não temos evidência de que este tumor (astroblastoma) seja de comportamento agressivo. | |
 |
|
 |
|
| Astroblastoma
Definição. Tumor glial raro, que ocorre principalmente em crianças, adolescentes e adultos jovens, composto por células GFAP positivas com prolongamentos espessos, pouco ou não afilados, que se prendem radialmente a vasos sanguíneos. Estes freqüentemente mostram esclerose. No momento, a OMS considera prematuro graduar os astroblastomas, já que dados sobre o comportamento biológico e prognóstico dos mesmos são insuficientes. Isto se deve à raridade e a dificuldades de delimitação histológica precisa da entidade. Historicamente, o termo foi originalmente aplicado por Bailey e Bucy (1930) para uma coleção variada de gliomas agressivos e infiltrativos afetando principalmente pacientes na meia idade. O conceito de astroblastoma como entidade distinta e unificada é controverso ainda hoje. A idéia de astroblastoma como neoplasia glial circunscrita e vasocêntrica, com predileção por pacientes relativamente jovens, deriva principalmente do trabalho de Bonnin e Rubinstein (1989). A semelhança dos astroblastomas com os ependimomas levanta difíceis problemas de diagnóstico diferencial. Outros pontos de intersecção ocorrem com gangliogliomas, astrocitomas pilocíticos e o xantoastrocitoma pleomórfico. Incidência. Em três séries publicadas, totalizando 40 casos, a idade mediana foi 11 anos, e a abrangência foi de 1 a 58 anos, com predomínio do sexo feminino 3 : 1. Estudos de imagem. São tipicamente tumores de hemisférios cerebrais, superficiais, bem delimitados, não calcificados, nodulares ou lobulados, com freqüente transformação cística, e forte impregnação por contraste. Em comparação, astrocitomas difusos são mal delimitados e não captantes. Histopatologia. Para contemplar-se o diagnóstico de astroblastoma, o tumor deve ser histologicamente circunscrito e não conter áreas de astrocitoma difusamente infiltrativo, astrocitoma de padrão gemistocítico, ou ependimoma convencional. É característica uma margem bem definida, como se ‘empurrasse’ o tecido normal, embora uma fina orla de permeação possa ser observada. A feição mais notável é a disposição radiada das células em torno de vasos ou de eixos fibrovasculares, sendo que as células tendem a epitelióides, sendo mais cilíndricas, mais curtas e espessas, e sem os finos prolongamentos fibrilares próprios das pseudorrosetas dos ependimomas. O aspecto pode lembrar uma roda de carroça (cartwheel), ou formar fitas ou fileiras, com aspecto nitidamente epitelial, ao longo da interface com o tecido conjuntivo-vascular. A disposição perivascular das células pode ter aspecto pseudopapilífero em áreas. Entre os vasos, as células neoplásicas podem dispor-se de forma densa ou frouxa, com contornos fusiformes ou estrelados. Pode haver extensas áreas de tumor sem as características pseudorrosetas do astroblastoma. Outra feição considerada de importância é a hialinização extensa das paredes vasculares espessadas, que pode resultar em trechos de tecido fibroso denso no seio do tumor. A fibrose pode ser maciça ao ponto de comprimir e reduzir numericamente as células neoplásicas entre os vasos. São descritas variedades bem diferenciadas e anaplásicas de astroblastoma, estas últimas com atividade mitótica, atipias nucleares conspícuas, hiperplasia microvascular e áreas de necrose. Imunoistoquímica. Há positividade para GFAP, VIM e proteína S-100. A positividade para GFAP pode variar, contrastando células marcadas e não marcadas, freqüentemente lado a lado. Pode haver marcação focal para EMA em padrão membrana. Queratinas podem ser demonstráveis ou não. Reatividade para NSE é inconstante. Casos isolados foram negativos para SNF. Marcação dos núcleos por Ki-67 variou de 1 a 18 % na literatura. Histogênese. É desconhecida. A evidência atual sugere que o tumor derive de células mais relacionadas a astrócitos, o que coincide com a idéia de Bailey e Cushing (1926) de que o tumor seria originado de células programadas para se transformar naquela direção. O tanicito, uma célula com feições intermediárias entre astrócito e epêndima, é considerado um candidato a célula de origem. Dados genéticos, embora ainda em pequeno número de casos, são consistentes com a idéia de que os astroblastomas são distintos de outras neoplasias gliais. Referências. Aldape KD, Rosenblum MK. Astroblastoma. In WHO Classification of Tumours of the Central Nervous System. 4th Ed. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK, editors. International Agency for Research on Cancer, Lyon, 2007. pp 88-9. Bailey P, Bucy PC. Astroblastomas of the brain. Acta Psychiatr Neurol 5: 439-61, 1930. Bailey P, Cushing H. A classification of tumors of the glioma group on a histogenetic basis with a correlation study of prognosis. Lippincott, Philadelphia, 1926. Bonnin JM, Rubinstein LJ. Astroblastomas: a pathological study of 23 tumors, with a postoperative follow-up in 13 patients. Neurosurgery 25: 6-13, 1989. Burger, PC, Scheithauer BW, Vogel FS. Surgical Pathology of the Nervous System and its Coverings. 4th Ed. Churchill Livingstone, New York, 2002. p. 254-6. Russell DS, Rubinstein LJ. Pathology of Tumours of the Nervous System. 5th Ed. Edward Arnold, London, 1989. pp. 161-9. Thiessen
B, Finlay J, Kulkami R, Rosenblum MK. Astroblastoma: does histology predict
biologic behavior? J. Neurooncol 40: 59-65, 1998.
|
| Caso do Serviço de Neurocirurgia do Hospital Santa Casa de Limeira, gentilmente contribuído pelos Drs. Antonio Augusto Roth Vargas, Marcelo Senna Xavier de Lima, Paulo Roland Kaleff e residentes. Limeira, SP. |
| Para mais imagens deste caso: | TC | HE | IH :GFAP, VIM, S-100, EMA |
 |
 |
 |
|
|
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|