|
|
2 - Imunohistoquímica |
|
|
|
2 - Imunohistoquímica |
|
| IMUNOHISTOQUÍMICA |
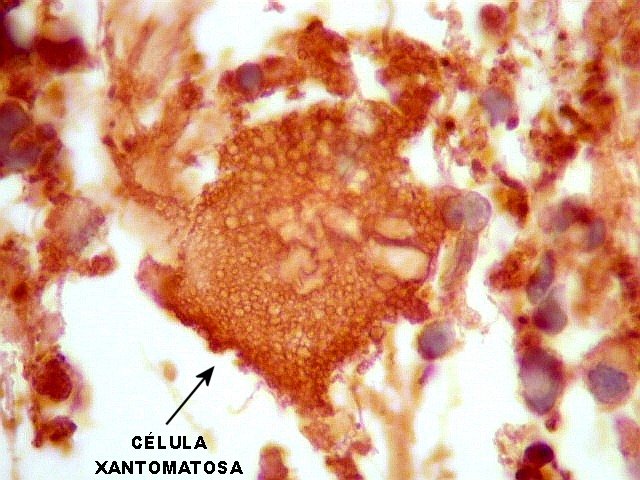
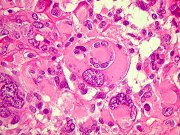
| GFAP. Como esperado, foi positivo no citoplasma das células neoplásicas, sendo útil para salientar o aspecto xantomatoso já demonstrado em HE. | |
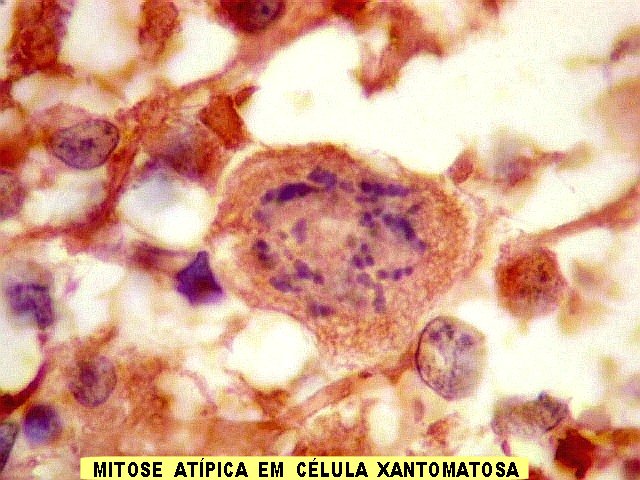
| Algumas mitoses atípicas foram observadas em células com citoplasma espumoso e GFAP positivo. | |
 |
|
| Células atípicas não xantomatosas. | |
| VIM. Como GFAP, resultado positivo difuso, enfatizando o caráter xantomatoso de numerosas células neoplásicas. | |
| S-100. Positividade nuclear e citoplasmática na maioria das células. Alguns núcleos não reagem. | |
 |
|
 |
|
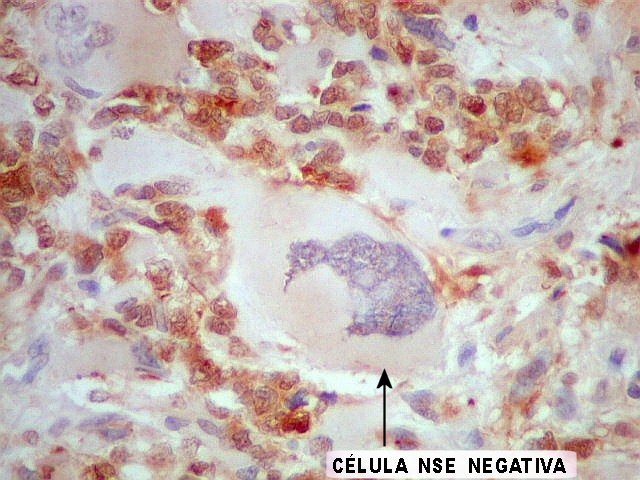
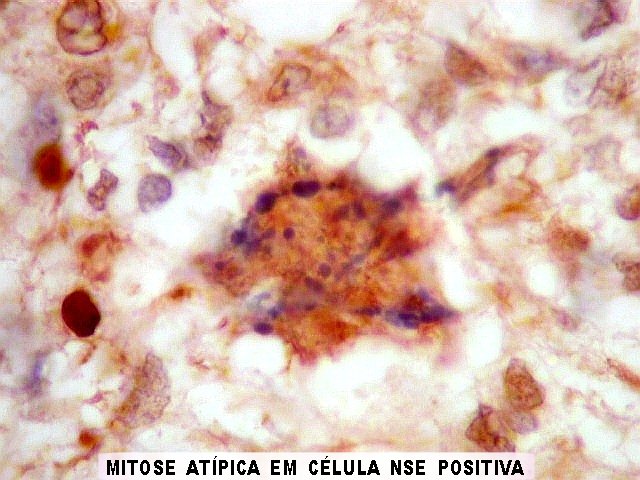
| NSE. Comportamento irregular com positividade nuclear e/ou citoplasmática variável. | |
 |
 |
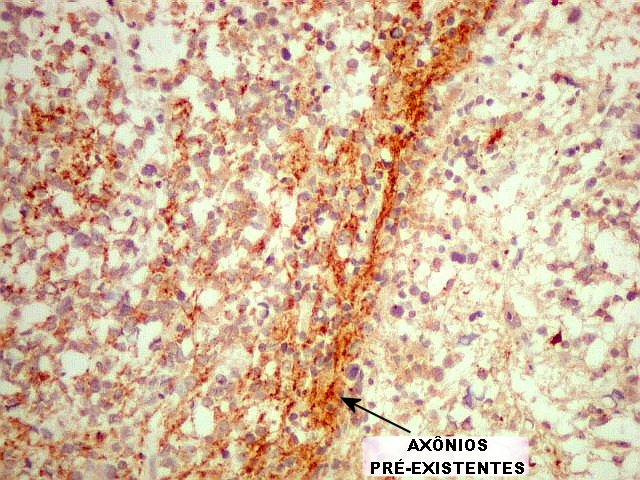
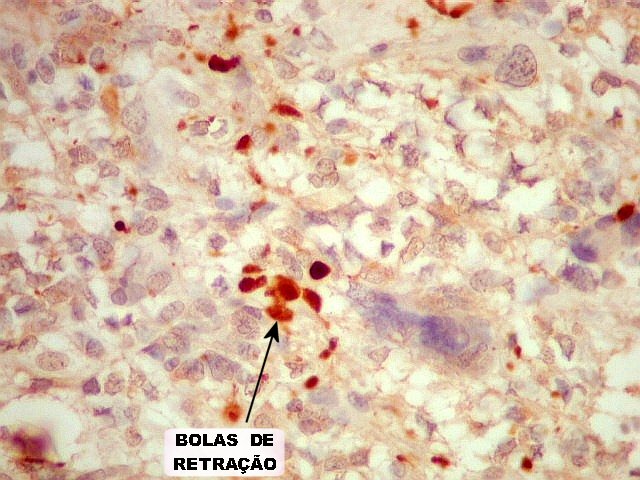
| NF. Útil para demonstrar axônios remanescentes nas áreas infiltradas pelo tumor. A reação para NF mostra que o tumor é bem mais infiltrativo do que se poderia supor pela HE. Em alguns lugares observam-se formações bulbosas ricas em neurofilamento, que provavelmente correspondem às chamadas bolas de retração de Cajal, um sinal de lesão axonal. As células neoplásicas são negativas para NF (como esperado). | |
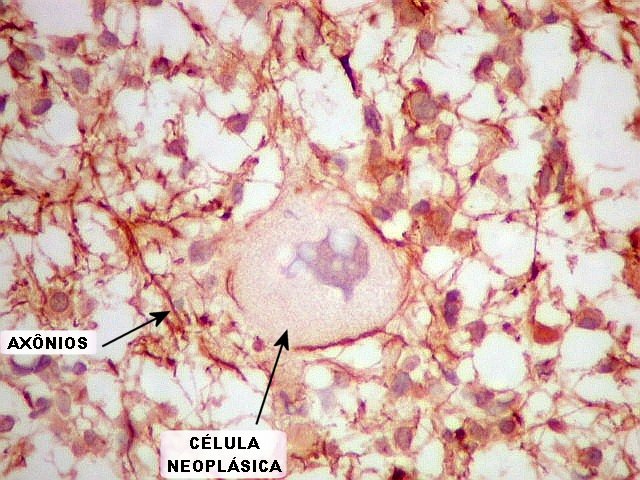 |
|
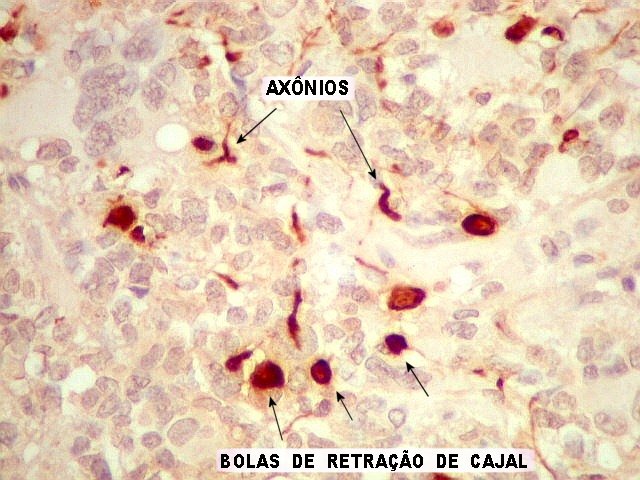 |
|
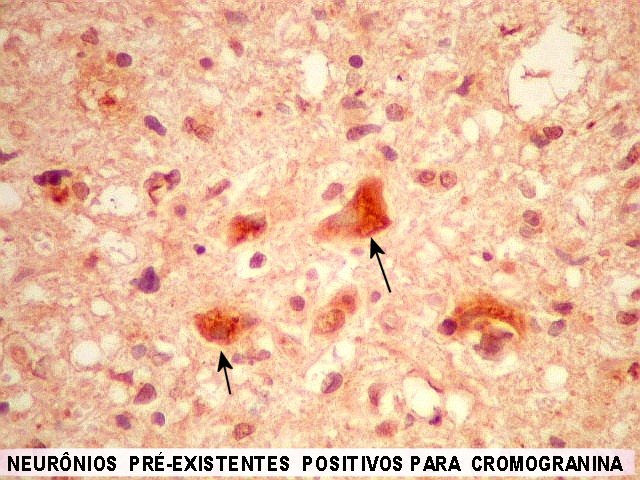
| SNF. Como NF (acima), demonstra elementos remanescentes do tecido cerebelar infiltrado pelo tumor, que teriam passado despercebidos em HE. Logo abaixo, uma área em faixa com neurônios e grânulos sinaptofisina positivos, que foi interpretada como resto do núcleo denteado. Em outros campos, observam-se axônios pré-existentes, e algumas bolas de retração (que se formam em axônios seccionados ou rotos). | |
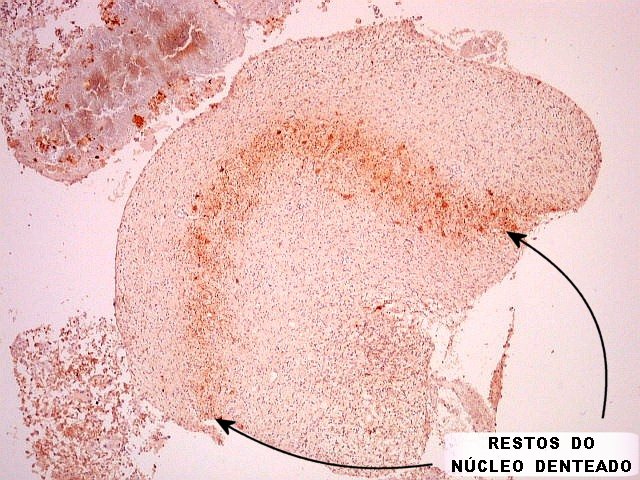 |
|
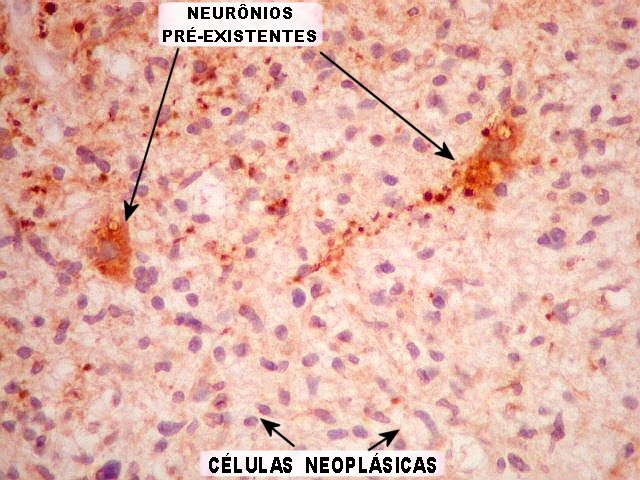 |
|
 |
|
 |
|
| CGR. Mostra neurônios remanescentes, como NF e SNF. | |
 |
|
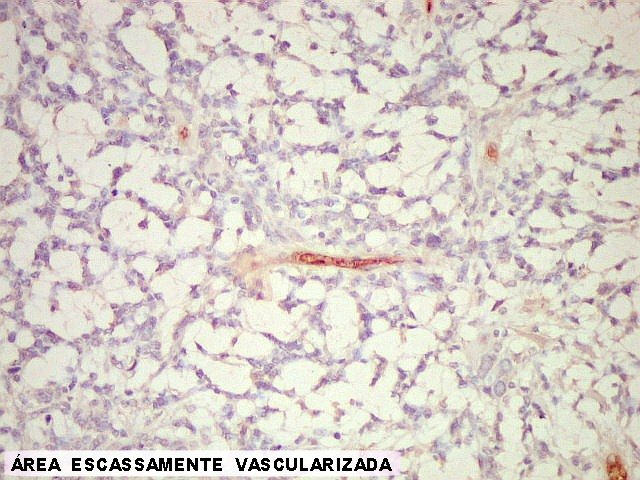
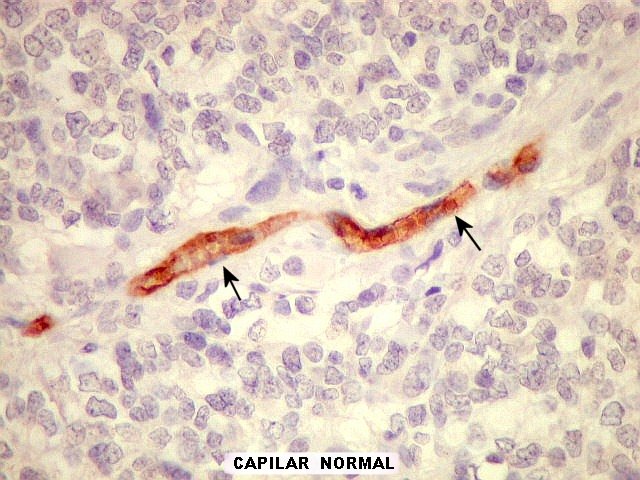
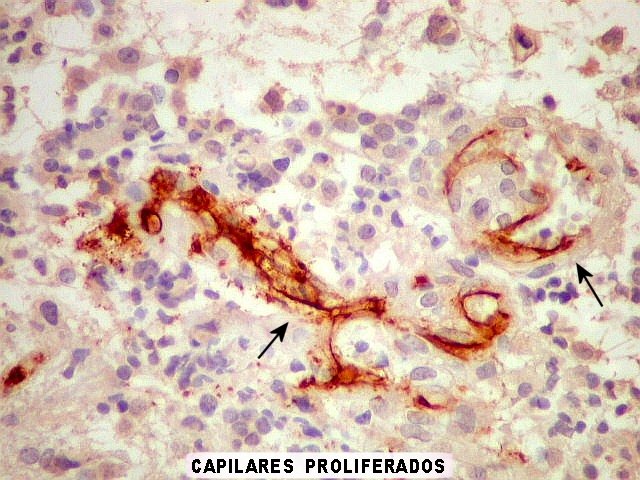
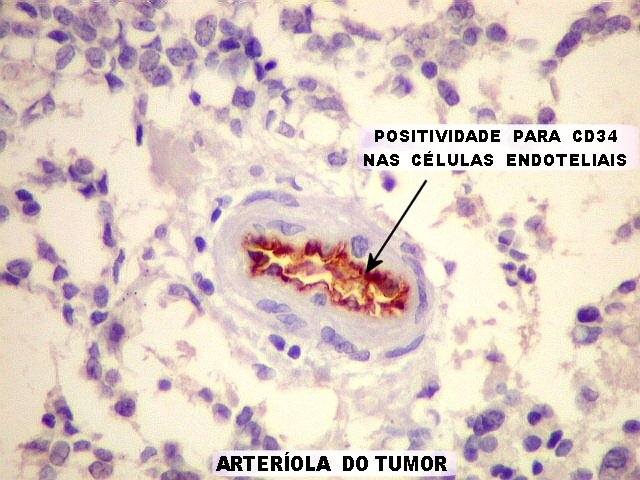
| CD34. Valioso para demonstrar a vascularização do tumor. A positividade reside nas células endoteliais. No presente caso, em que pese o caráter infiltrativo e a malignidade do tumor, a grande maioria dos capilares é fina, com ramificação dicotômica, lembrando pequenos tubos. A luz é retilínea e os núcleos das células endoteliais são espaçados. Capilares proliferados, uma das feições próprias dos astrocitomas anaplásicos e glioblastomas, são raros e de pouca expressão. | |
 |
|
 |
|
 |
|
 |
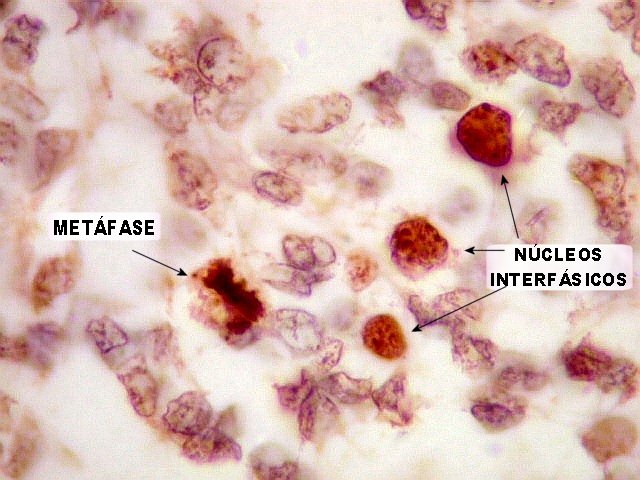
| KI-67. O marcador de proliferação celular Ki-67 é positivo em 10 a 15 % das células tumorais, tanto pequenas como gigantes multinucleadas. Nas células em mitose marcam-se os cromossomos (forte) e o citoplasma (mais fraco e difuso). | |
| Mitoses. Típicas (primeira fileira) e atípicas. | |
 |
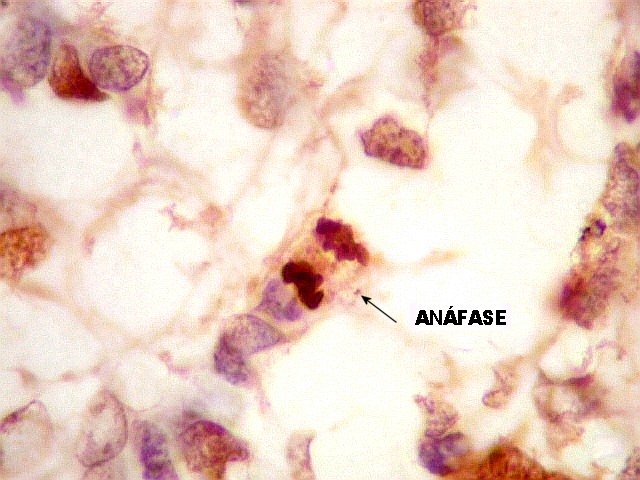 |
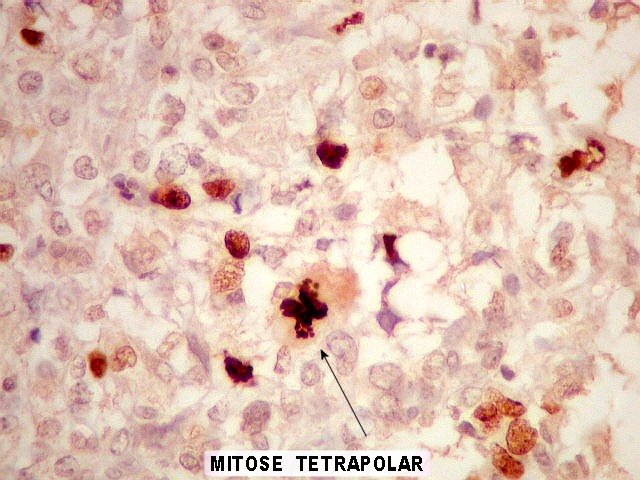 |
|
| Áreas infiltradas. Nestas, é possível ver células tumorais marcadas entre as células pré-existentes, que demonstram uma vez mais o potencial infiltrativo desta neoplasia. Provavelmente não teriam sido notadas em HE. | |
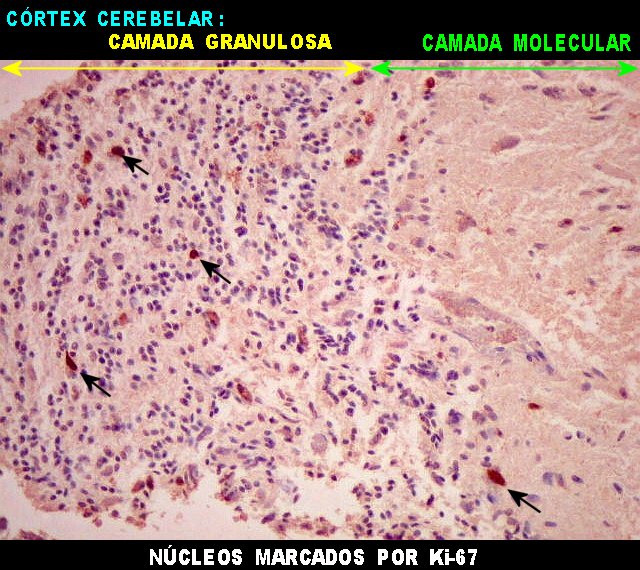 |
| p53. Positividade chega a atingir 100% dos núcleos em várias áreas, sugerindo importante papel de mutações deste gene na gênese do tumor. | |
| Comentário.
Este
é um caso raro de tumor maligno astrocitário primário
do cerebelo, que reúne os critérios para glioblastoma multiforme:
atipias, mitoses, proliferação vascular e necrose. Contudo,
embora as atipias sejam muito acentuadas, as mitoses são relativamente
escassas, assim como a proliferação vascular e a necrose.
A observação de que muitas das células mais atípicas
e volumosas têm citoplasma xantomatoso levanta também a possibilidade
de um xantoastrocitoma pleomórfico (PXA), que, no caso, seria da
variedade anaplásica. É conhecido que este tumor é
habitualmente sólido-cístico, bem delimitado e situado nos
hemisférios cerebrais. Sua localização em fossa posterior
é rara, correspondendo a apenas um (Wasdahl et al., 1994) dentre
71 casos de reunidos por Giannini et al. (1999). Contudo, o
presente exemplo é muito agressivo e infiltrativo, tendo recidivado
e aumentado de volume apenas 6 meses após a cirurgia.
Na literatura, há cerca de 144 casos relatados de glioblastoma multiforme no cerebelo em adultos e 28 em crianças (Gupta et al., 2003), correspondendo a menos de 1% da incidência em hemisférios cerebrais (Kopelson, 1982). Kepes e Rubinstein (1981) descreveram três casos de um subtipo raro de glioblastoma multiforme, em que parte das células neoplásicas são gigantes, bizarras, com marcadas atipias nucleares, e citoplasma finamente vacuolado contendo lípides. Ao contrário do glioblastoma habitual, o número de mitoses não é grande e há relativamente pouca proliferação vascular. Parece-nos que esta hipótese é a que melhor cabe ao presente caso. Peferimos não atribuir o diagnóstico de PXA em virtude do caráter claramente maligno do tumor, demonstrado pela clínica e exames de imagem. Referências.
|
| Para mais imagens deste paciente, clique » |
|
|
 |
 |
| Este assunto na graduação | Características de imagem dos glioblastomas |
| Neuropatologia
- Graduação |
Neuropatologia -
Casos Complementares |
Neuroimagem
- Graduação |
Neuroimagem -
Casos Complementares |
Correlação
Neuropatologia - Neuroimagem |
|
|
|
|