|
|
|
|
|
|
|
|
| Fem 42 a. Clique para história clínica e ressonância magnética. |
| Destaques da microscopia. Texto sobre linfomas primários do SNC. | ||
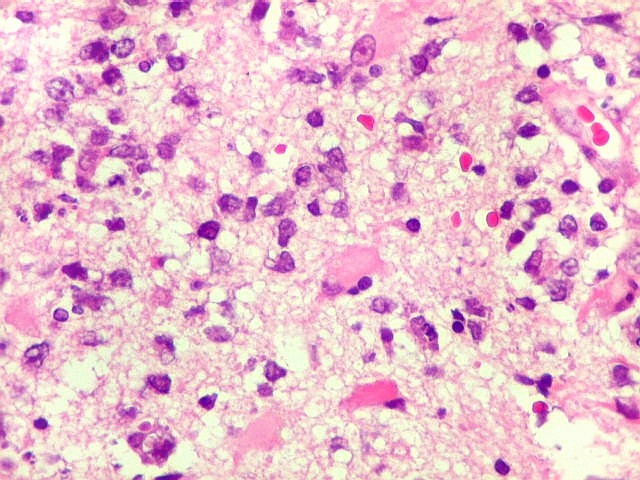
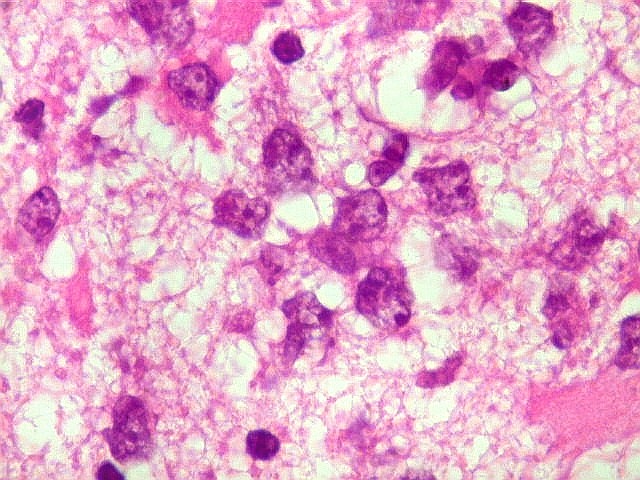
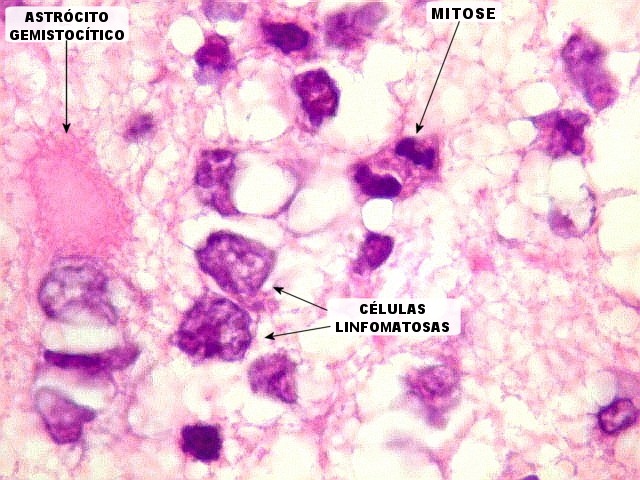
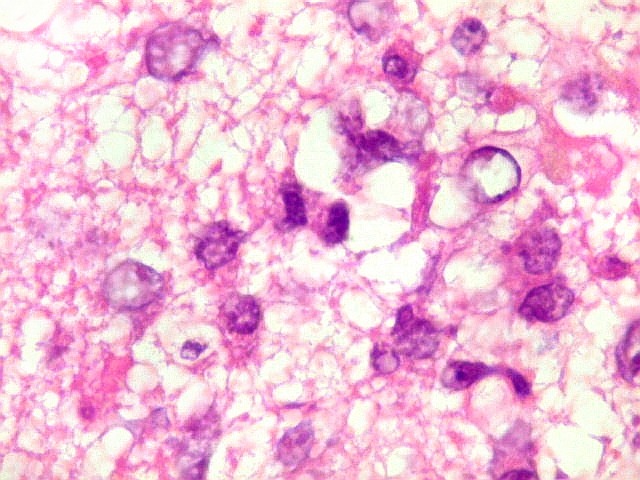
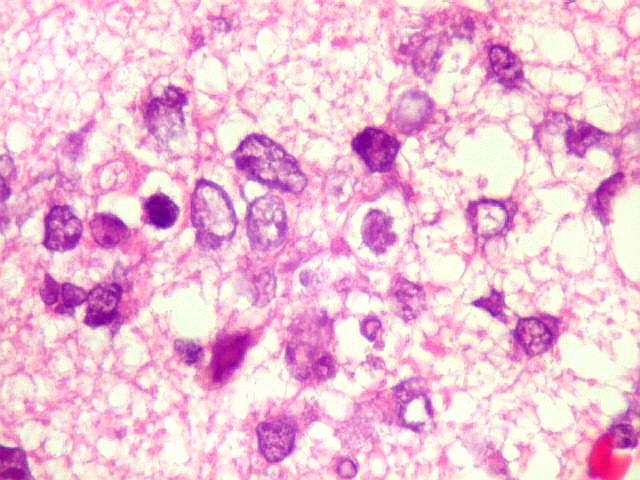
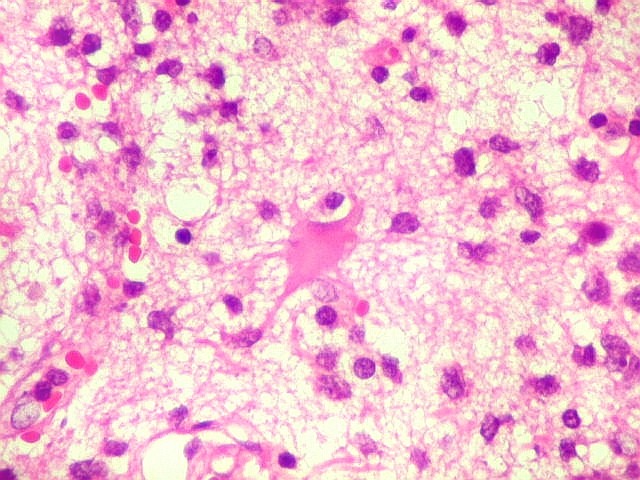
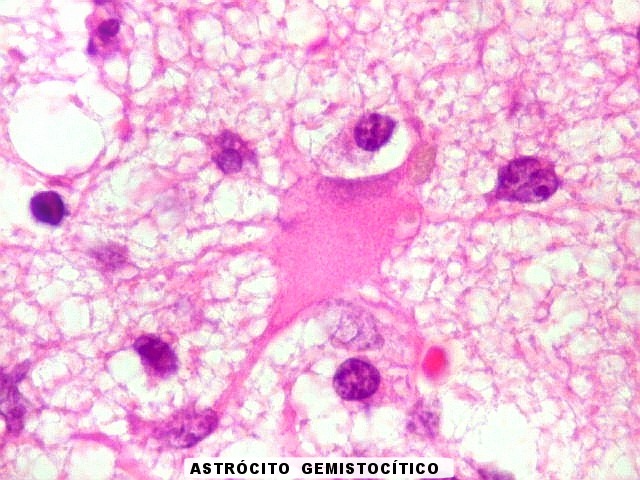
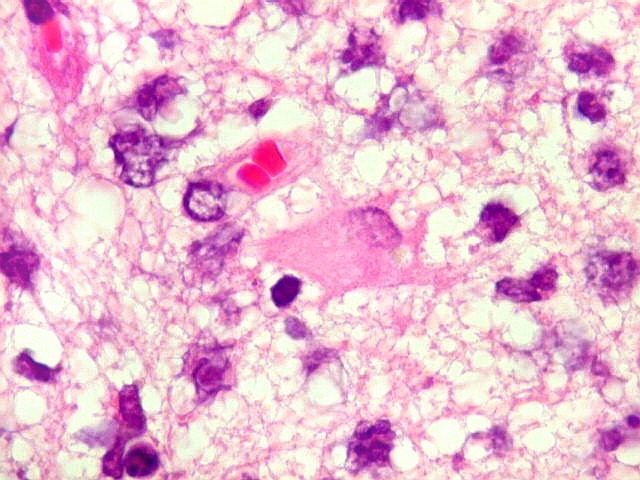
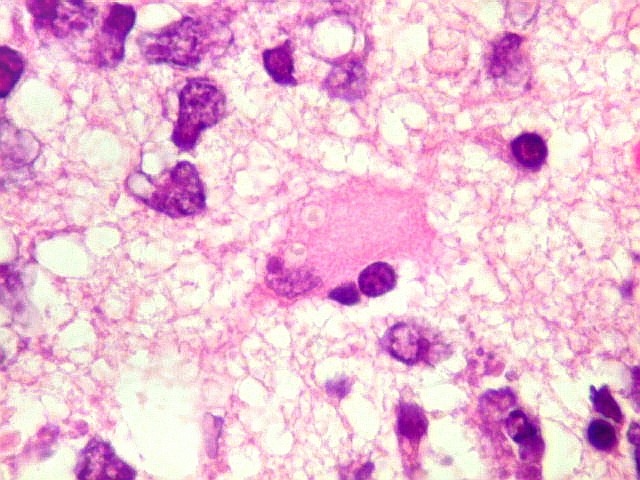
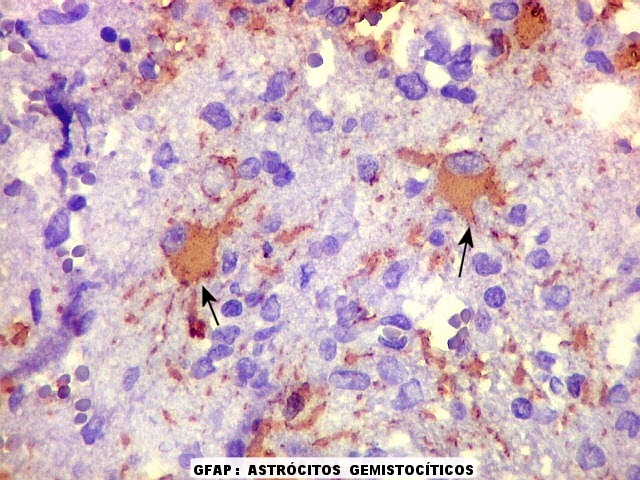
| HE. Caráter infiltrativo difuso, alta celularidade | Células neoplásicas : núcleos grandes e irregulares, cromatina grosseira, nucléolo, citoplasma muito escasso. | Astrócitos gemistocíticos reacionais à infiltração neoplásica |
 |
 |
 |
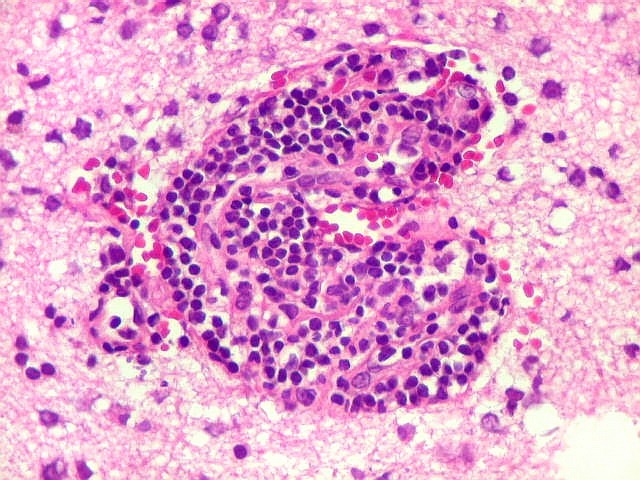
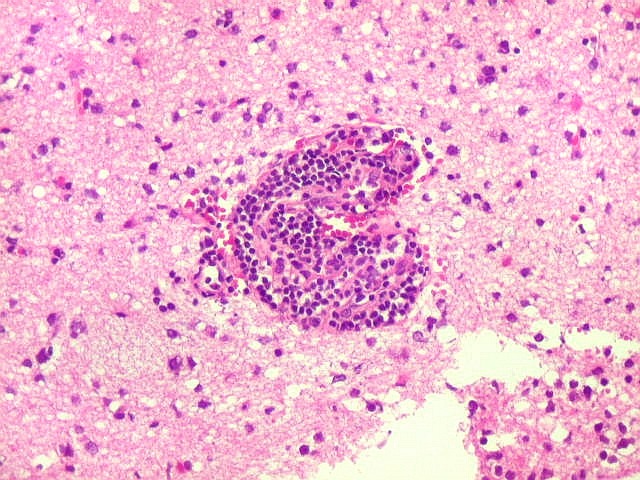
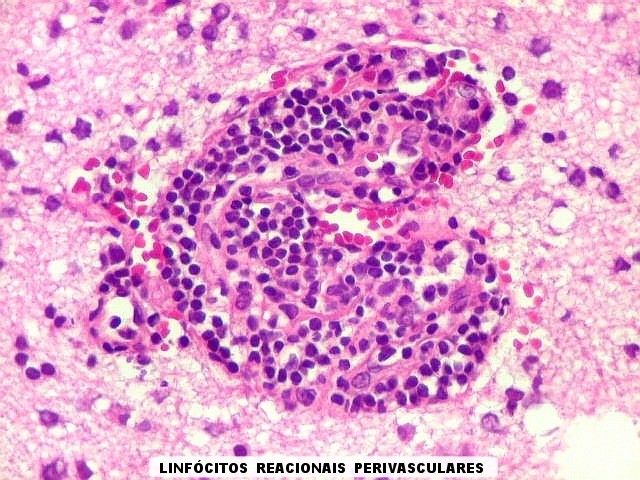
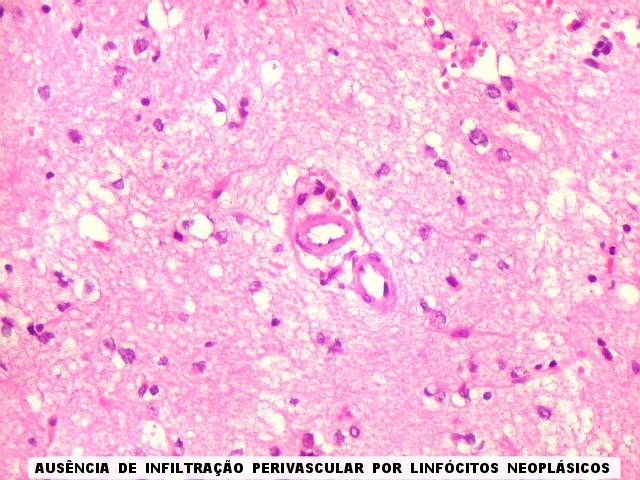
| Manguitos perivasculares raros e constituídos por linfócitos reacionais não neoplásicos (exceção). Na grande maioria dos vasos deste caso não há infiltração perivascular | CD20. Fortemente positivo nas células neoplásicas (linhagem B). | CD3. Positivo em linfócitos T reacionais. |
 |
 |
 |
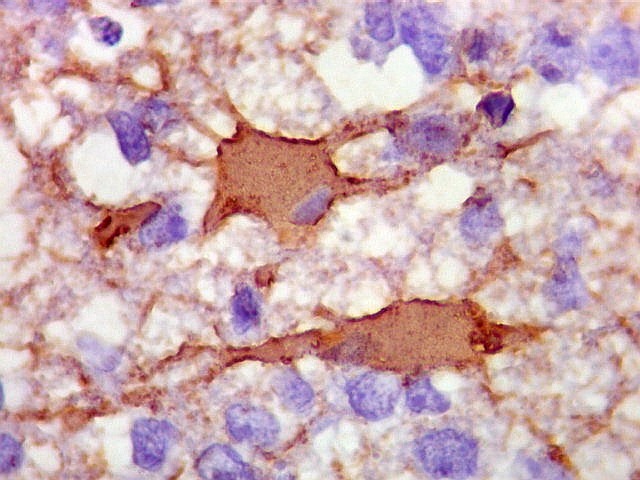
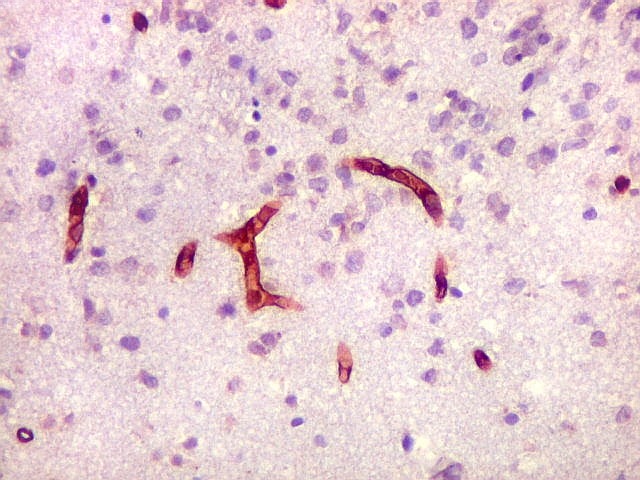
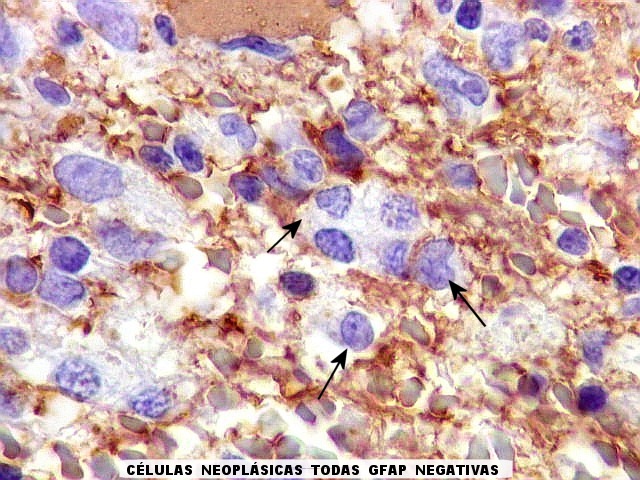
| GFAP. Positivo em astrócitos pré-existentes (formas reacionais gemistocíticas) | CD34. Positivo em vasos. Ausência de manguitos perivasculares de células neoplásicas, característicos dos linfomas do sistema nervoso central | Ki-67. Positividade em cerca de 100% dos núcleos das células neoplásicas (altíssimo índice proliferativo). Negativo em pequenos linfócitos perivasculares |
 |
 |
 |
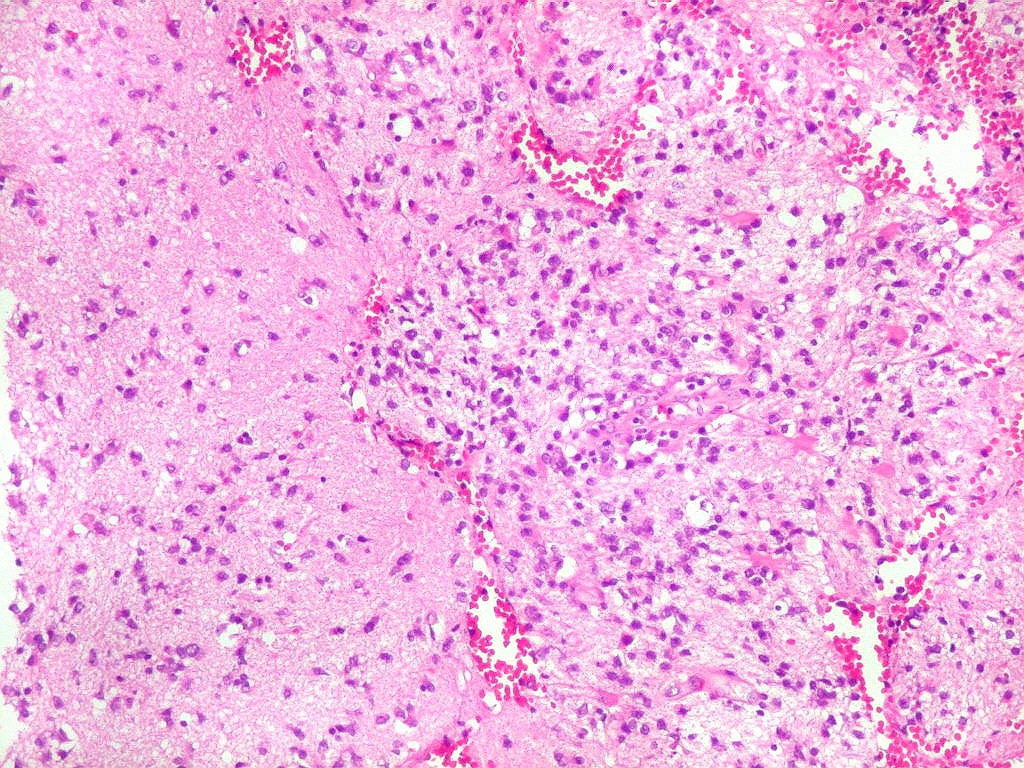
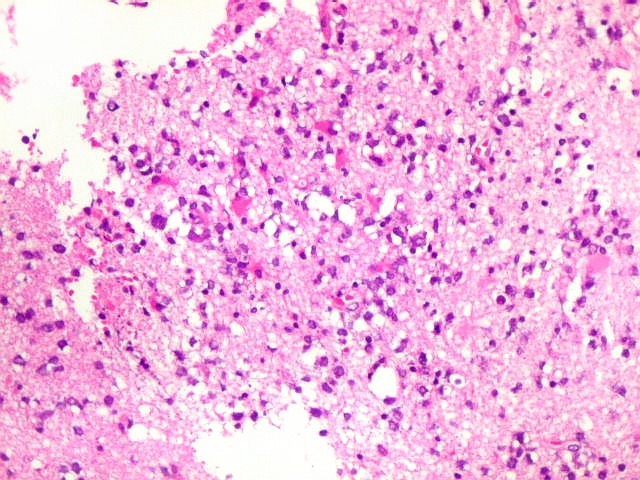
| Aspecto
geral.
Biópsia, obtida da substância branca profunda, mostra grande aumento de celularidade à custa de células com núcleos arredondados, irregulares e citoplasma muito escasso. Entre elas há população de astrócitos gemistocíticos (reativos). A morfologia em HE não foi considerada suficientemente característica para fechar o caso como linfoma. Cabia o diagnóstico diferencial com glioma difusamente infiltrativo. O diagnóstico final de linfoma de grandes células B só foi firmado com imunohistoquímica para CD20. |
 |
 |
 |
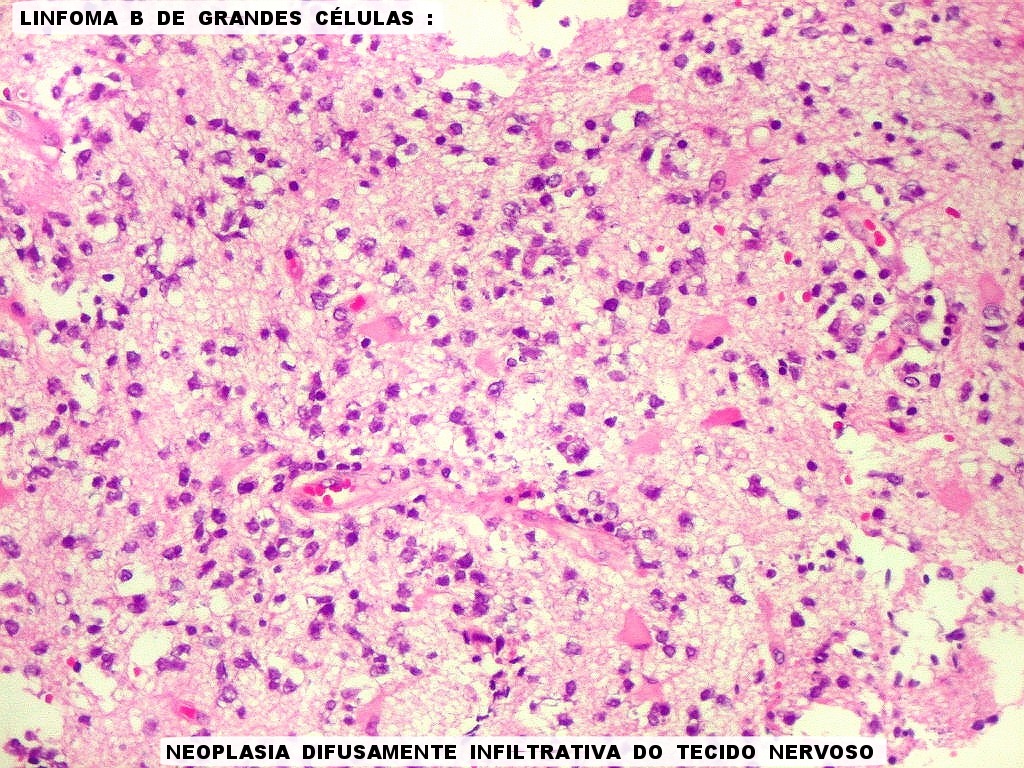
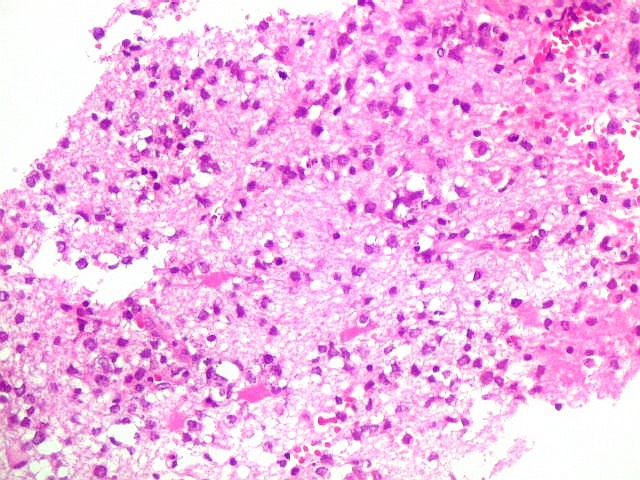
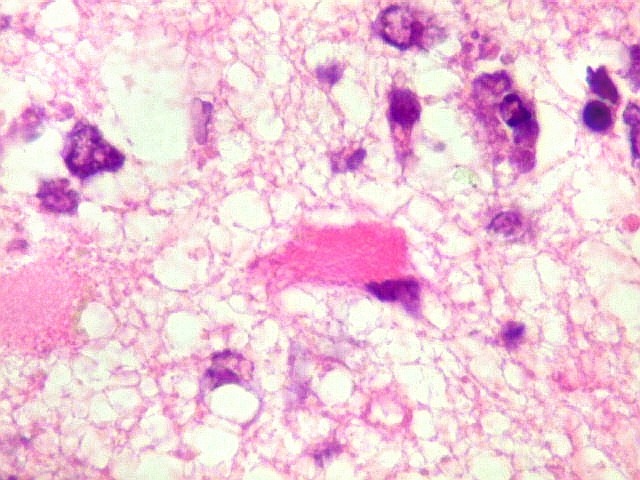
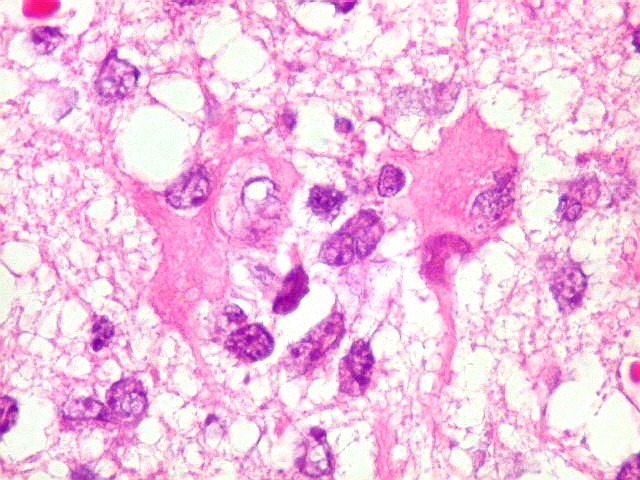
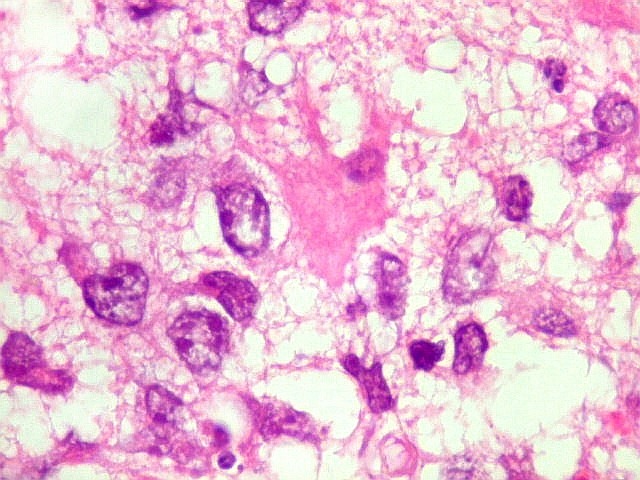
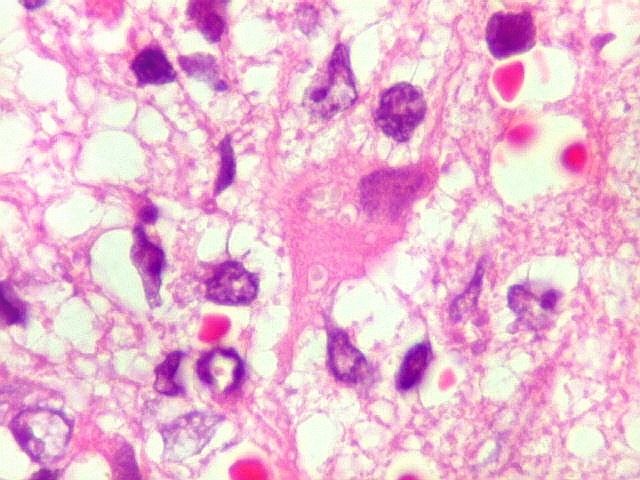
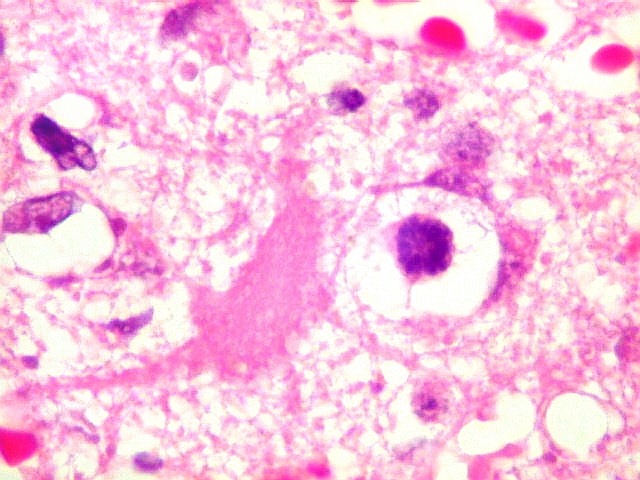
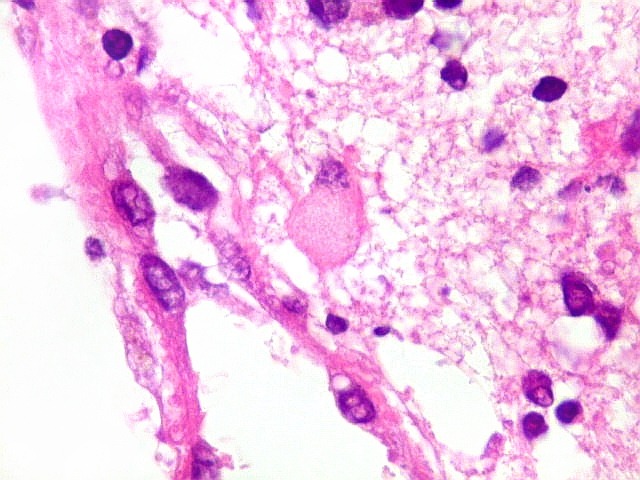
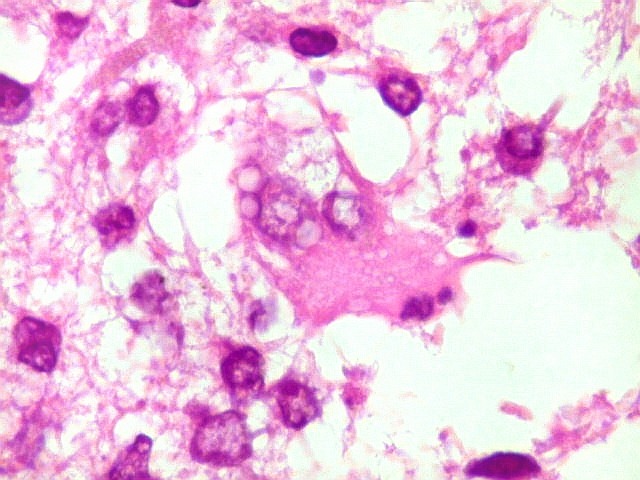
| Caráter infiltrativo. As células neoplásicas permeiam difusamente entre os elementos próprios do tecido nervoso (glia e axônios). Muitas das células não neoplásicas são astrócitos gemistocíticos. | |
 |
 |
 |
 |
 |
 |
 |
 |
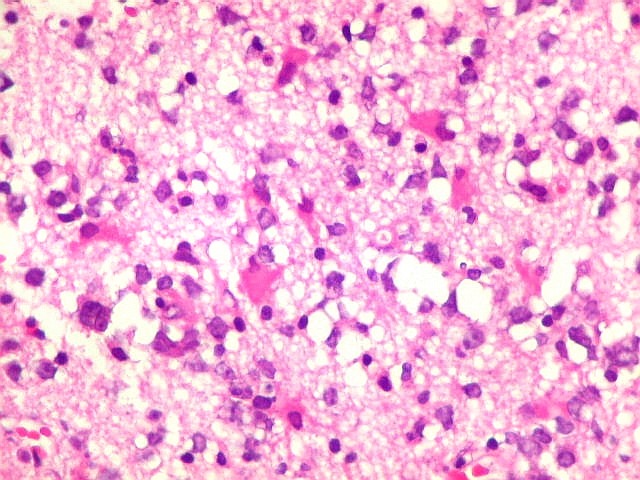
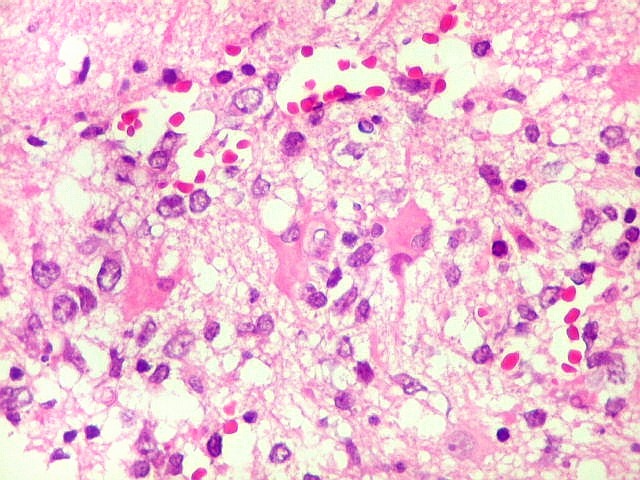
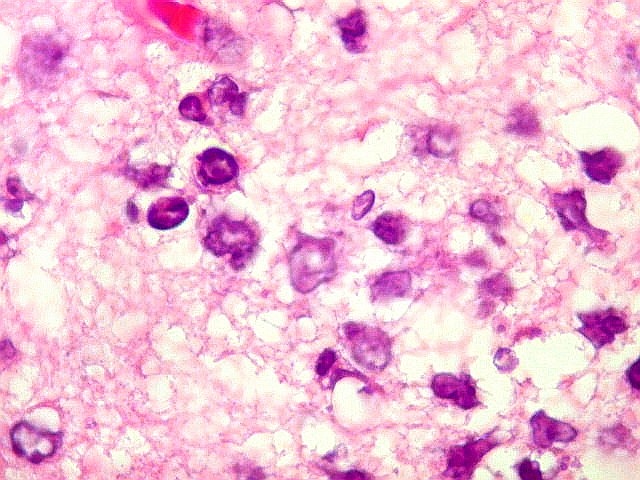
| Células neoplásicas. As células mostram núcleos grandes, com contorno irregular, por vezes com indentações, cromatina grosseira e, freqüentemente, nucléolo. Observam-se algumas mitoses. O citoplasma é muito escasso, geralmente não identificável. A ausência de citoplasma fala a favor de linfoma, pois se fosse um glioma pouco diferenciado, pelo menos algum citoplasma deveria ser visível em pelo menos parte das células. Porém, contra linfoma, havia a ausência de manguitos perivasculares de células neoplásicas. A imunohistoquímica esclareceu o caso como linfoma não Hodgkin de grandes células B. | |
 |
 |
 |
 |
 |
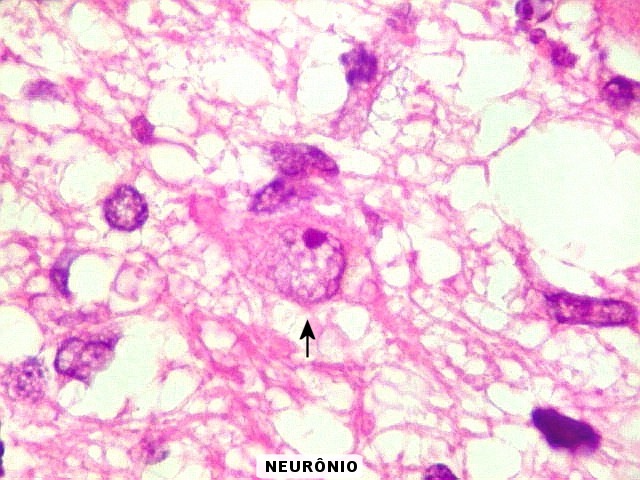 |
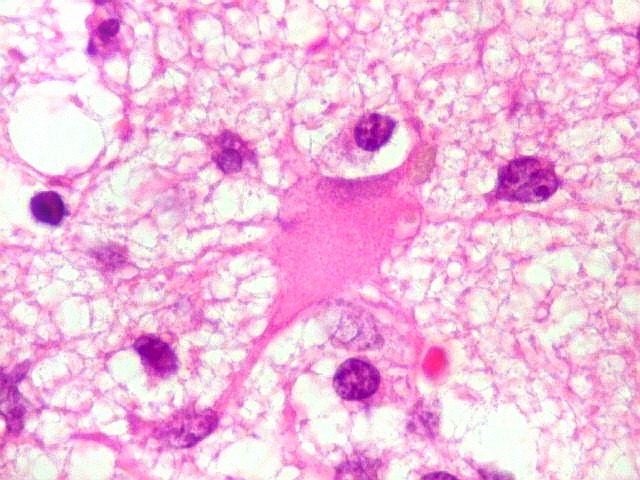
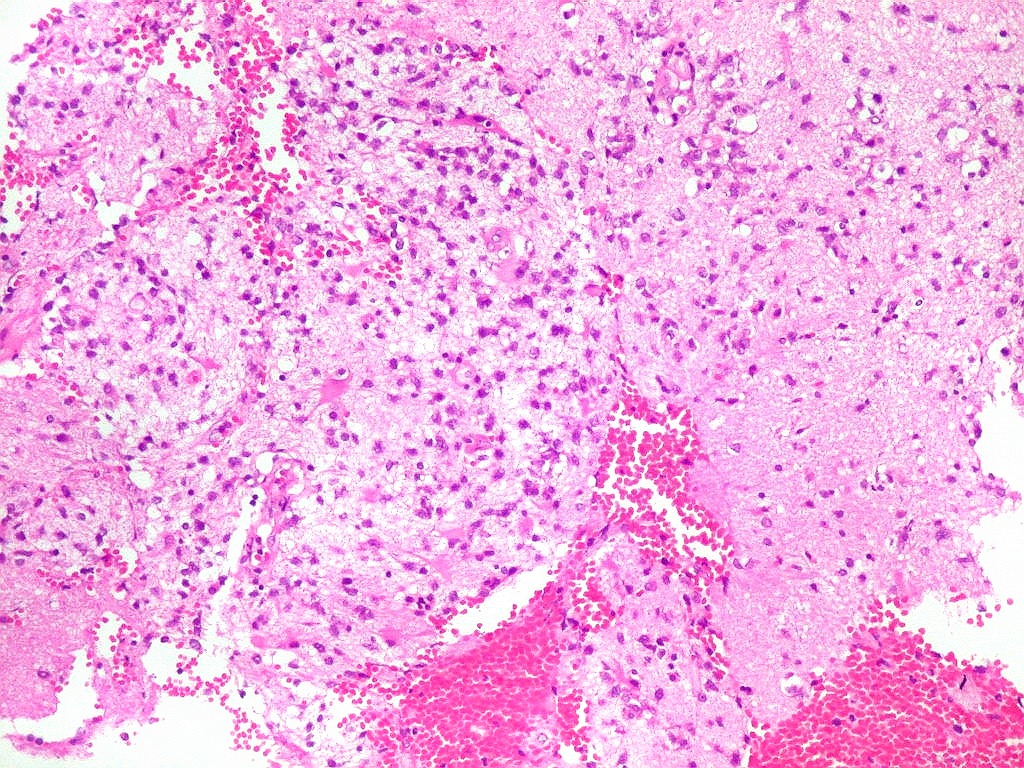
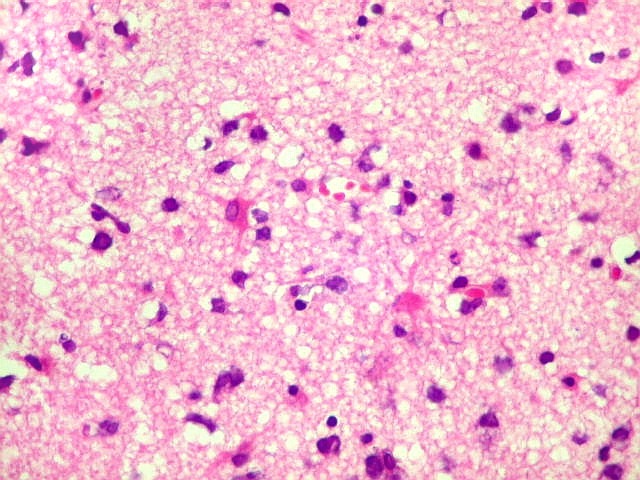
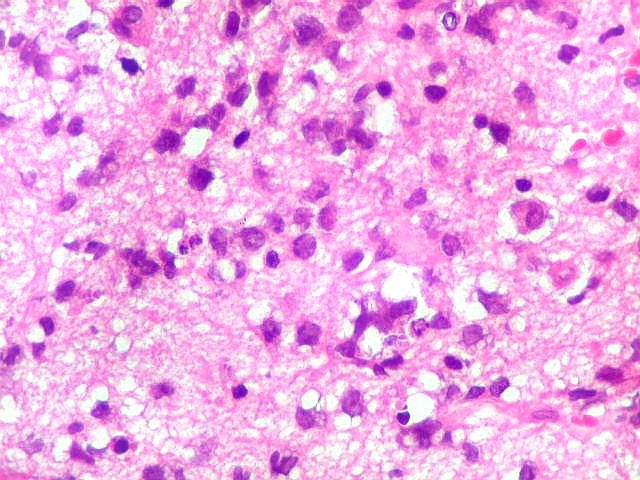
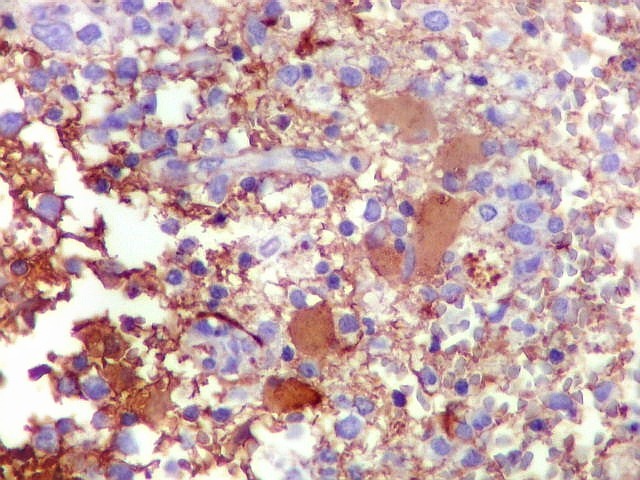
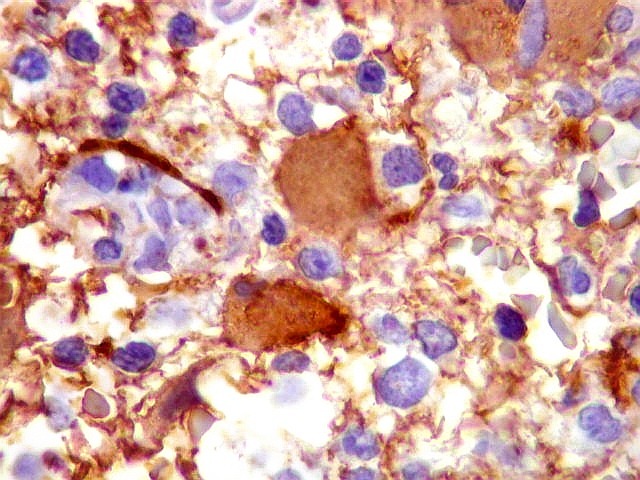
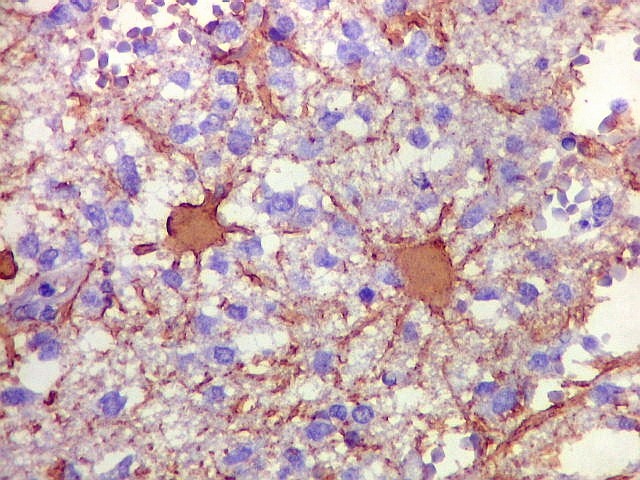
| Astrócitos gemistocíticos. Os astrócitos apresentam-se hipertróficos, com citoplasma róseo, abundante e homogêneo, e núcleo excêntrico. Estas formas reacionais, chamadas astrócitos gemistocíticos, são inespecíficas, pois podem aparecer frente a diferentes tipos de agressão ao tecido nervoso. No caso, estão reagindo à infiltração pelas células linfomatosas. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
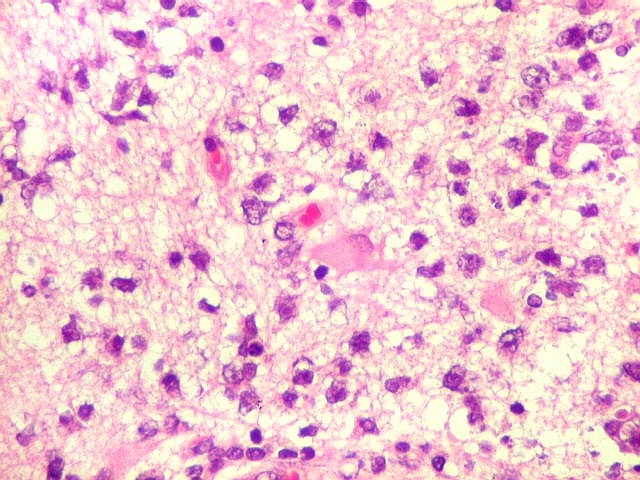
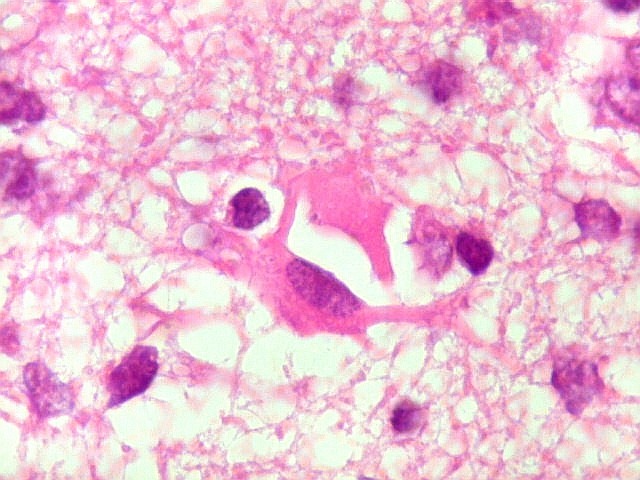
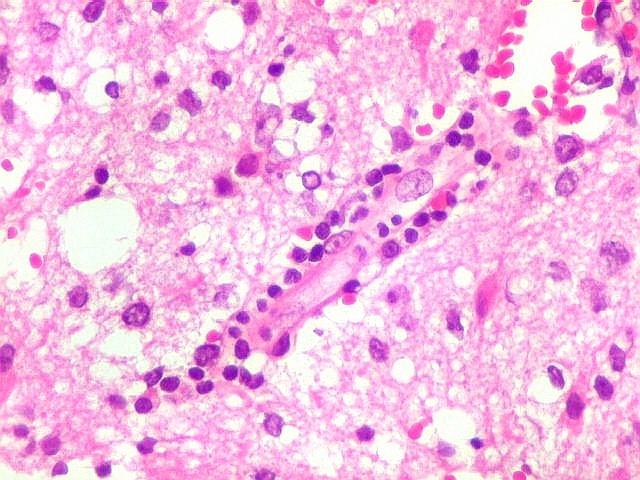
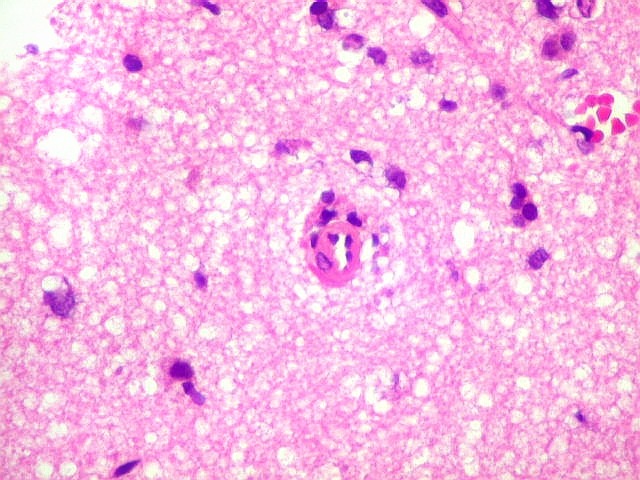
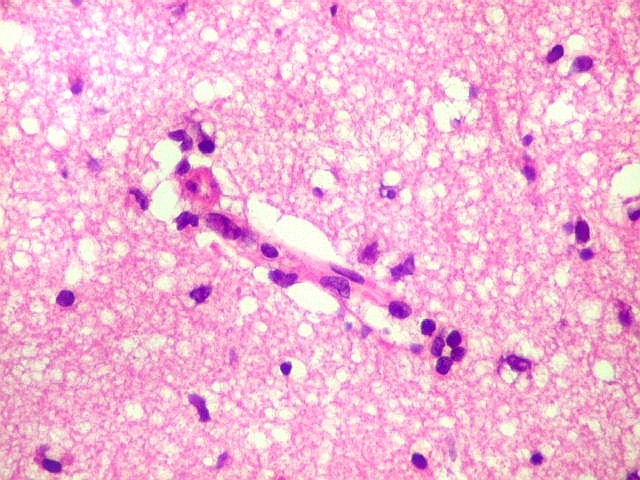
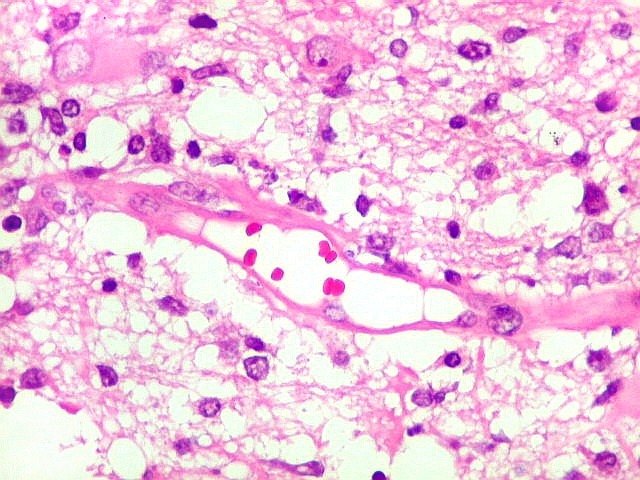
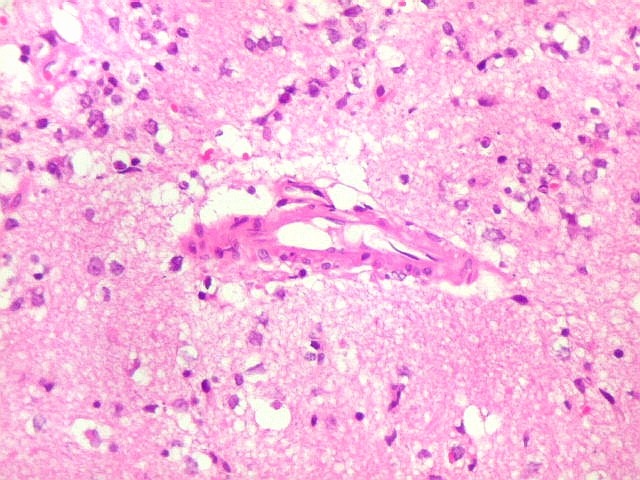
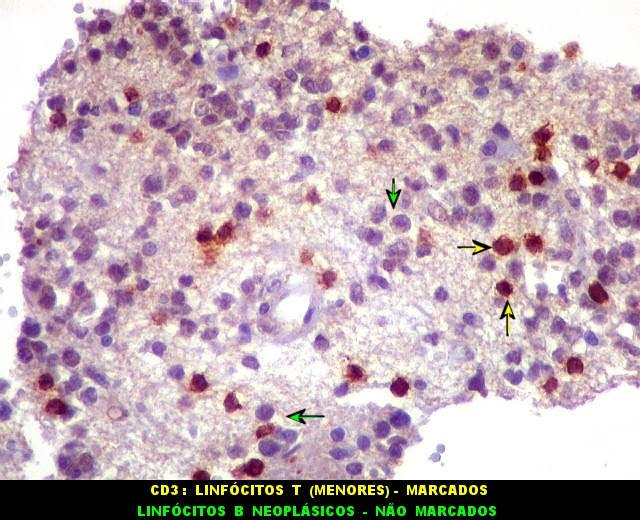
| Vasos com infiltrado inflamatório perivascular. Uns poucos pequenos vasos na amostra apresentam-se circundados por células inflamatórias, na maioria linfócitos T. Não são neoplásicos, têm núcleos muito menores que os linfócitos B neoplásicos e não se marcam para CD20. Devem corresponder a uma reação inespecífica ao tumor. No tecido nervoso infiltrado há também considerável população de linfócitos T, demonstráveis por CD3, que são considerados reacionais. | |
 |
 |
 |
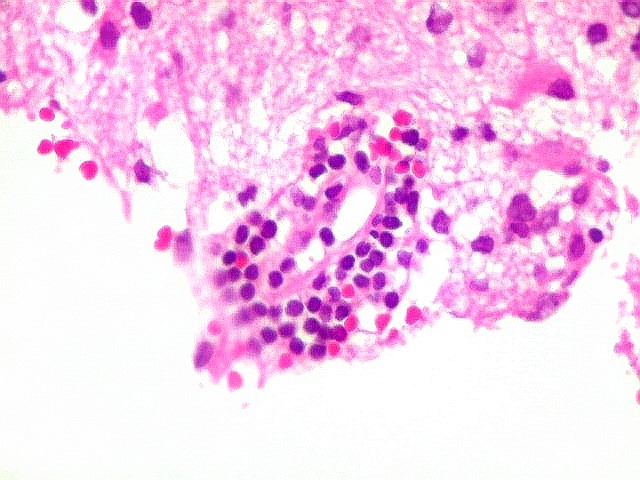 |
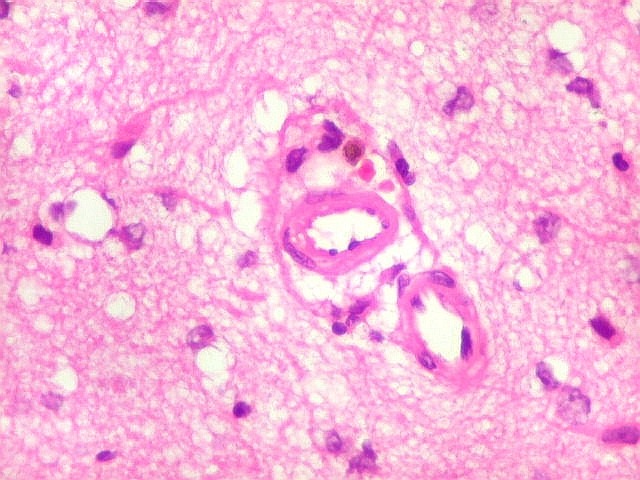
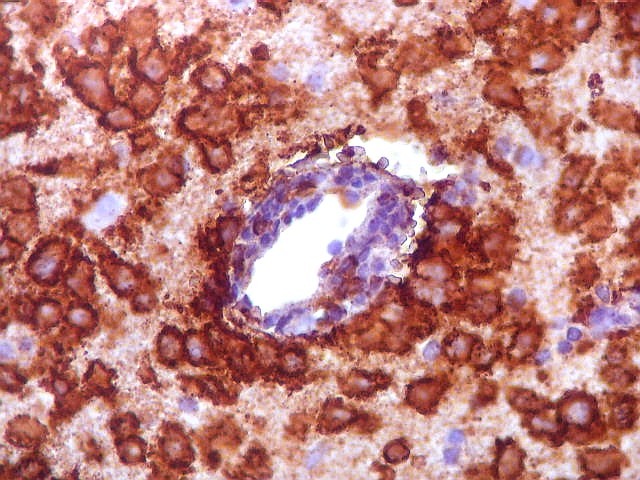
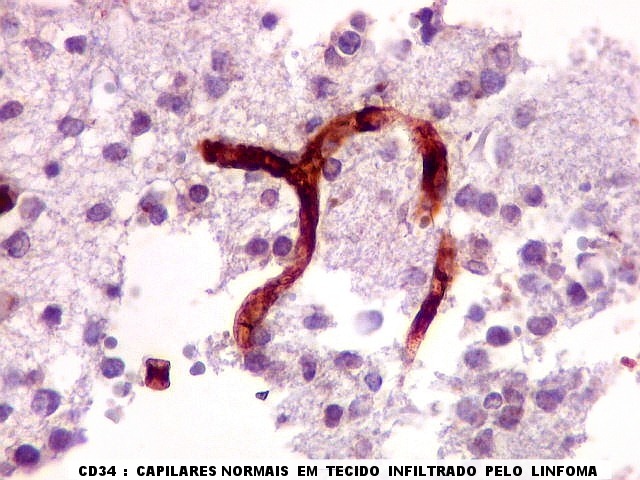
| Vasos sem infiltração por células neoplásicas. Ao contrário do que seria esperado para um linfoma infiltrativo do cérebro, não havia coroas ou manguitos perivasculares de células neoplásicas. Manguitos perivasculares de células neoplásicas, com a característica proliferação de fibras reticulínicas, são achado clássico neste tipo de neoplasia, e a sua ausência no presente caso dificultou o diagnóstico até o resultado da imunohistoquímica. Nos raros vasos circundados por linfócitos, estes eram não neoplásicos, e não marcavam para CD20 nem Ki-67. | |
 |
 |
 |
 |
 |
 |
|
|
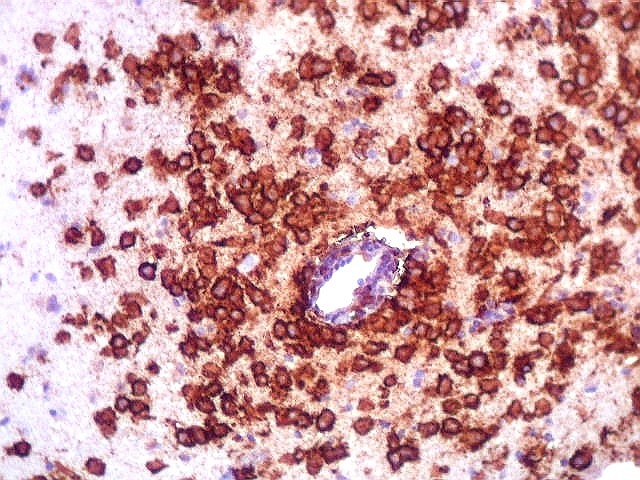
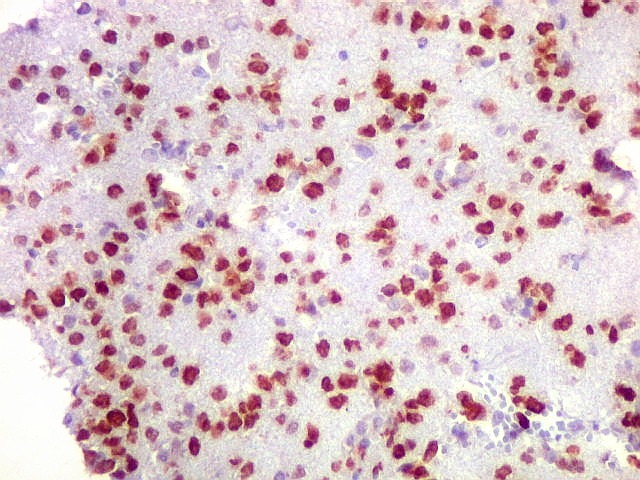
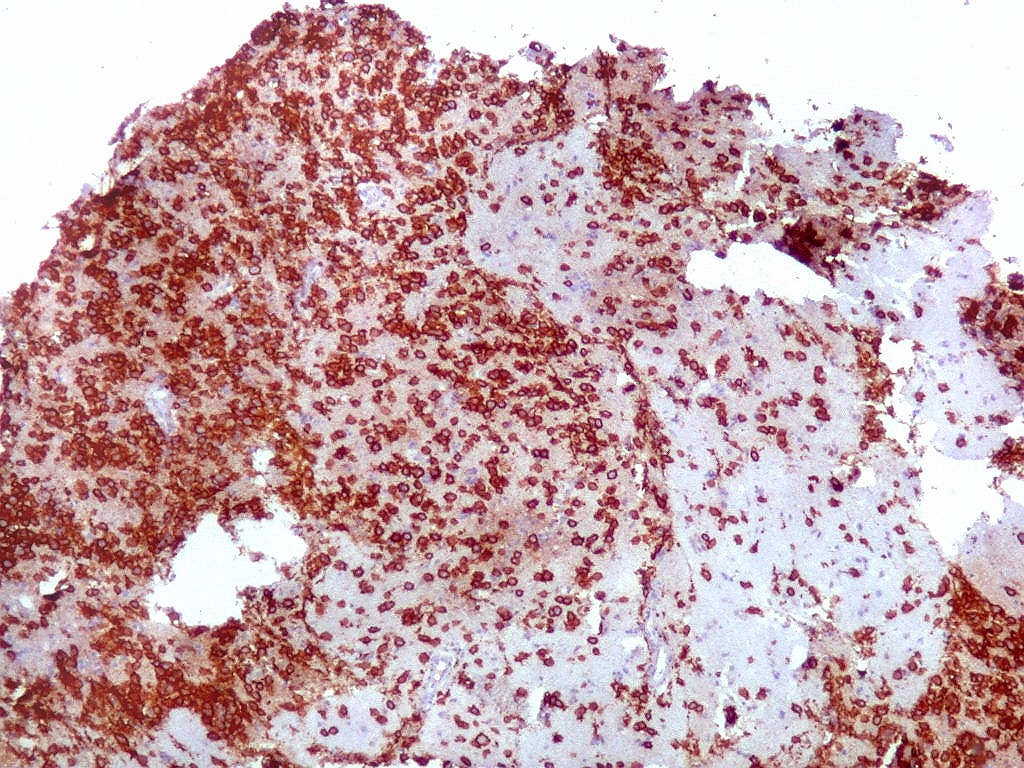
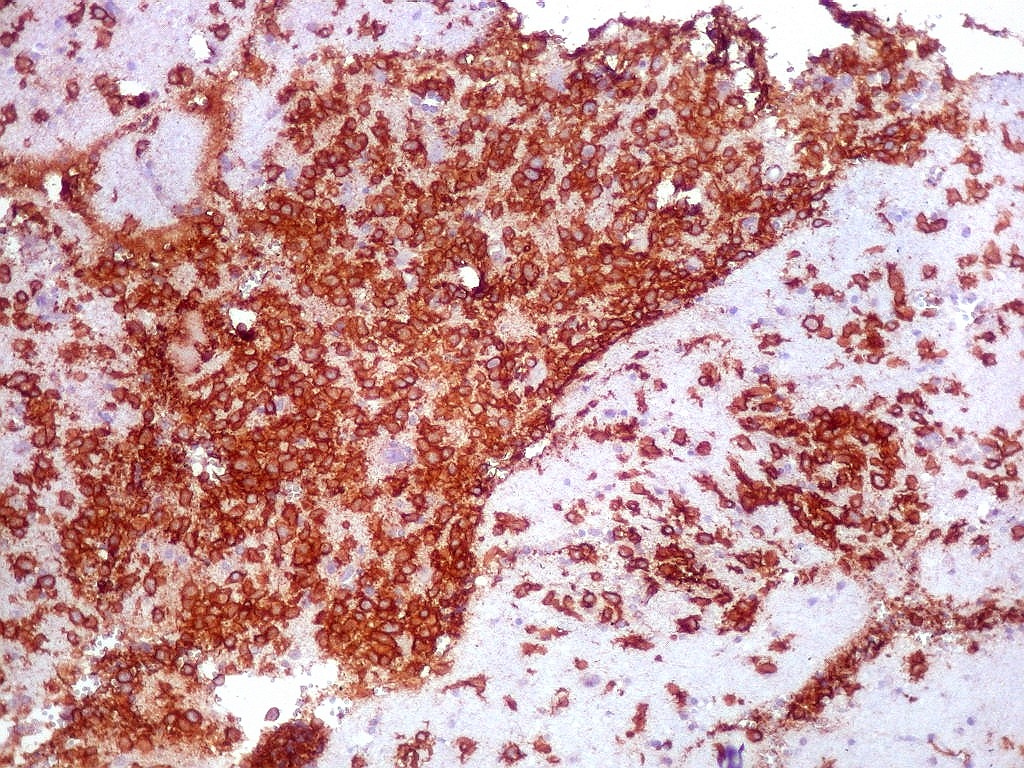
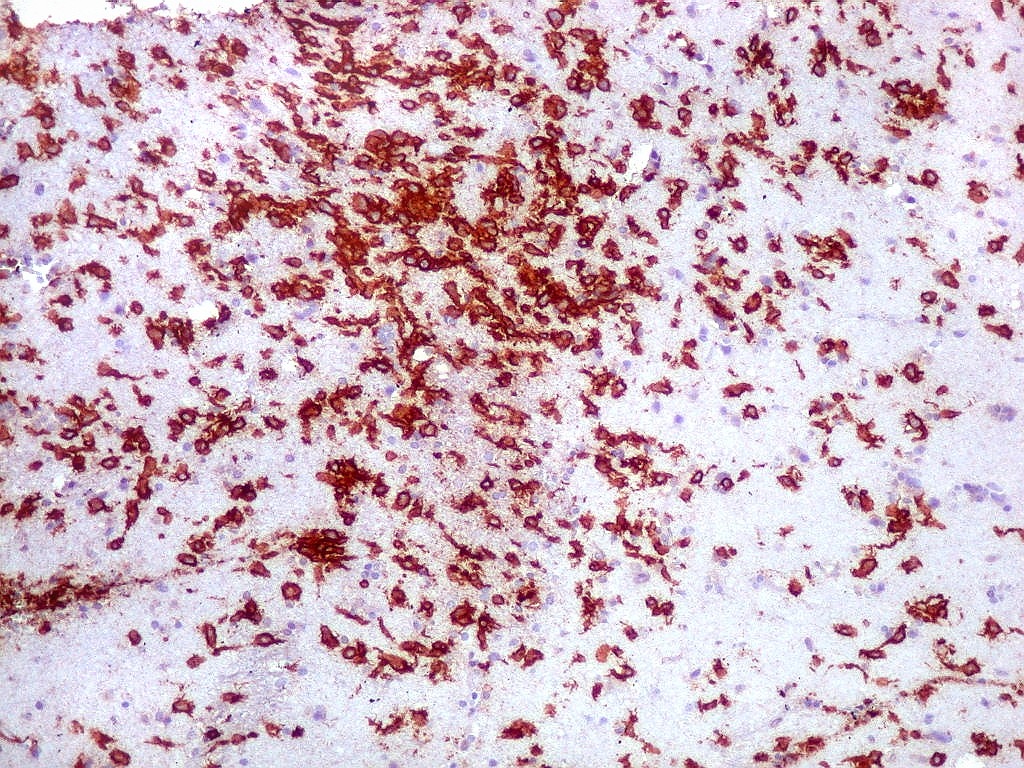
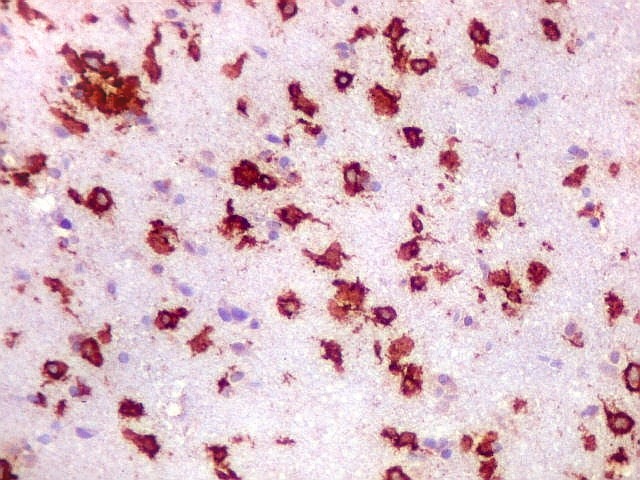
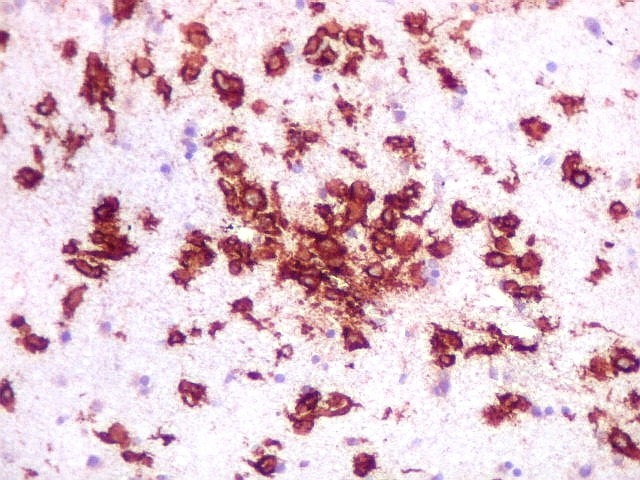
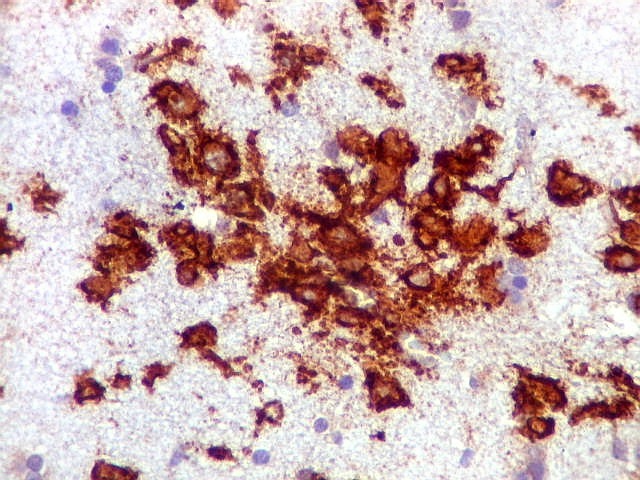
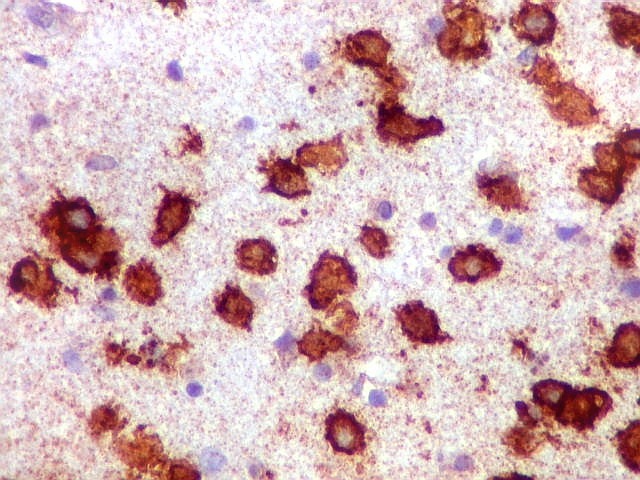
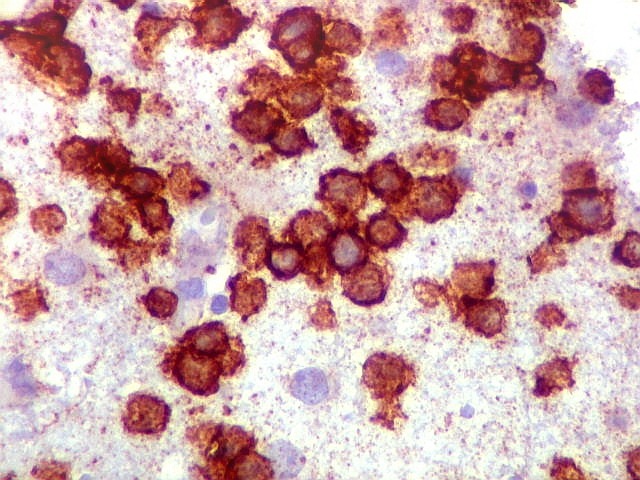
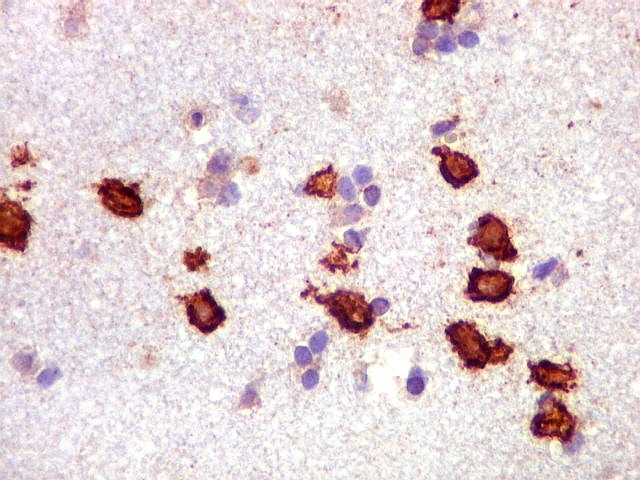
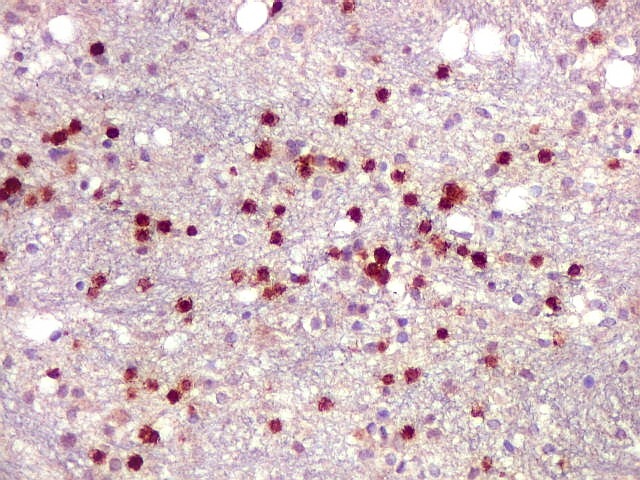
| CD20.
Este marcador de linfócitos B foi extensamente positivo nas células neoplásicas, demonstrando o caráter marcadamente infiltrativo do tumor. A concentração de células variava com a área, mas em nenhum ponto foram observados manguitos perivasculares. |
 |
 |
 |
 |
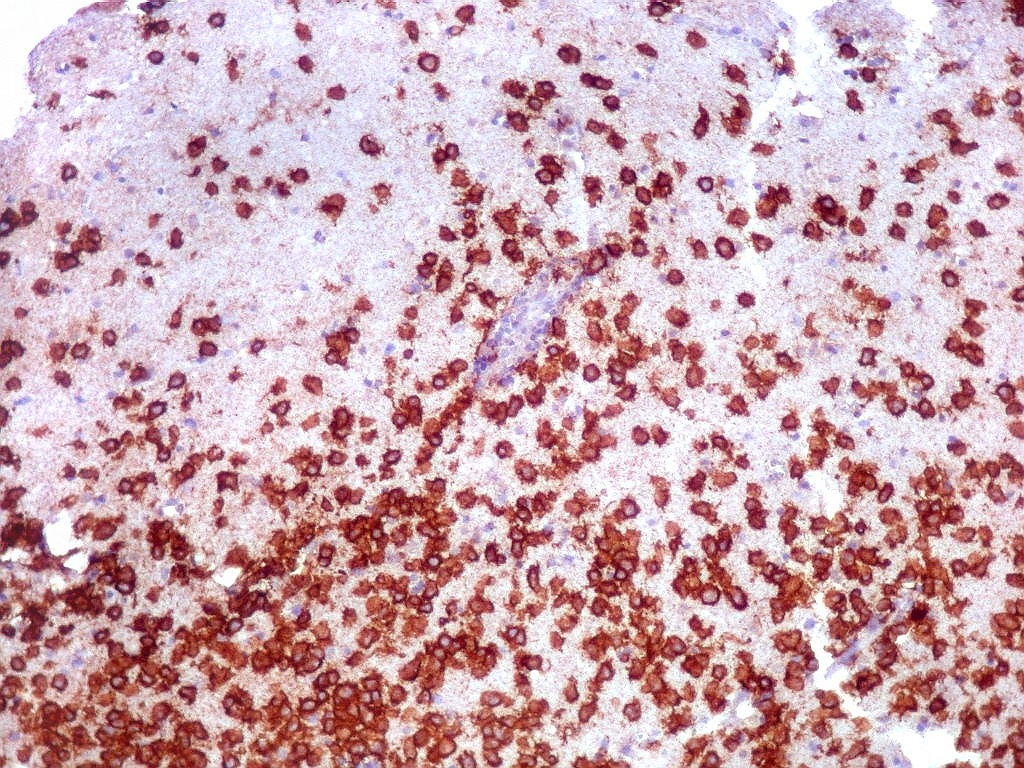 |
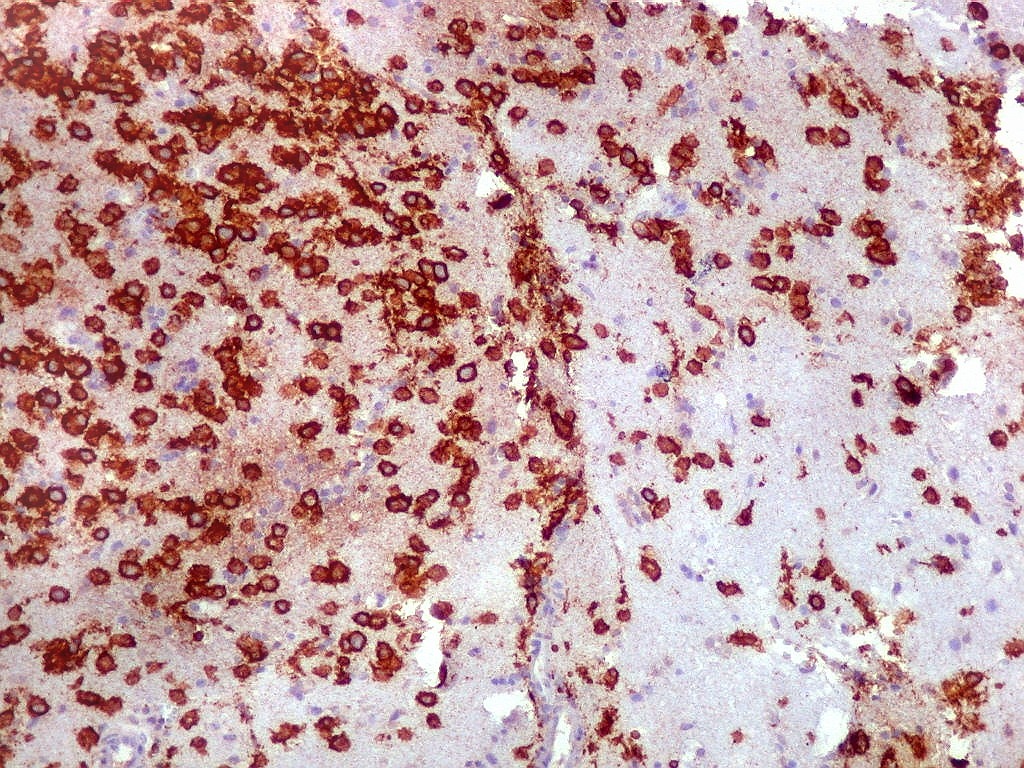
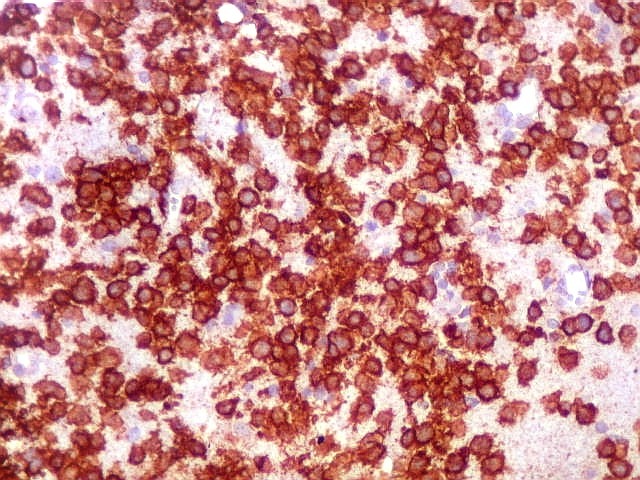
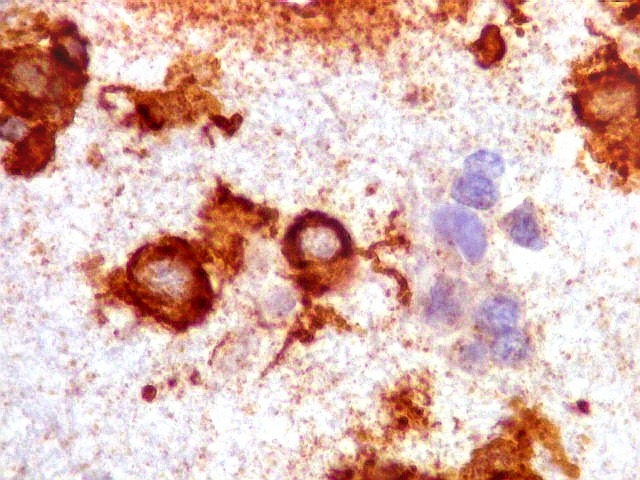
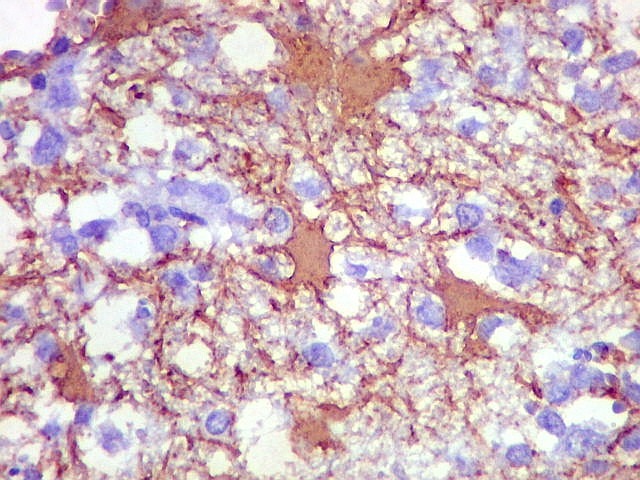
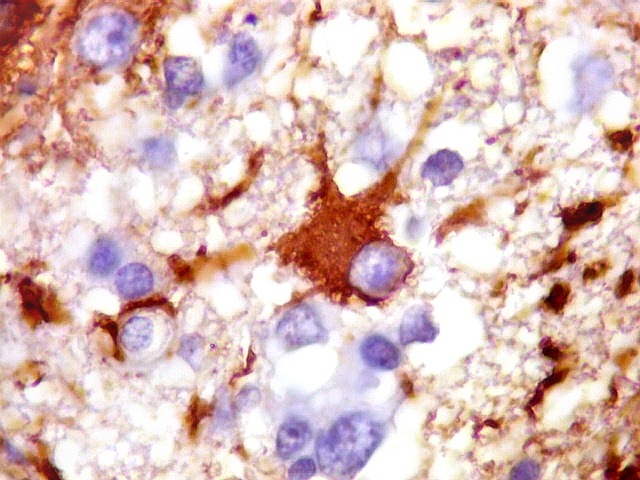
| CD20. Abaixo, campos ilustrando a marcada variação de celularidade em diferentes áreas do tecido nervoso infiltrado. | |
 |
 |
 |
 |
 |
 |
 |
 |
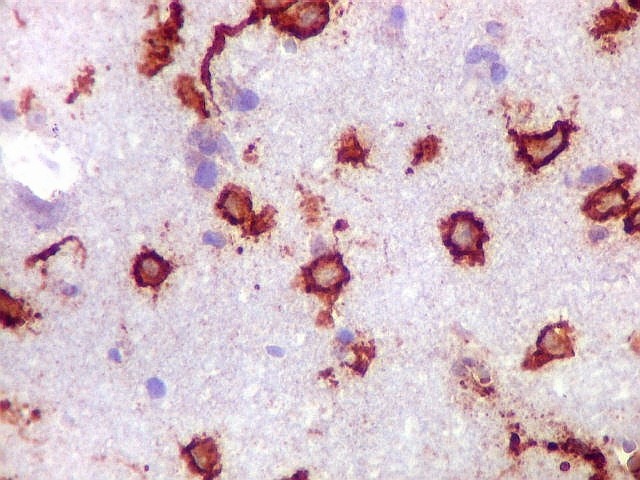
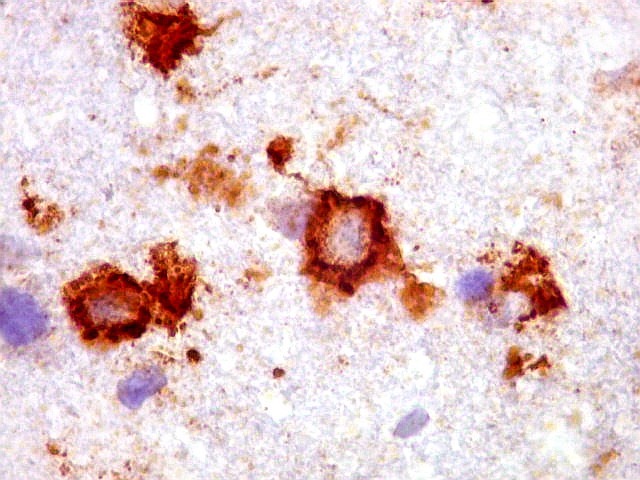
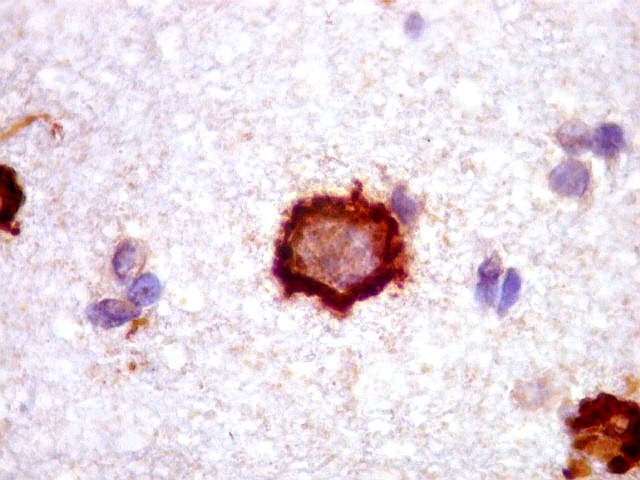
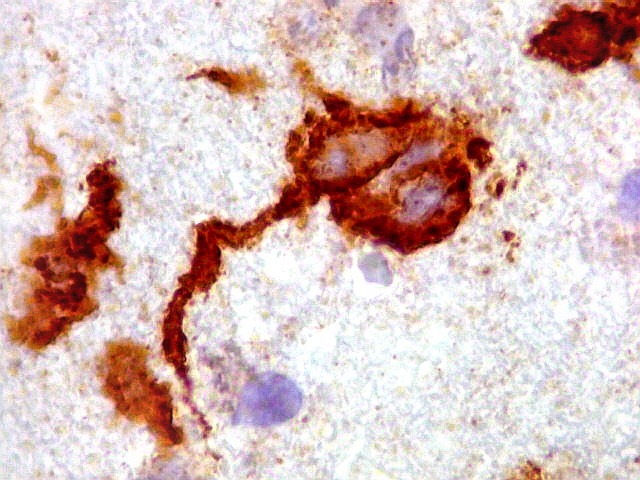
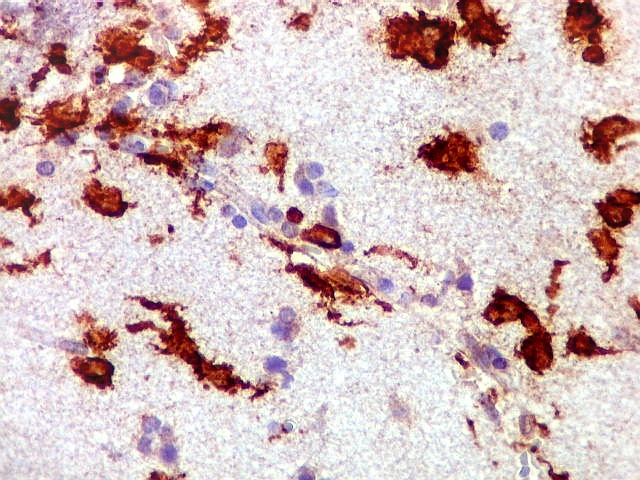
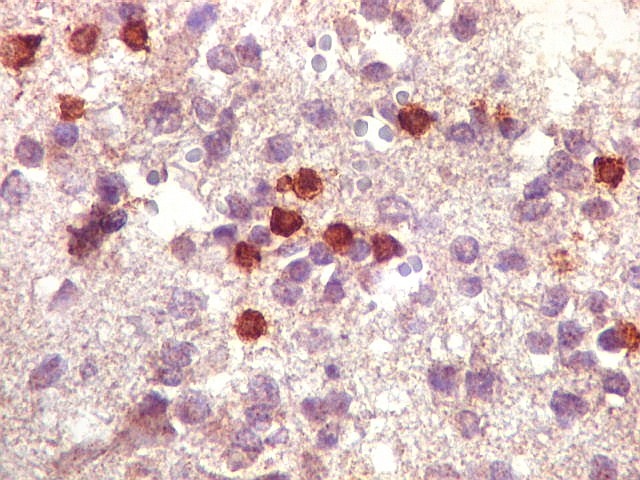
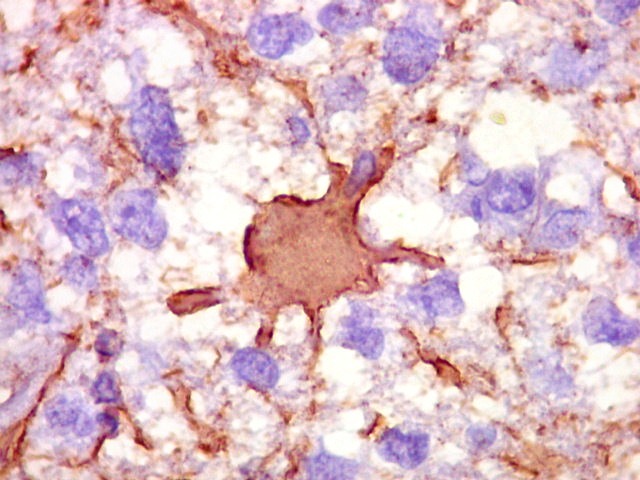
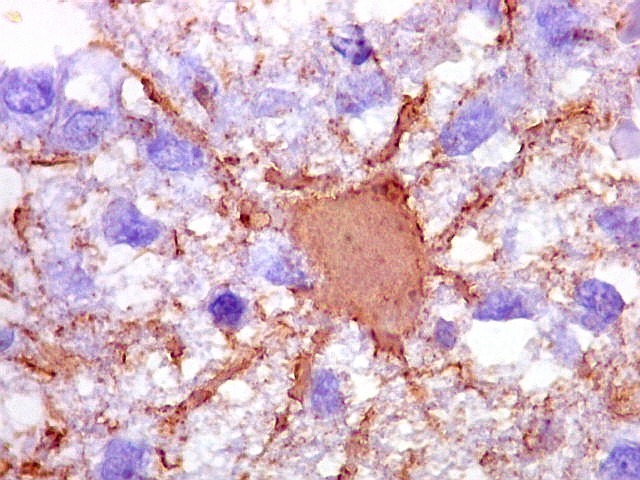
| CD20.
Morfologia das células neoplásicas.
As células são geralmente arredondadas, com núcleos grandes que não se marcam para CD20, um antígeno de membrana. Algumas células mostram curiosas projeções deste revestimento externo, por vezes até com ramificações. |
 |
 |
 |
 |
 |
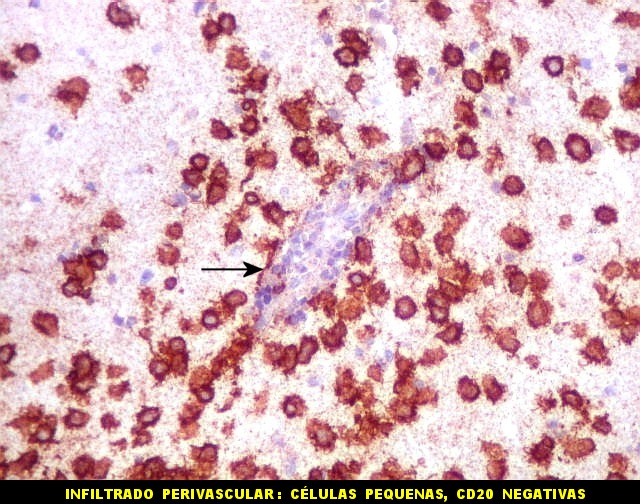
| CD20. Ausência de manguitos perivasculares. Ao contrário do esperado, as células neoplásicas não se concentram em torno de vasos, formando as características coroas ricas em fibras reticulínicas. Nos poucos vasos com infiltrado linfocitário, este não era de células neoplásicas. São células com núcleos pequenos, que não marcam para CD20. | |
 |
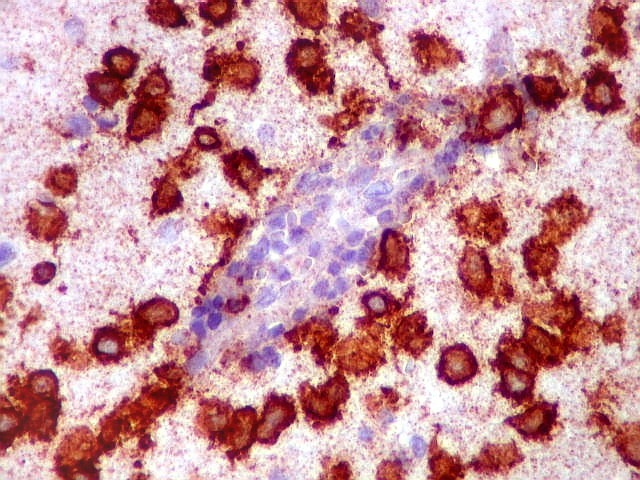 |
 |
 |
 |
 |
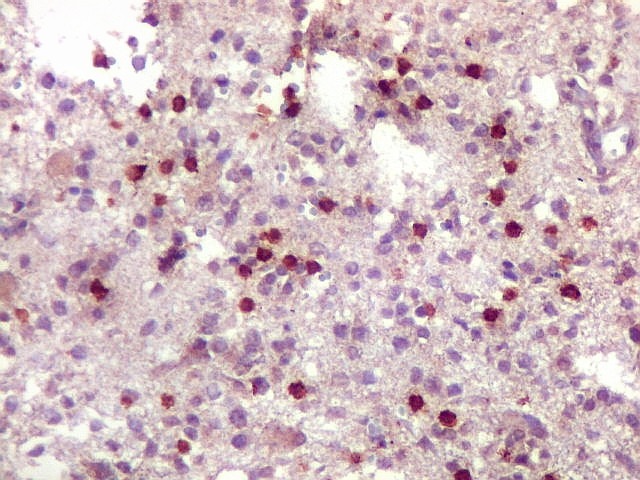
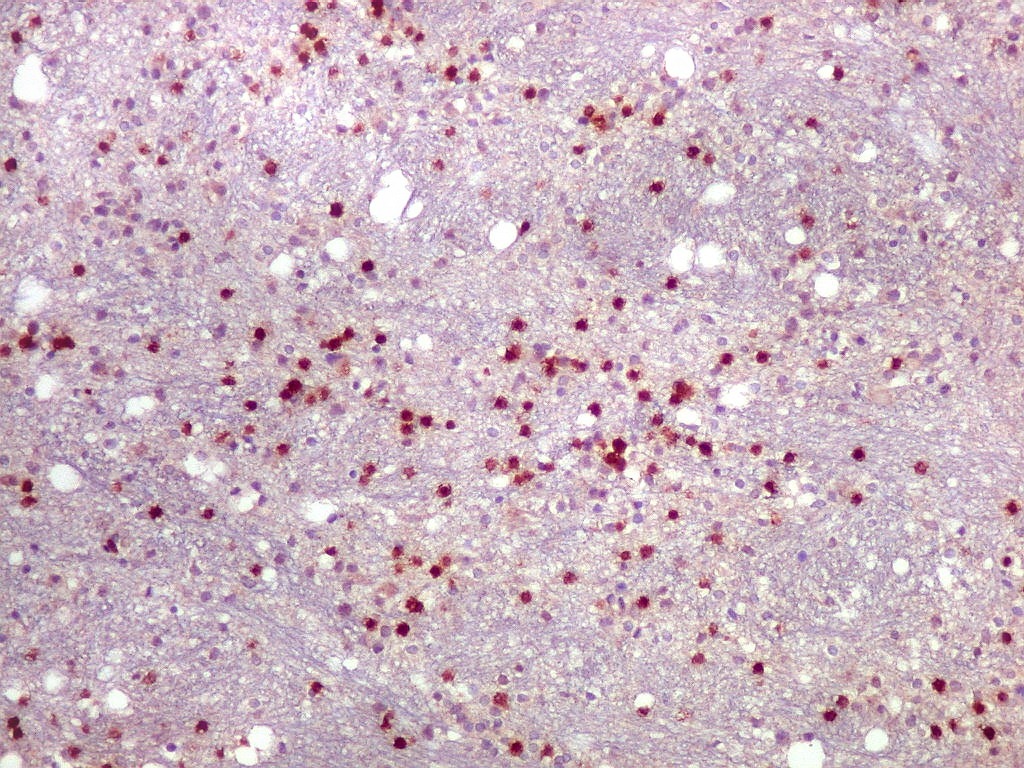
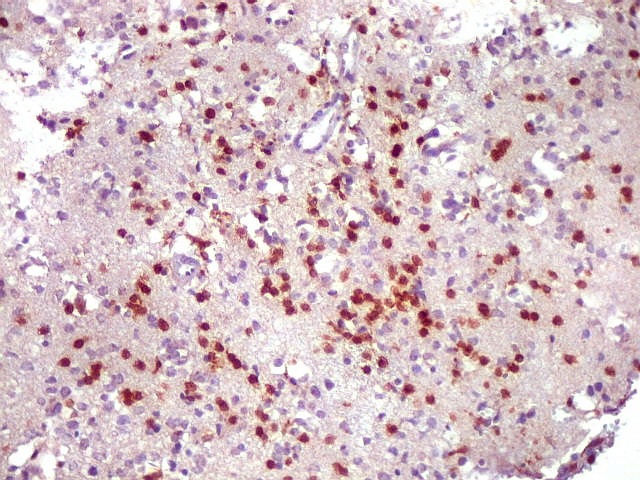
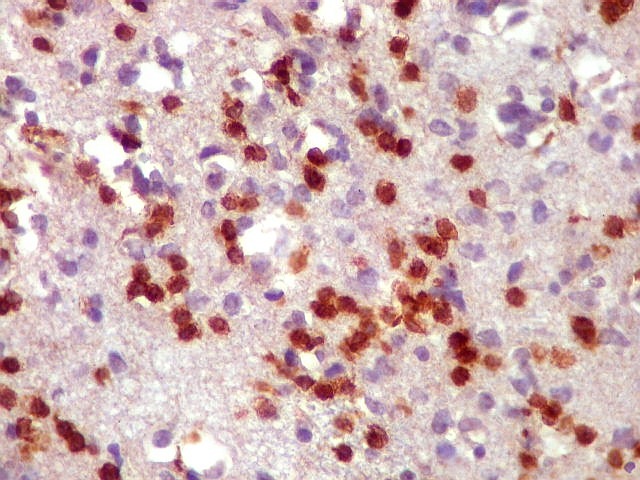
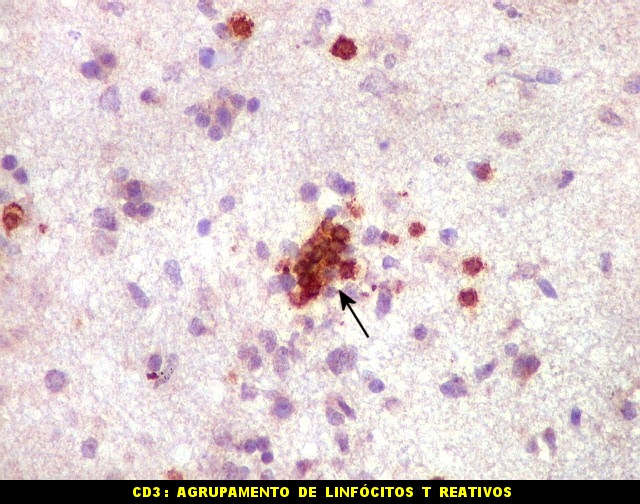
| CD3.
Há uma população significativa de linfócitos T, demonstrados pelo antígeno CD3, no tecido infiltrado pelo linfoma. São células pequenas, menores que os linfócitos B neoplásicos, e seus núcleos aparecem muito pouco, ficando encobertos pelo produto da reação imunohistoquímica. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
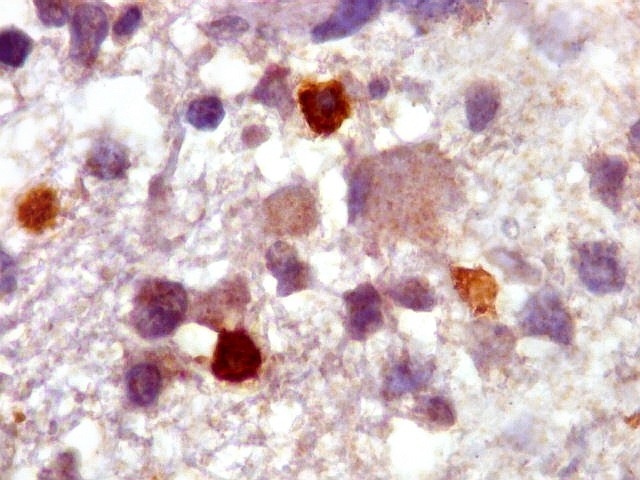 |
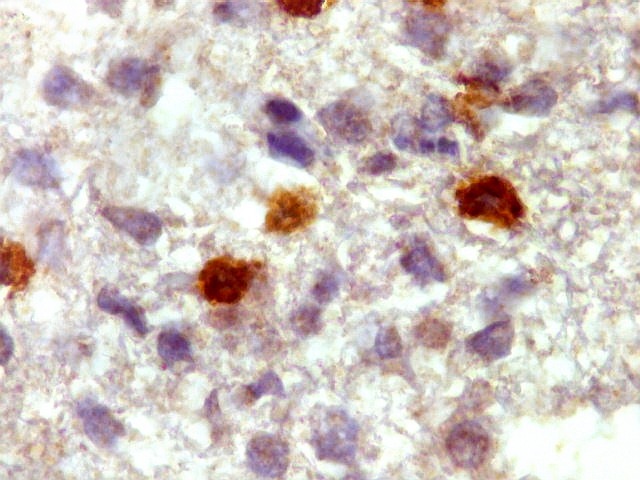
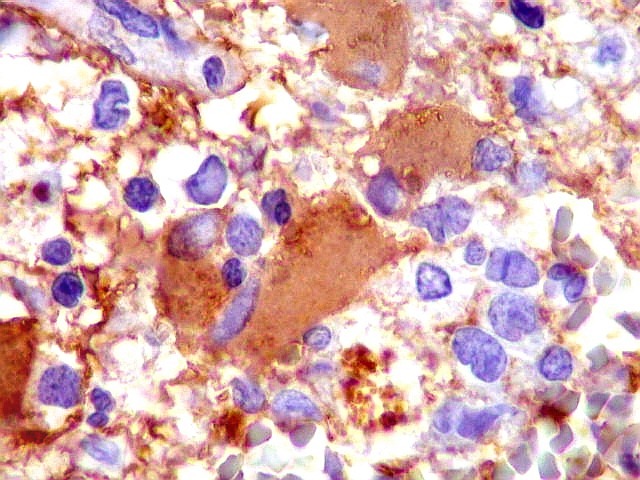
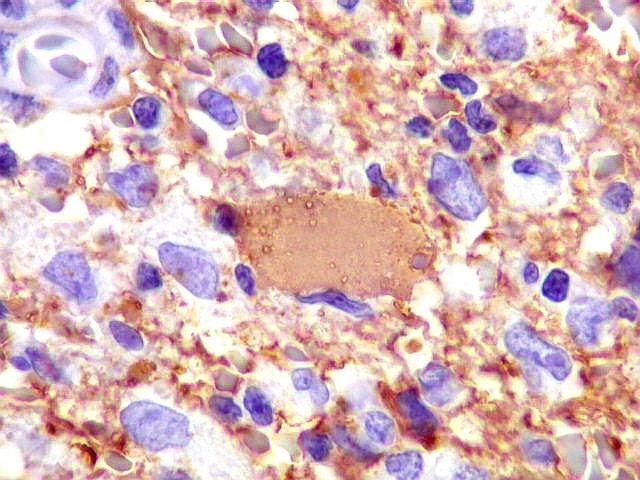
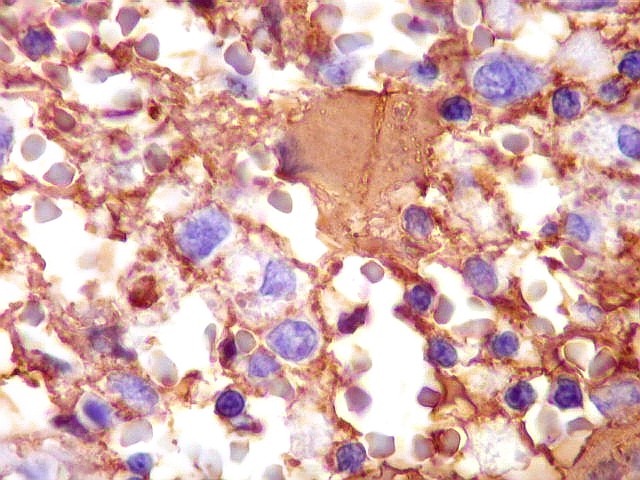
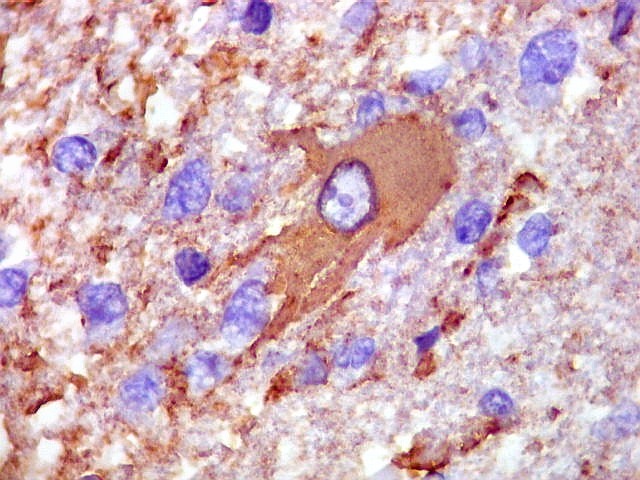
| GFAP. Demonstra astrócitos reacionais em meio ao tecido nervoso infiltrado pelo linfoma. Todos os astrócitos na amostra são hipertróficos, com abundante citoplasma que se marca para GFAP (proteína glial ácida fibrilar), o filamento intermediário característico destas células. Os núcleos são deslocados para a periferia, sendo algumas células binucleadas. | |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
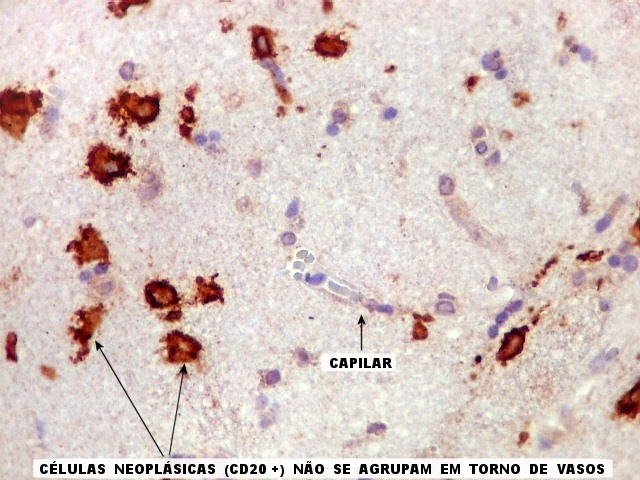
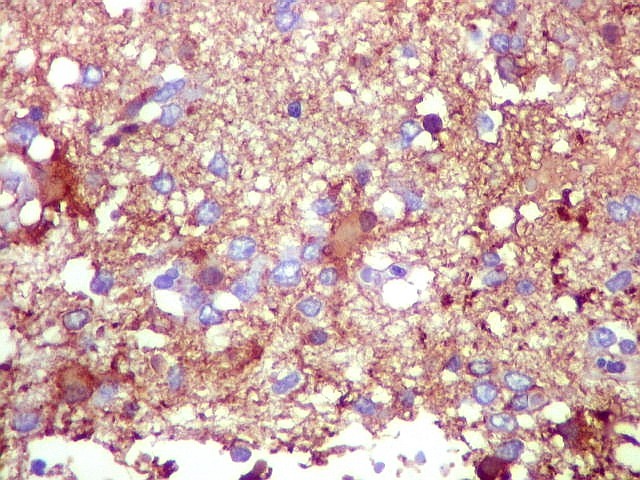
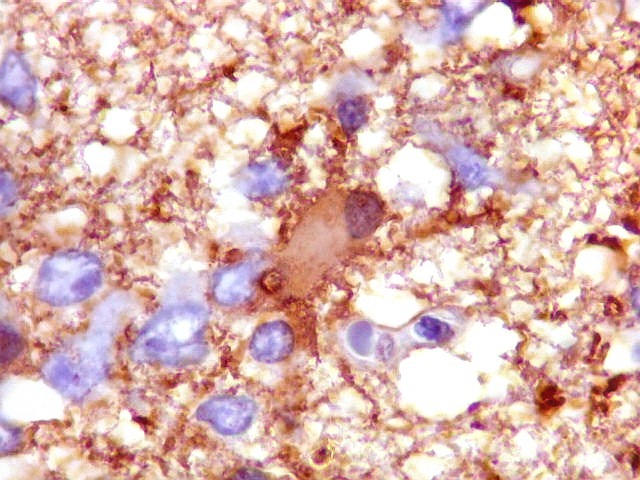
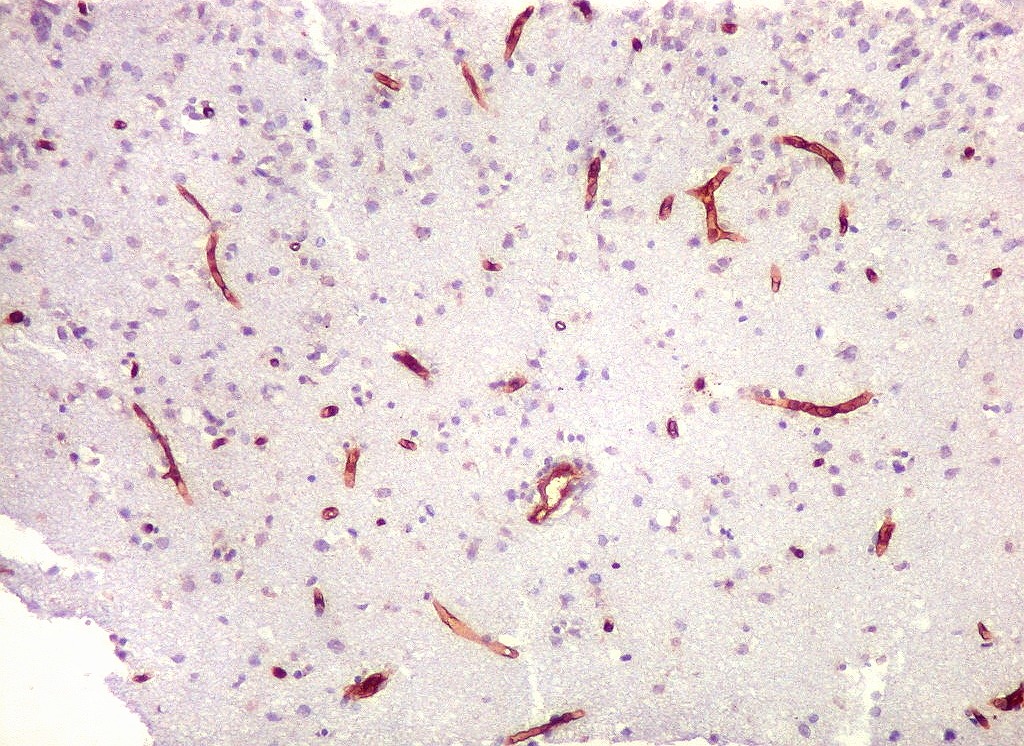
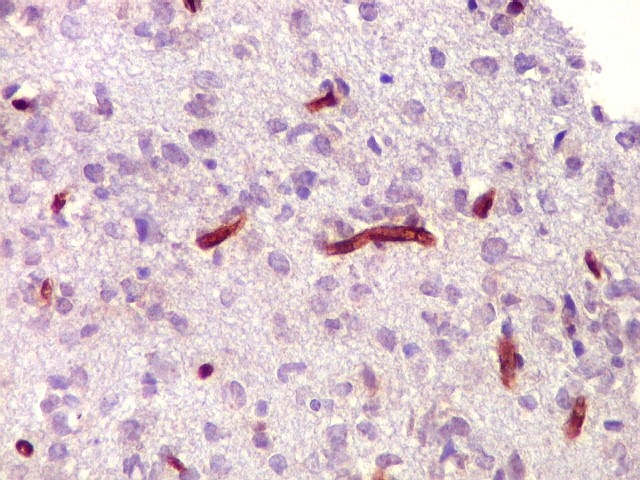
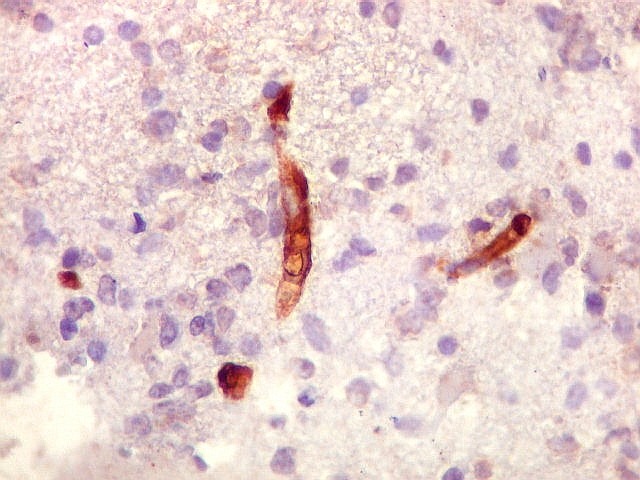
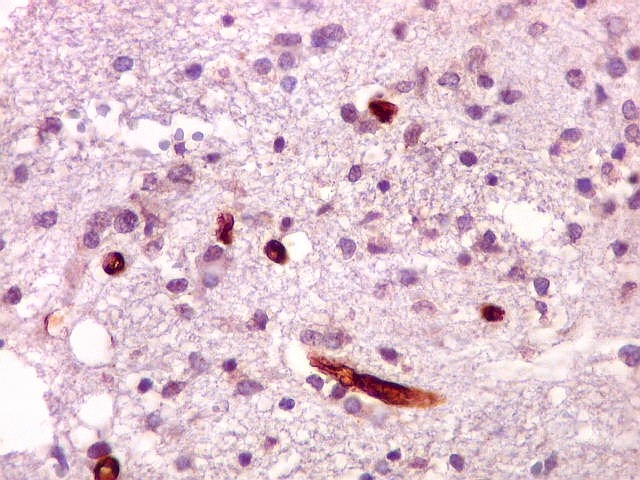
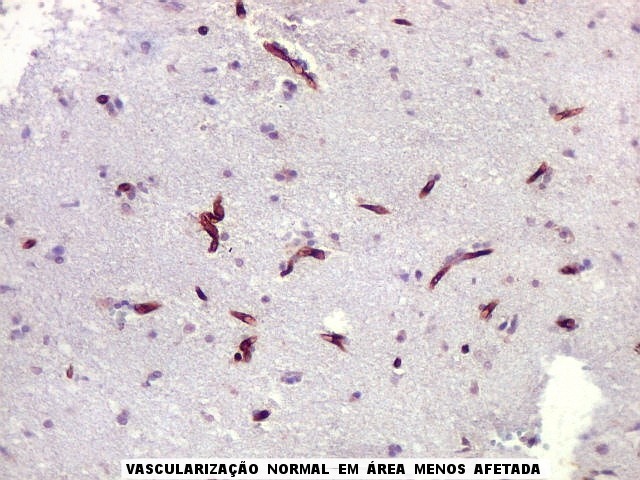
| CD34.
Este marcador de endotélio é útil para ressaltar os capilares no tecido. No presente caso, os vasos são de padrão normal, finos, com ramificação dicotômica e regularmente espaçados. Não há evidência de proliferação endotelial. Células neoplásicas não se agrupam em torno dos vasos. |
 |
 |
 |
 |
 |
 |
 |
 |
 |
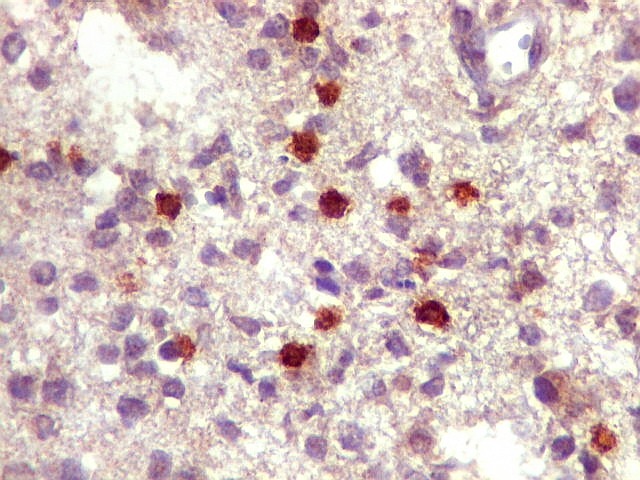
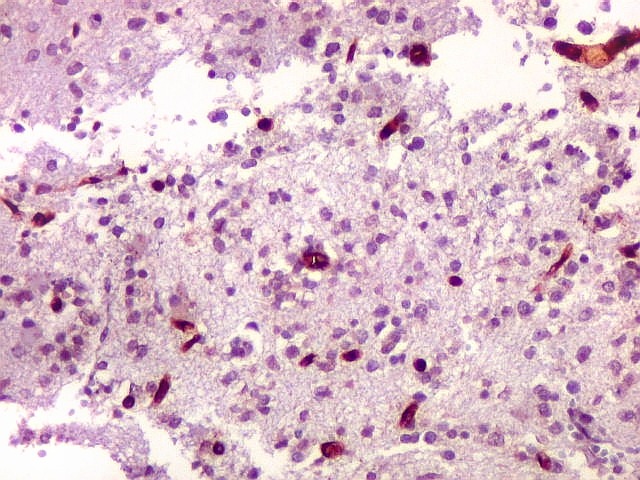
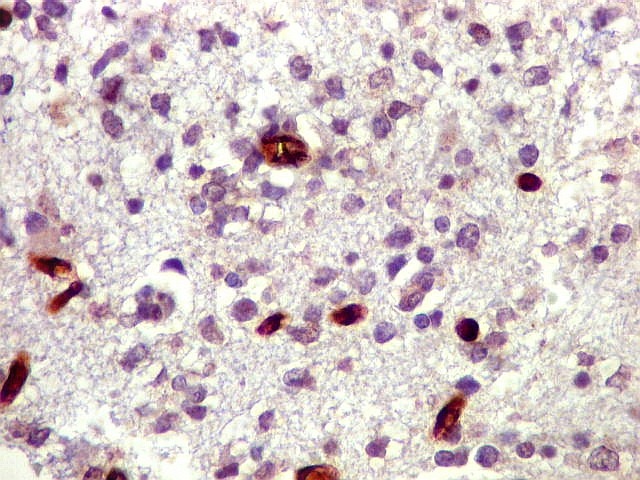
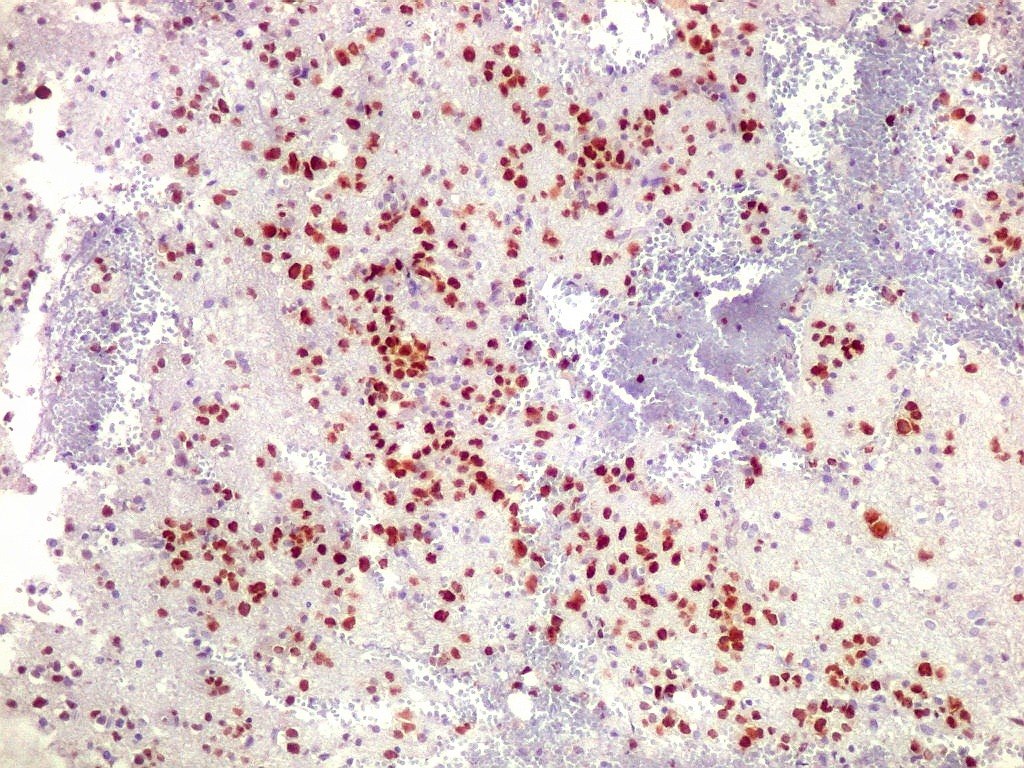
| Ki-67.
Há marcação de alta proporção dos núcleos de linfócitos neoplásicos, próxima de 100%, o que qualifica este linfoma como de altíssimo índice proliferativo (alto grau histológico). Os núcleos não marcados são menores e pertencem a pequenos linfócitos reativos ou células próprias do tecido infiltrado. |
 |
| Linfomas
primários do sistema nervoso central.
Definição. Linfomas malignos originados no sistema nervoso central (SNC) na ausência de linfoma fora do sistema nervoso. Linfomas primários do SNC foram pela primeira vez descritos por Bailey em 1929. Termos antigos hoje abandonados incluíram sarcoma peritelial, reticulossarcoma e microglioma. Incidência. Aumentou dramaticamente em conseqüência da epidemia de AIDS, de 0,8 – 1,5% a até 6,6% das neoplasias intracranianas primárias. Antes da moderna terapia antiviral, a incidência em pacientes de AIDS era de 4,7 por 1000 pacientes ano, ou 3600 vezes maior que na população geral. De 2 a 12% dos pacientes de AIDS desenvolviam linfomas primários do SNC. A terapia reduziu drasticamente a incidência de linfomas primários e secundários nos pacientes de AIDS. Idade e sexo. Linfomas primários do SNC afetam todas idades. Em pacientes imunocompetentes o pico de incidência é na 6a. e 7a. décadas com preferência pelo sexo masculino 3 : 2. Em imunodeficientes, varia com a causa. Em imunodeficiência hereditária, 10 anos. Em transplantados 37 anos, em AIDS 39 anos, sendo nestes 90% sexo masculino. Etiologia. O vírus de Epstein-Barr (EBV) tem importante papel nos linfomas primários do SNC de imunodeficientes. O genoma do EBV está presente em mais de 95% dos casos, em comparação a 0 a 20% dos imunocompetentes. Células de linfoma infectadas expressam EBNA 1-6, LMP1 (a principal oncoproteína do EBV) e EBER1 e 2. Localização. Cerca de 60% dos linfomas primários do SNC envolvem o espaço supratentorial, incluindo: lobos frontais (15%), temporais (8%), parietais (7%) e occipitais (3%), núcleos da base e regiões periventriculares (10%), corpo caloso (5%). A fossa posterior é envolvida em 13% e a medula espinal em 1%. As lesões são múltiplas em 25 a 50% , este índice atingindo 60 a 85% nos imunodeficientes. Disseminação leptomeníngea é vista em 30-40%. Linfoma leptomeníngeo primário corresponderia a 8% dos casos, mas linfomas primários durais ou epidurais são muito raros. Há doença ocular em 15-20%, podendo preceder as lesões intracranianas. Metástases à distância ocorrem em 6-10%. Linfomas secundários do SNC ocorrem preferencialmente na dura e leptomeninges, mas podem ocorrer também lesões parenquimatosas. Clínica. Em 50-80% dos pacientes com linfomas primários do SNC a doença se manifesta como déficits neurológicos focais, sintomas neuropsiquiátricos em 20-30%, hipertensão intracraniana em 10-30% e convulsões em 5 a 20%. Pode haver sintomas oculares em 5 a 20%. Linfoma angiotrópico manifesta-se como demência rapidamente progressiva com déficits neurológicos multifocais. Imagem. Ressonância magnética é o método de escolha. As lesões são hiperintensas em T2, FLAIR e difusão e impregnam-se fortemente por contraste. Focos subependimários simétricos de hipersinal são sugestivos de linfoma. Edema perilesional é menos marcado que em gliomas e metástases. As lesões podem desaparecer rapidamente com corticosteróides, às vezes em horas. Diagnóstico. Biópsia estereotáxica é o método de escolha e a única intervenção cirúrgica utilizada em linfomas primários do SNC. Tentativa de ressecção das lesões, mesmo parcial, associa-se a pior sobrevida. A menos que haja risco de herniação eminente, a biópsia deve ser feita antes da administração de corticóides, pois isto pode levar a amostras inconclusivas, sem células diagnósticas. A melhora com corticóides é dramática, mas geralmente só temporária. Macro. Linfomas primários do SNC aparecem como massas únicas ou múltiplas, freqüentemente profundas ou adjacentes ao sistema ventricular. Há grande variação de aspectos e do grau de delimitação em relação ao tecido nervoso adjacente, podendo assemelhar-se a gliomas ou até a metástases. Formas difusamente infiltrativas podem ser chamadas de linfomatose cerebral. Micro. A grande maioria dos linfomas primários do SNC são classificados como linfoma não Hodgkin difuso de grandes células B (92 a 98% dos casos), que expressam CD20, um marcador pan-B. Em aumento fraco, a periferia do tumor mostra a típica infiltração angiocêntrica, em que as células neoplásicas formam os característicos manguitos perivasculares com depósitos de reticulina (estes demonstrados por impregnação pela prata). A partir destes manguitos as células neoplásicas infiltram o parênquima nervoso, em geral difusamente, lembrando uma encefalite. Pode haver extensas áreas de necrose coagulativa. São comuns alterações reacionais de astrócitos (gemistócitos) e micróglia (macrófagos, células grânulo-adiposas). Há também infiltrados reativos de pequenos linfócitos T. As células B neoplásicas são grandes, blásticas, com núcleos volumosos e pleomórficos, e nucléolos proeminentes, correspondendo a centroblastos ou imunoblastos. A atividade proliferativa segundo o índice Ki-67 é da ordem de 50 a 70% e até > 90%. Apoptose é detectada na maioria dos casos e aumenta dramaticamente com corticoterapia. Mutação do gene p53 é rara. Histogênese. Não é conhecido se a origem de linfomas primários do SNC seria dentro ou fora do cérebro. Há 3 hipóteses. 1) As células B seriam transformadas fora do SNC e desenvolveriam moléculas de adesão específicas para endotélio cerebral; 2) As células linfomatosas sistêmicas seriam erradicadas por um sistema imune competente fora do SNC, mas uma vez localizadas neste, poderiam escapar da imunovigilância. 3) Uma lesão inflamatória policlonal do SNC pode expandir-se de forma clonal e se transformar em uma neoplasia monoclonal. Tratamento e prognóstico. Usa-se quimioterapia sistêmica e intraventricular, associada a radioterapia. Há graves efeitos colaterais, com leucoencefalopatia e atrofia córtico-subcortical. Os resultados são piores em pacientes acima dos 60 anos. Sobrevida mediana de 50 meses. Em pacientes antes dos 60 anos, sobrevida de 5 anos chega a 75%. Em pacientes com AIDS, com antivirais e RT a sobrevida mediana é de 36 meses. Envolvimento secundário do SNC em linfomas e leucemias sistêmicas. A freqüência varia de 2 a 27% em diferentes séries, provavelmente em torno de 5%. Na maioria dos casos, o envolvimento secundário se manifesta como doença meníngea, dural ou leptomeníngea, às vezes envolvendo o córtex superficialmente. O envolvimento profundo periventricular, classicamente visto nos linfomas primários do SNC, é raro. Fontes Deckert M, Paulus W. Malignant lymphomas. In WHO Classification of Tumours of the Central Nervous System. 4th Ed. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK (eds). International Agency for Research on Cancer, Lyon, 2007. pp 188-92. Paulus W, Perry A. Lymphomas and Histiocytic Tumors. Chapter 14. In Perry A, Brat DJ (eds). Practical Surgical Neuropathology. Churchill Livingstone Elsevier, 2010. p. 321. |
| Para RM desta paciente, clique » |  |
| Neuropatologia
- Graduação |
Neuropatologia -
Estudos de casos |
Neuroimagem
- Graduação |
Neuroimagem -
Estudos de Casos |
Roteiro
de aulas |
Textos
de apoio |
Correlação
Neuropatologia - Neuroimagem |
| Índice alfabético - Neuro | Adições recentes | Banco de imagens - Neuro | Textos ilustrados | Neuromuscular | Patologia - outros aparelhos | Pages in English |
|
|
|
|