|
|
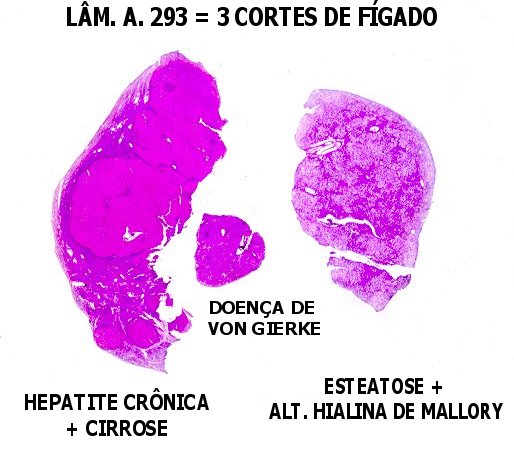
Doença de von Gierke Lam. A. 293, corte menor |
|
|
|
Doença de von Gierke Lam. A. 293, corte menor |
|
 |
|
|
|
|
 |
 |
 |
|
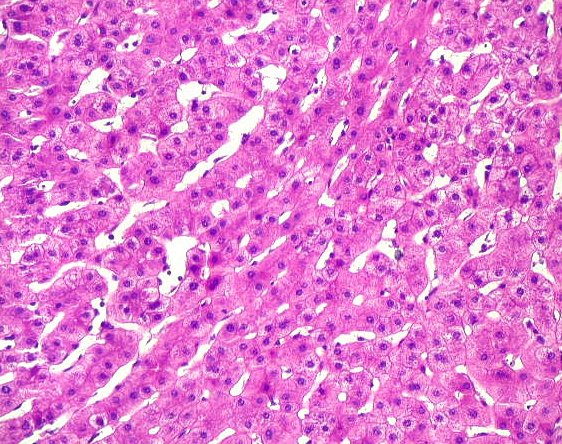
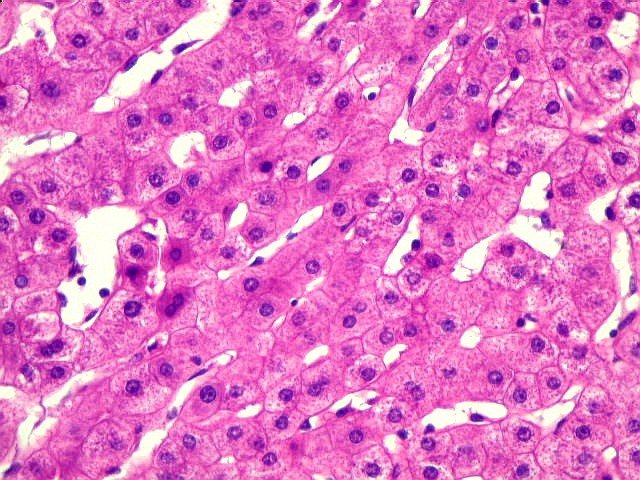
| Lâm.
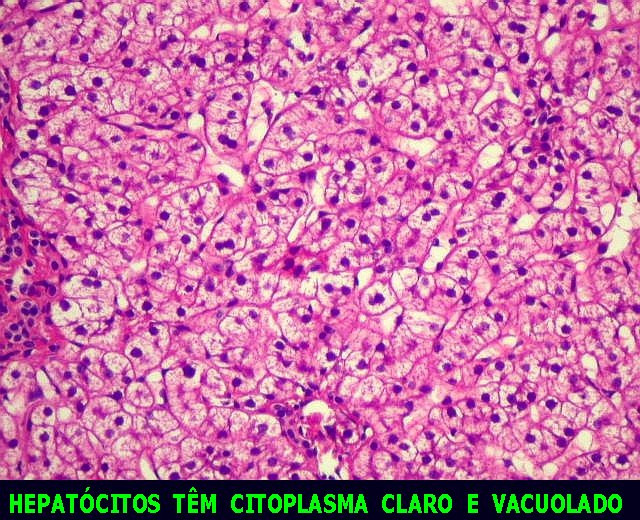
A. 293, corte menor, do meio. Glicogenose
hepática tipo I ou doença de von Gierke. Esta
lâmina de fígado mostra acúmulo de glicogênio
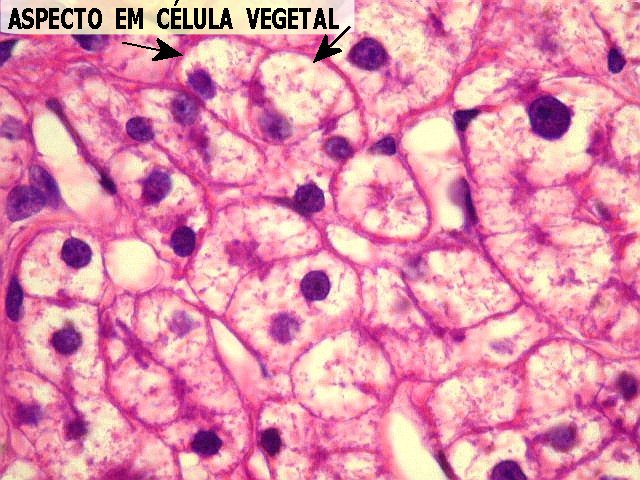
em hepatócitos, que ficam com citoplasma claro e vacuolado (aspecto
em célula vegetal). O material foi obtido por biópsia em
cunha, fixado em formol, incluído em parafina, e os cortes foram
corados por hematoxilina e eosina. O glicogênio, sendo hidrossolúvel,
dissolveu-se no fixador, que é aquoso. Temos, portanto, a imagem
após a retirada do glicogênio. O aspecto vazio do citoplasma
foi comparado ao de uma célula vegetal, onde a maior parte
do volume celular é ocupado por um vacúolo aquoso.
Os filamentos róseos, que contrastam com o aspecto vazio do citoplasma,
correspondem a organelas, como mitocôndrias e retículo endoplasmático.
O núcleo tende a permanecer central.
Para demonstrar efetivamente o glicogênio seria necessário fixar o fragmento em um fixador não aquoso (p. ex., álcool absoluto). Neste caso, o glicogênio, sendo insolúvel em álcool, permaneceria no interior das células e poderia ser revelado por um corante como o carmim de Best, ou por uma reação histoquímica, como o ácido periódico + reativo de Schiff (PAS). Para ver o resultado desta reação em uma glicogenose muscular, a doença de McArdle, clique aqui. A causa destas alterações é uma deficiência genética da enzima glicose-6-fosfatase, a última enzima da via de degradação do glicogênio, antes de sua liberação como glicose no sangue. A enzima é codificada por um par de gens autossômicos. É necessária a falta de ambos para que a doença se manifeste (portanto, herança autossômica recessiva). |
|
|
|
|
 |
 |
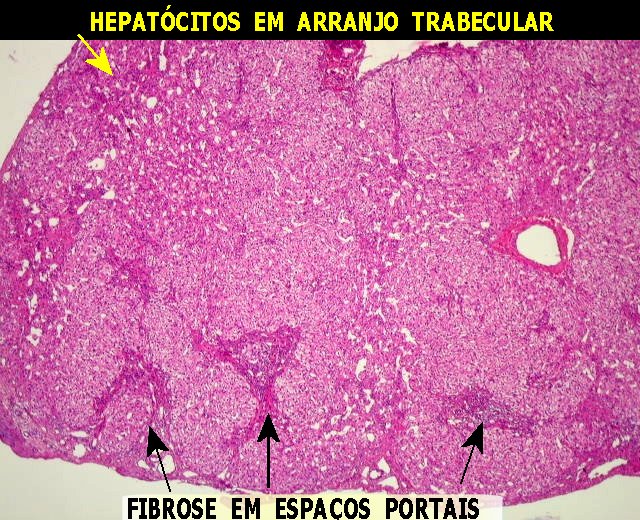
| Lâm. A. 293, corte maior. Hepatócitos normais no corte maior da mesma lâmina. Estes hepatócitos têm citoplasma bem distribuído. O aspecto finamente granuloso é devido às várias organelas presentes no citoplasma. (Embora a lâmina seja de cirrose (que será estudada em outro capítulo), os hepatócitos têm estrutura normal). | |
|
A falta das enzimas do metabolismo do glicogênio acarreta várias doenças autossômicas recessivas chamadas glicogenoses. Há pelo menos 12 já descritas. Exemplos: Doença de Von Gierke: glicogenose do tipo I, por deficiência de glicose-6-fosfatase em hepatócitos e células tubulares renais. • Notada geralmente em torno dos dois anos de idade.Patogênese: A glicose 6-fosfatase é a última enzima da via de degradação do glicogênio no fígado para dar glicose. A enzima retira o grupo fosfato da posição 6 da molécula da glicose 6-fosfato. A glicose pode atravessar a membrana do hepatócito, mas a glicose 6-fosfato não pode. Conseqüentemente, acumula-se dentro do hepatócito, retardando toda a via de degradação e retendo o glicogênio, que passa a ser abundante no hepatócito, dando o aspecto em célula vegetal quando retirado por fixadores aquosos como o formol. O aumento do volume dos hepatócitos leva a aumento do fígado como um todo (hepatomegalia). A hipoglicemia é explicada pela falta de liberação da glicose no sangue. Doença de McArdle: glicogenose do tipo V, por deficiência de fosforilase em fibras musculares esqueléticas. • Notada geralmente na idade adulta.Patogênese: A fosforilase é a primeira enzima da via de degradação do glicogênio. Na sua falta, a fibra muscular tem dificuldade em obter energia através de glicólise anaeróbica. Normalmente, a fibra usa ATP gerado no ciclo de Krebs, que é muito mais abundante, mas requer O2 como aceptor de hidrogênio na cadeia respiratória. Em casos de trabalho muscular intenso, a fibra lança mão da glicólise anaeróbica (cada glicose resultando em 2 piruvatos + 2 ATP). Na falta de fosforilase, a fibra pode ficar sem ATP para mover suas bombas iônicas e pode até sofrer necrose (morte celular). Isto explica a incapacidade em realizar exercícios intensos e prolongados e ocorrência de dores e câimbras nos músculos exercitados. |
|
|
|
|
|
|
|
|
|
|
|
|
|