|
|
(PNET) temporal E |
|
|
|
(PNET) temporal E |
|
| Aspecto geral do tumor. | |
| Neoplasia indiferenciada, consistindo em sua quase totalidade de pequenas células com núcleos ovalados ou arredondados, e citoplasma escasso de limites indefinidos. As células estão compactamente arranjadas, sem formar estruturas rosetóides. Há proliferação vascular e necrose. |
| Atipias nucleares. Pouco comuns, predominando monotonia celular. | |
| Atividade mitótica, apoptose. Figuras de mitose numerosas, na maioria típicas. Muitas células em apoptose. | |
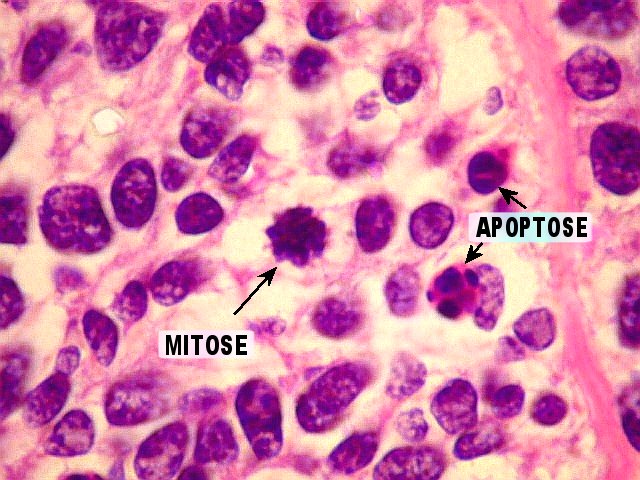 |
|
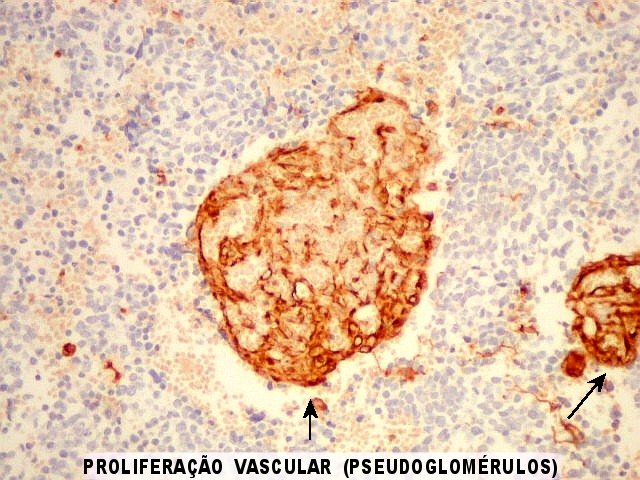
| Proliferação vascular. Vasos espessos, com redução da luz. Os núcleos são tumefeitos, com cromatina frouxa, indicando atividade metabólica. Algumas mitoses são observadas nestas estruturas. | |
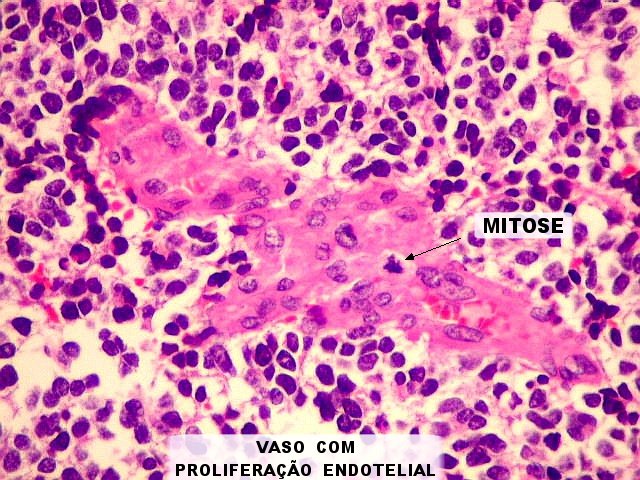 |
|
| Necroses em pseudopaliçada. Semelhantes às observadas no glioblastoma multiforme, provavelmente resultam da proliferação vascular notada acima. | |
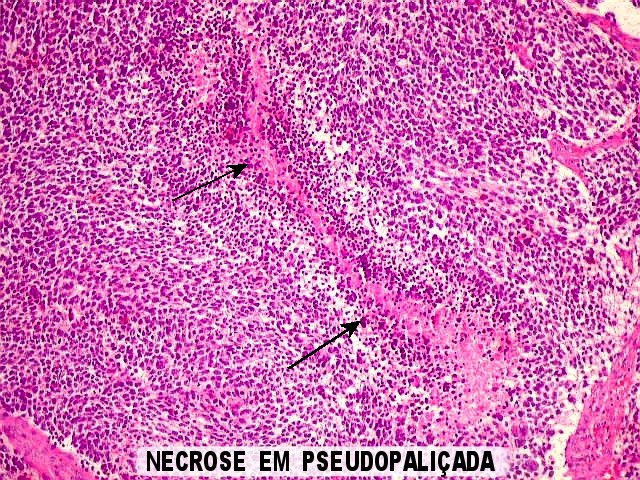 |
|
| IMUNOHISTOQUÍMICA |
| QUADRO
DE RESUMO.
Células neoplásicas isoladas são positivas para marcadores de astrócitos: GFAP, VIM, S100. |
||
 |
 |
 |
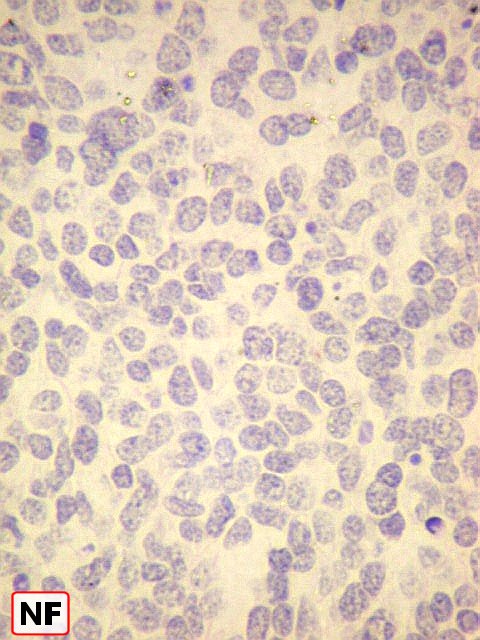
| Marcadores de neurônios : células positivas para NSE, SNF, negativas para NF. | ||
 |
 |
 |
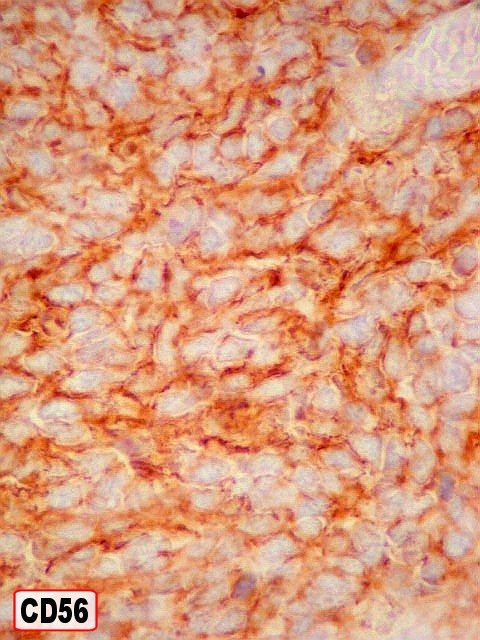
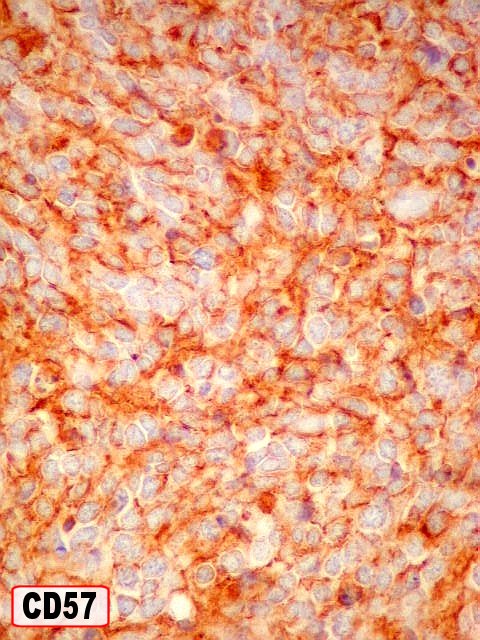
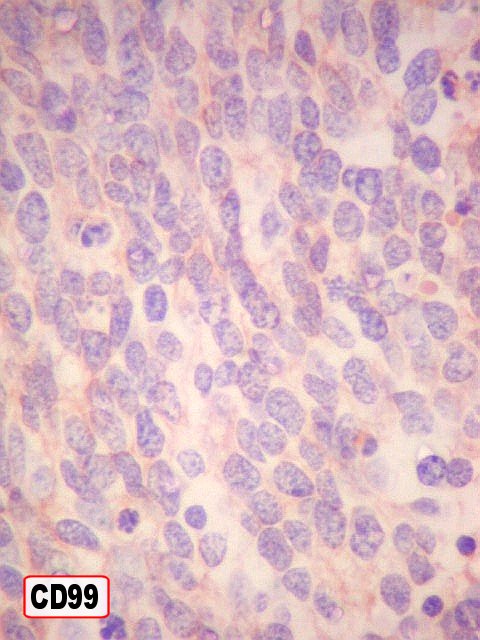
| Outros marcadores neuroectodérmicos/neuroendócrinos : células positivas para CD56, CD57 (Leu-7), negativas para CD99 (próprio de PNETs periféricos). | ||
 |
 |
 |
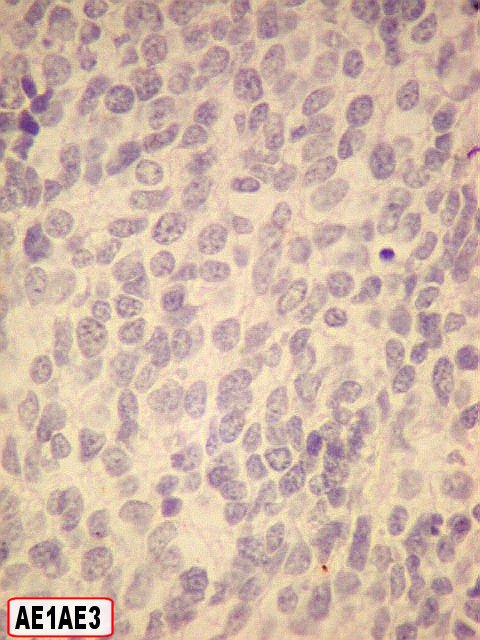
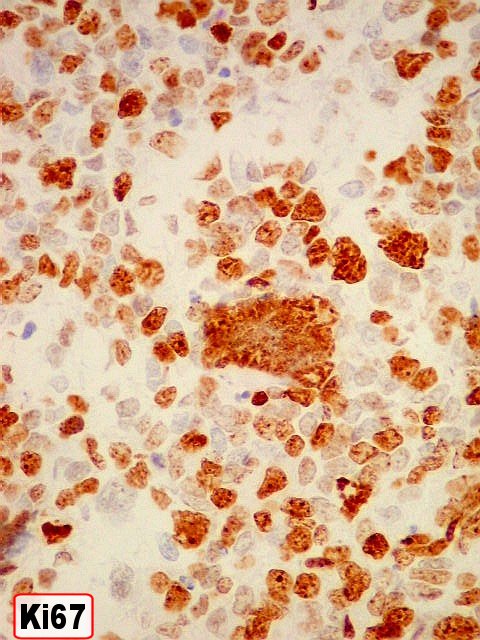
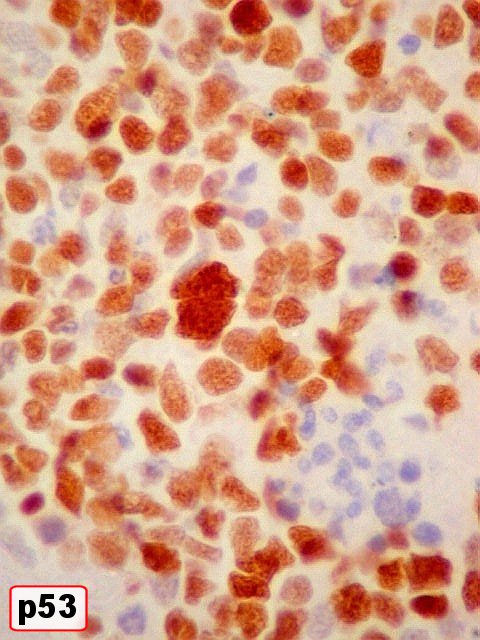
| Marcador epitelial : AE1AE3 - negativo. | Marcadores de proliferação celular : Ki67, p53 fortemente positivos. | |
 |
 |
 |
| Comentário.
Trata-se
de tumor altamente indiferenciado na HE, sem formar estruturas sugestivas
de tumor neural, como pseudorosetas
do tipo neuroblástico (de Homer Wright). Com imunohistoquímica,
mostra indícios de diferenciação neuroectodérmica
(positividade para CD56 e CD57). Usando marcadores mais específicos,
há
diferenciação divergente para astrócitos
e neurônios, geralmente em células isoladas. Portanto,
apresenta feições semelhantes às dos meduloblastomas,
o principal PNET intracraniano, exclusivo do cerebelo, onde também
se observa positividade para antígenos gliais e neuronais (clique,
para exemplos (1) (2).
Interpretamos este caso, portanto, como um raro exemplo de tumor neuroectodérmico primitivo (PNET) supratentorial. Em comparação, os glioblastomas , mesmo muito indiferenciados, são forte e difusamente positivos para GFAP, VIM e S100 (não só em células isoladas como neste caso) e negativos para SNF (que foi positiva em células isoladas neste caso). São, assim, claramente definidos como de linhagem glial. Abaixo, mais imagens e detalhes das reações imunohistoquímicas. |
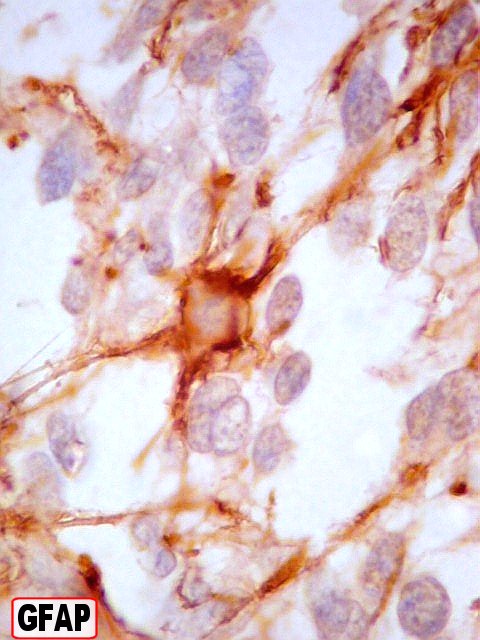
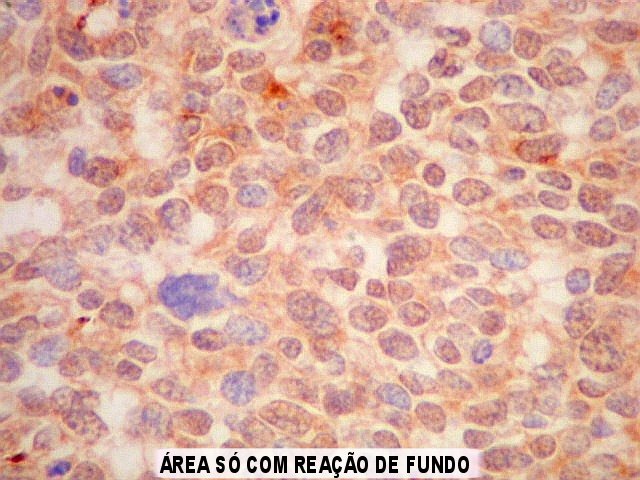
| GFAP. Na maior parte da amostra havia leve positividade difusa, interpretada como reação de fundo. Se ficasse só nisso, seria negativo. Contudo, em certa área, havia marcação forte de células isoladas e seus prolongamentos, que não raro mostravam relação com vasos, definindo-as como células de linhagem astrocitária. Houve dúvida se se tratava de células pré-existentes em tecido infiltrado. Isto foi afastado em função do pequeno tamanho e escasso citoplasma das células. Se fosse tecido infiltrado esperaríamos astrócitos reativos do tipo gemistocítico, com citoplasma mais abundante. | |
 |
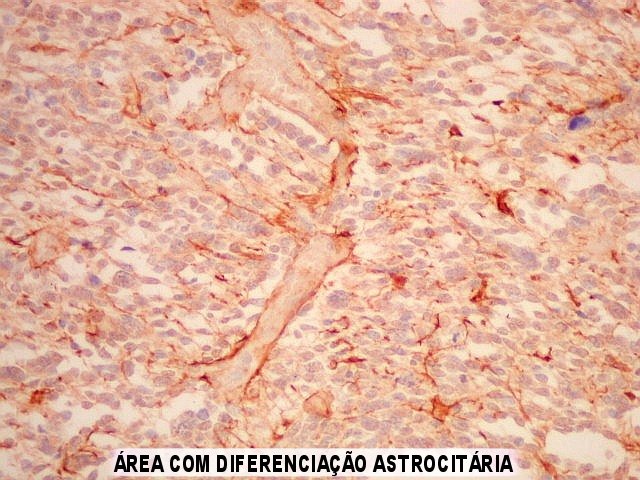 |
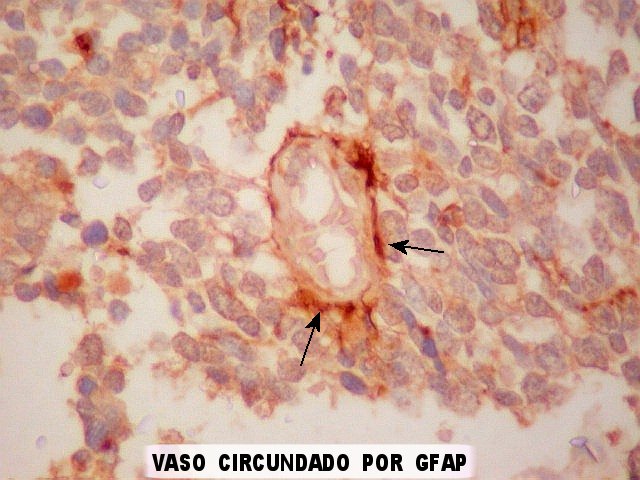
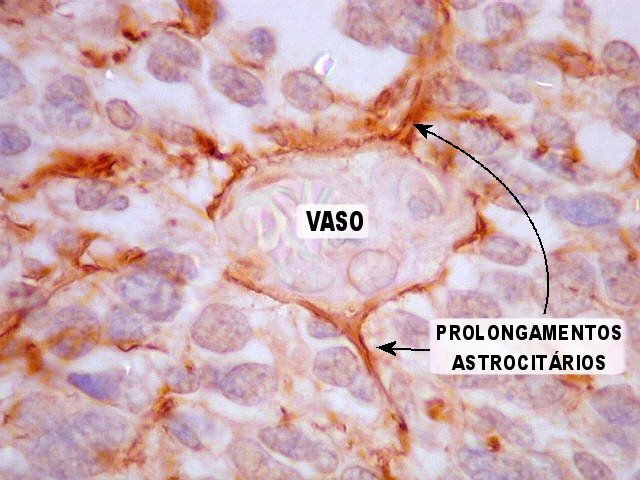
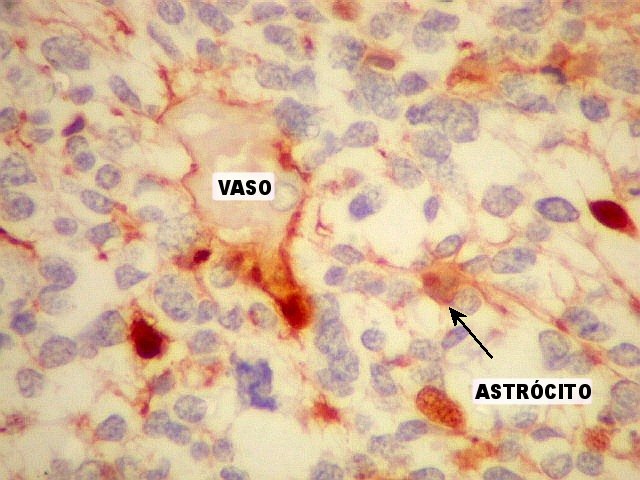
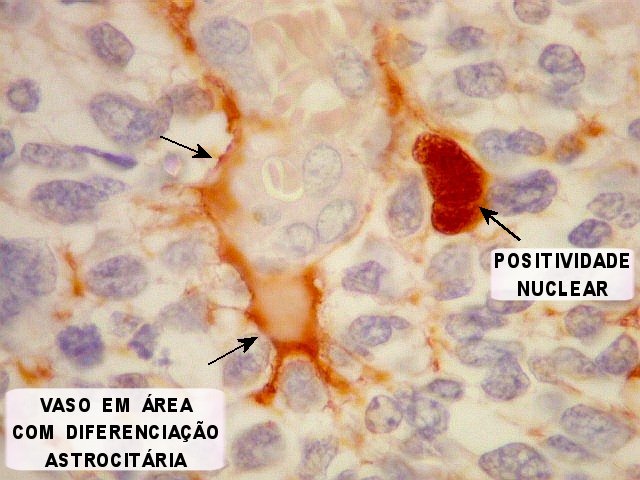
| Vasos mostram-se delineados por material GFAP positivo, que corresponde a prolongamentos astrocitários. Vários astrócitos com prolongamentos, alguns em relação com vasos, são observados. | |
 |
|
 |
|
| GFAP. Astrócitos em vários graus de diferenciação. A maior parte das células neoplásicas não exprime GFAP. As poucas que expressam vão desde uma fina orla citoplasmática com prolongamentos curtos e rudimentares até células bem diferenciadas, com prolongamentos múltiplos, mostrando crescente complexidade. | |
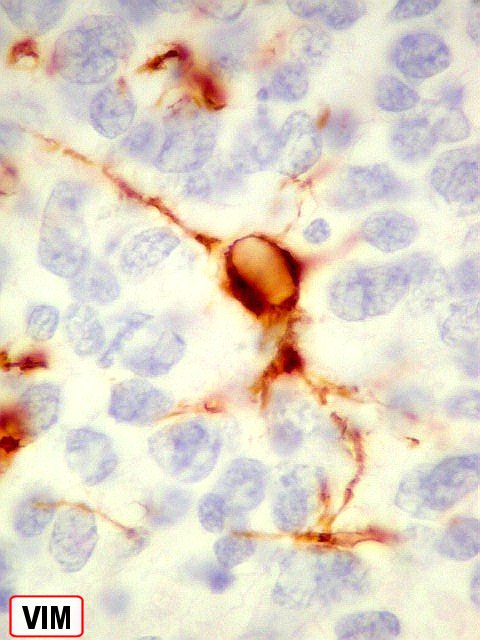
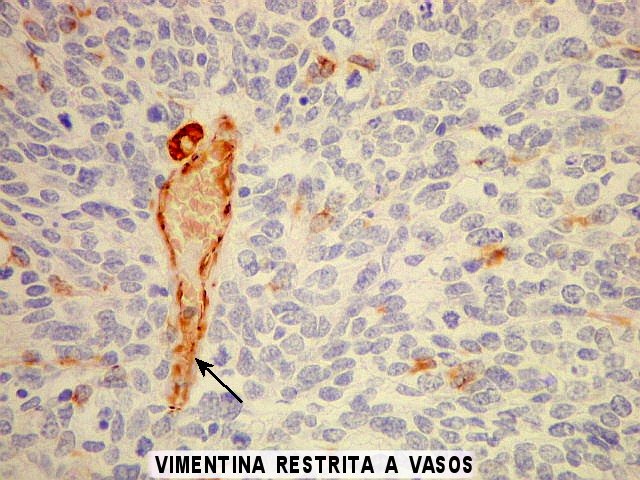
| VIM. Na maioria das áreas, vimentina está restrita aos vasos e não é expressa pelas células neoplásicas. Porém, na mesma área de diferenciação astrocitária vista acima com GFAP, havia astrócitos expressando VIM, desde fina orla citoplasmática até células bem diferenciadas. | |
 |
|
 |
|
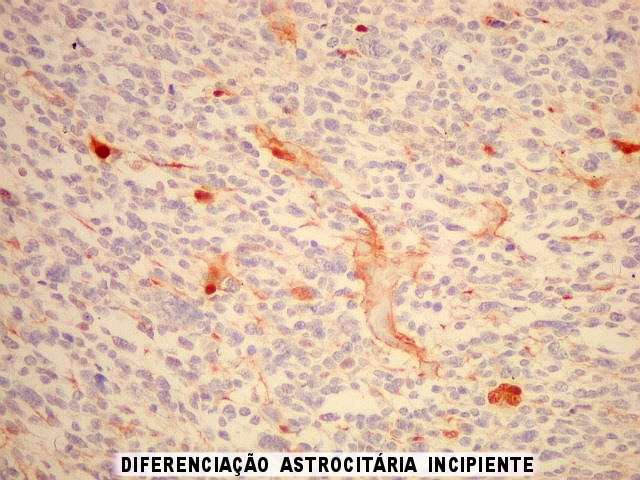
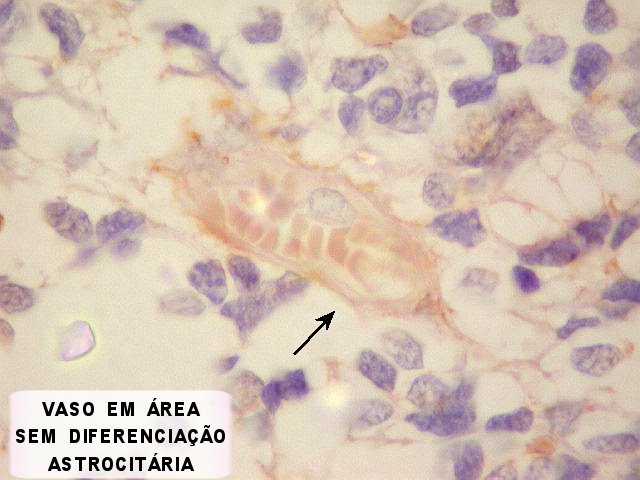
| Área de diferenciação astrocitária incipiente. Notam-se prolongamentos astrocitários dirigindo-se aos vasos. | |
|
|
|
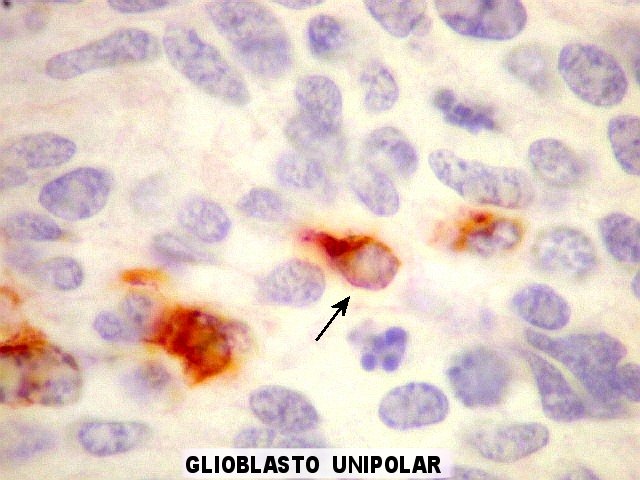
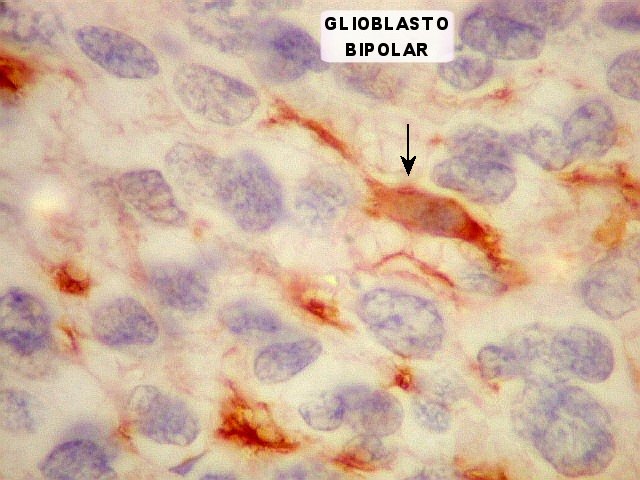
| VIM. Astrócitos em vários graus de diferenciação. Há desde células com mínima orla positiva, passando por glioblastos unipolares (células astrocitárias muito primitivas com um único prolongamento, lembrando a forma de um girino) a células mais e mais complexas, até astrócitos diferenciados. | |
 |
|
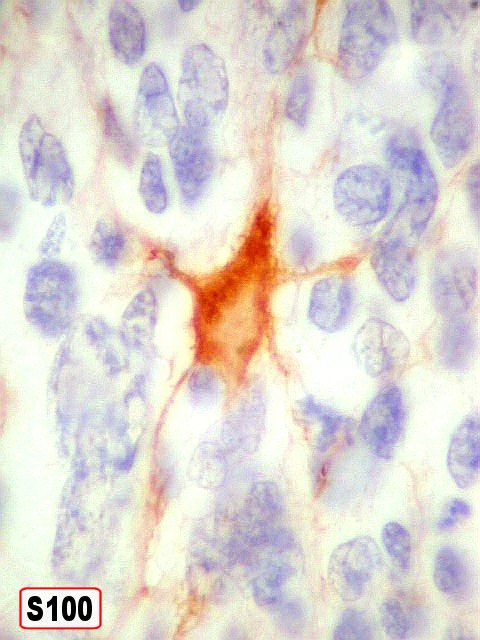
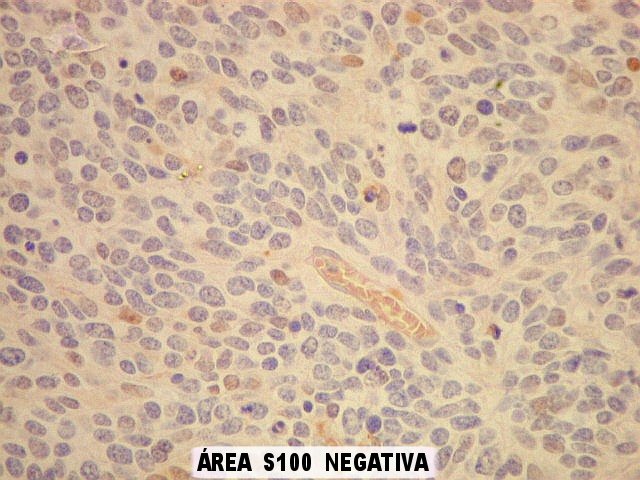
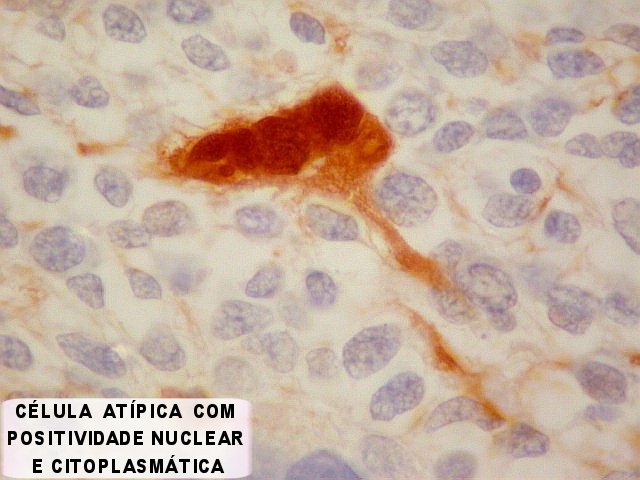
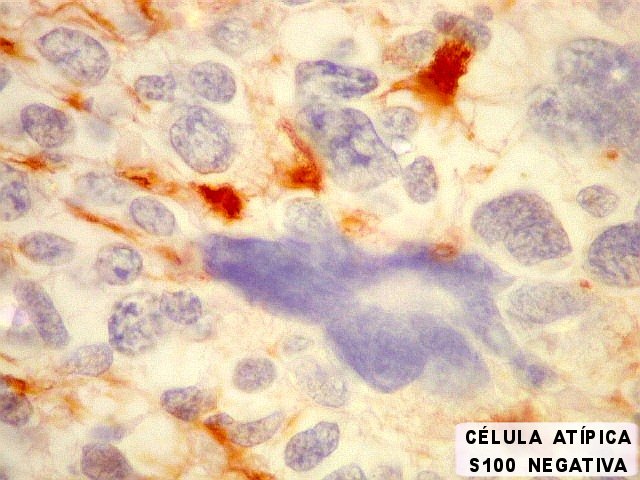
| S-100. Mesmos aspectos já demonstrados com GFAP e VIM. | |
 |
|
 |
|
 |
|
 |
 |
| S100. Astrócitos em vários graus de diferenciação. | |
 |
|
 |
 |
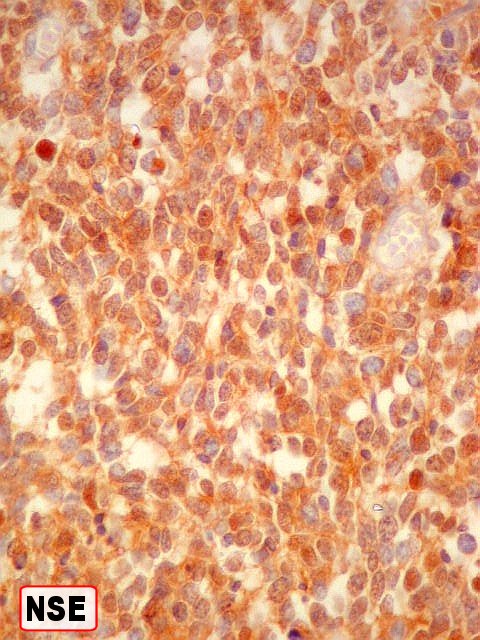
| NSE. Positividade difusa, endossando a natureza neuroectodérmica do tumor. | |
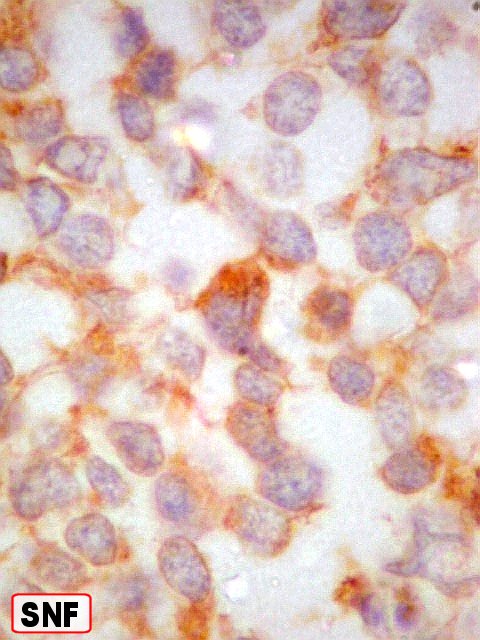
| SNF. Positividade difusa, mas destacando células isoladas (diferenciação neuronal). | |
| CGR. Positividade citoplasmática focal em raras células, negativa na maior parte do espécime (discreta reação de fundo). | |
| NF. Negativo em todas áreas. | |
| CD56 (NCAM). NCAM = Neural cell adhesion molecule. As moléculas de adesão de células neurais são uma família de glicoproteínas que têm importante papel em ligações entre células, bem como na migração e diferenciação celulares. O gene pertence à família das imunoglobulinas. A distribuição é principalmente, embora não exclusivamente, em tecido nervoso. Neste exemplo, o antígeno está presente nas células neoplásicas em padrão membrana. Dentre os tumores de outros sistemas que expressam NCAM estão os carcinomas folicular e papilífero da tiróide, carcinomas renais e hepatocelulares. | |
| CD57
(Leu7, HNK-1). O antígeno Leu7 é
reconhecido pelo anticorpo monoclonal HNK-1. É um epítopo
carboidrato presente em NCAMs e várias outras moléculas de
adesão. A maioria das células neuroendócrinas
e tumores com grânulos neurosecretórios contêm proteínas
NCAM. O antígeno CD57 está presente também em
subgrupos de linfócitos T e células NK (natural killer).
Anticorpos contra CD57 também reagem contra células de Schwann,
oligodendrócitos e várias células neuroendócrinas
dos tipos neural e epitelial. Reagem com proporções variáveis
de schwannomas, neurofibromas e tumores neuroendócrinos, como feocromocitomas
(100%), paragangliomas extraadrenais (85%), carcinóides (85%) e
carcinomas broncogênicos de pequenas células (50%). Contudo,
sua positividade em vários outros tipos de tumores indica que CD57
isoladamente não é confiável para identificação
de tumores neuroendócrinos.
Neste exemplo, o antígeno está presente nas células neoplásicas em padrão membrana. |
|
| AE1AE3. Negativo em toda a amostra,afasta um carcinoma indiferenciado metastático. Para um caso de metástase cerebral de carcinoma neuroendócrino, clique. | |
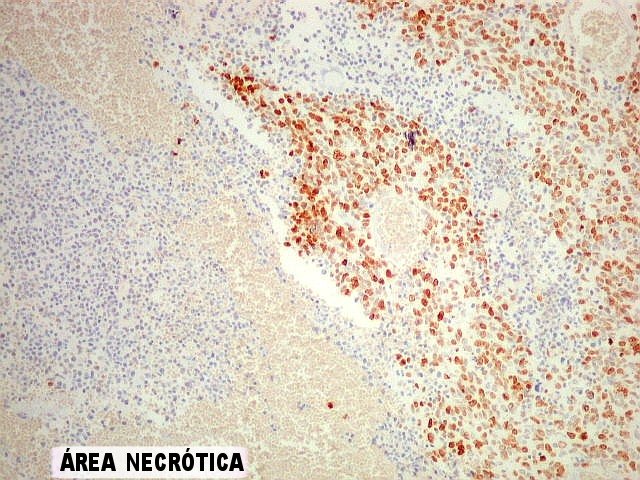
| KI-67. Positivo na quase totalidade das células neoplásicas, sem ou com atipias. Alguns núcleos atípicos são negativos. Células em áreas necróticas não reagem. | |
 |
|
| p53. Positivo na quase totalidade das células neoplásicas. | |
| Para exames de imagem deste caso, clique » |
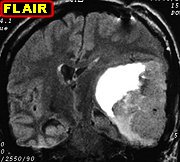 |
| Características de imagem dos PNETs |
| Neuropatologia
- Graduação |
Neuropatologia -
Casos Complementares |
Neuroimagem
- Graduação |
Neuroimagem -
Casos Complementares |
Correlação
Neuropatologia - Neuroimagem |
|
|
|