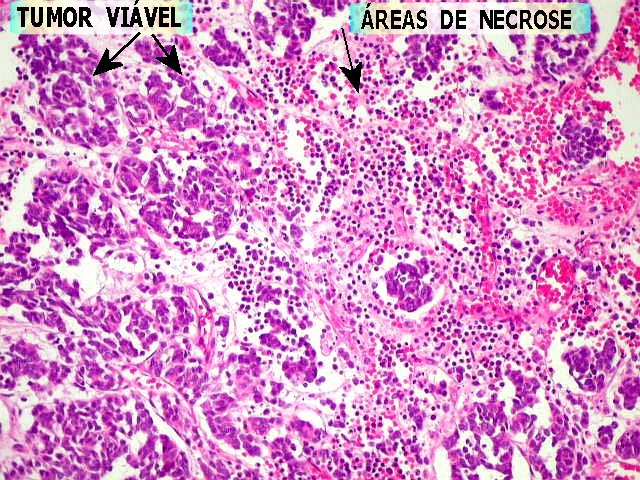
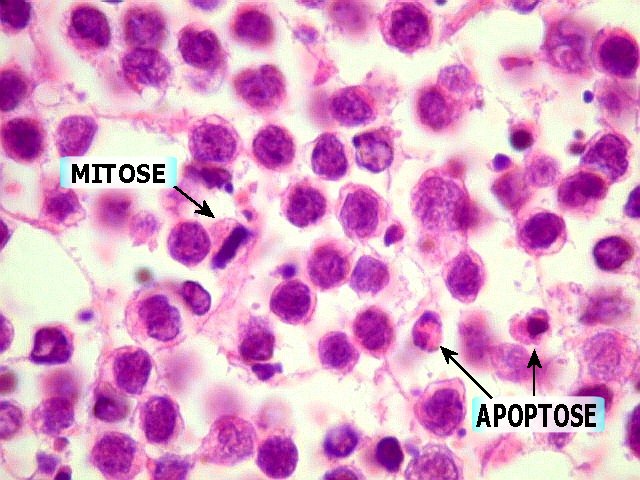
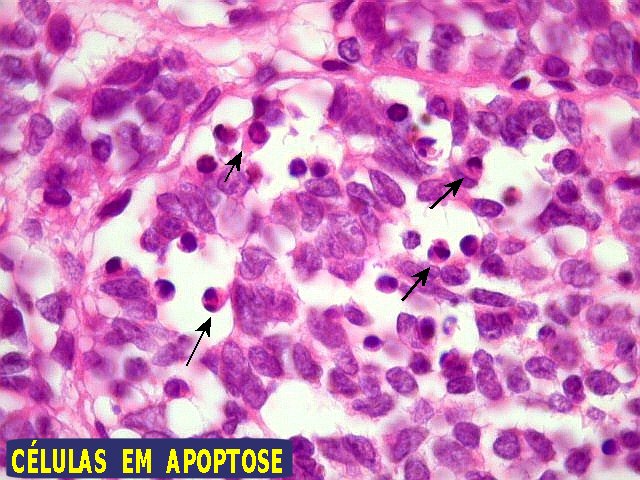
| Comentários
sobre o diagnóstico diferencial. Trata-se
de caso pouco comum.
Inicialmente,
em HE, foram consideradas três possibilidades: PNET (tumor neuroectodérmico
primitivo), metástase de neoplasia pouco diferenciada e linfoma.
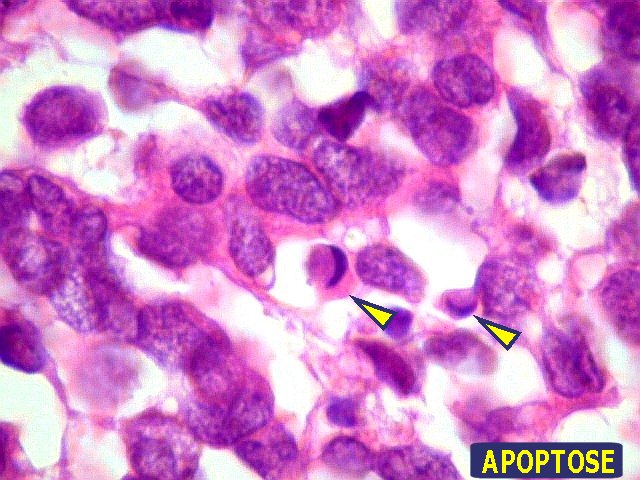
Linfoma.
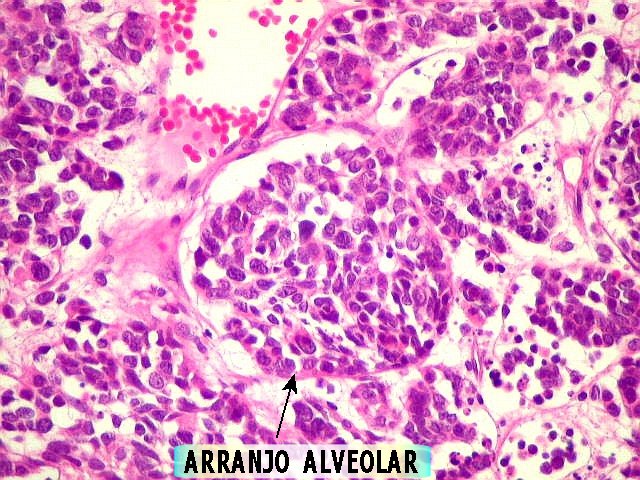
A possibilidade de linfoma foi afastada já na HE pelo aspecto de
células alongadas em arranjo alveolar (que é próprio
de carcinomas indiferenciados). Mesmo assim, foram investigados os antígenos
CD3 (pan-T), CD20 (pan-B) e CD30 (para linfoma de Hodgkin, carcinoma embrionário
e alguns linfomas não-Hodgkin, especialmente os anaplásicos),
que resultaram todos negativos.
PNETs primários
do SNC são raros, à exceção do
meduloblastoma. Rorke et al. (2000), de uma série de 178 PNETs
cerebrais, observou 10 casos supratentoriais (5,6%). A idade variou de
4 semanas a 10 anos, com média de 5,5 anos. A idade de nosso paciente
é 25 anos.
Do ponto
de vista imunohistoquímico, as células neoplásicas
no presente caso são reativas para três antígenos próprios
de neurônios, NSE, cromogranina e sinaptofisina, indicando
linhagem neuroectodérmica.
A reação
para CD-99, uma glicoproteina presente na maioria dos tumores
periféricos embrionários, inclusive PNETs, resultou negativa.
Gyure et al. (1999), estudando 8 casos de PNETs supratentoriais com idades
variando entre 2 meses e 40 anos, observou negatividade para CD99 em todos
os casos. Este resultado sugere diferenças patogenéticas
entre PNETs centrais e periféricos.
Por outro
lado, as células neoplásicas reagiram de forma intensa e
difusa para AE1AE3 (pancitoqueratina), sendo várias com padrão
dot.
É conhecido que alguns PNETs fora do SNC apresentam positividade
para queratina. Esta foi descrita em 10 de 50 casos de sarcoma de Ewing/PNET
(Gu et al., 2000). Contudo, expressão de queratinas não
é descrita em PNETs primários do SNC (Rorke et al., 2000),
inclusive meduloblastomas (Giangaspero et al., 2000).
Assim, concluímos
que a neoplasia no presente caso reune os critérios para um
carcinoma
neuroendócrino. Como não conhecemos
relatos de casos primários deste tipo de tumor no SNC, acreditamos
que a neoplasia é muito provavelmente metastática.
Possíveis sítios primários incluem nasofaringe e brônquios.
Até o momento, ao que sabemos, não foi detectado um foco
primário.
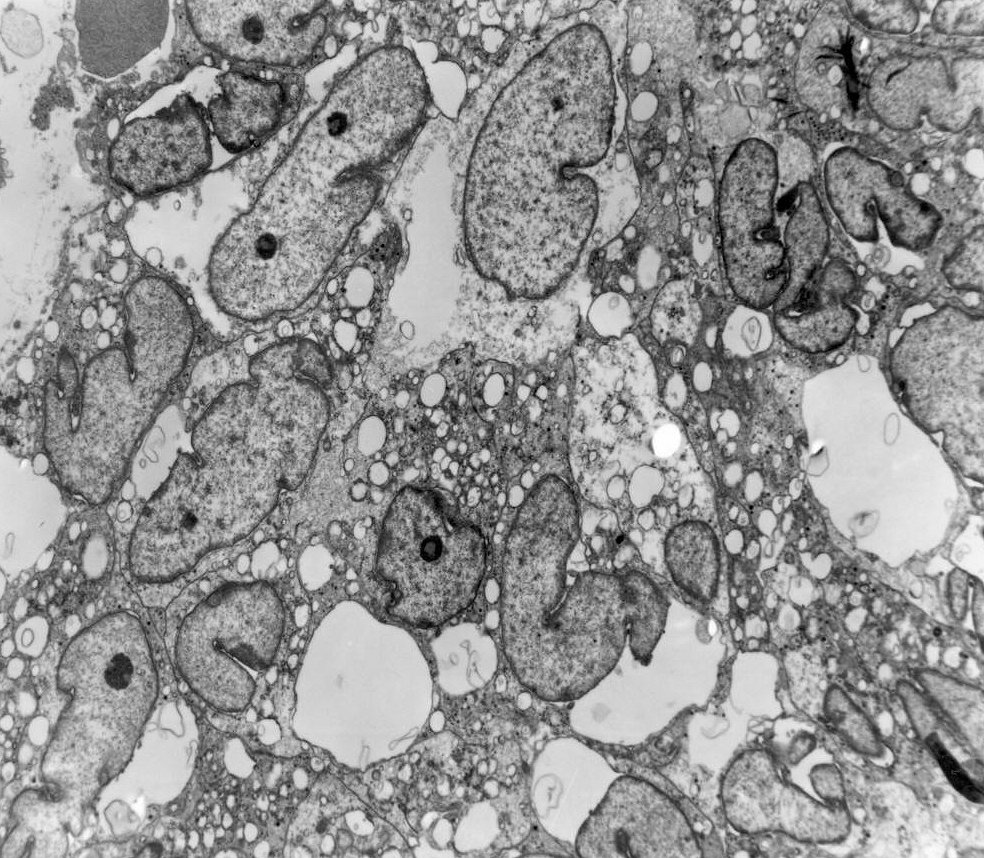
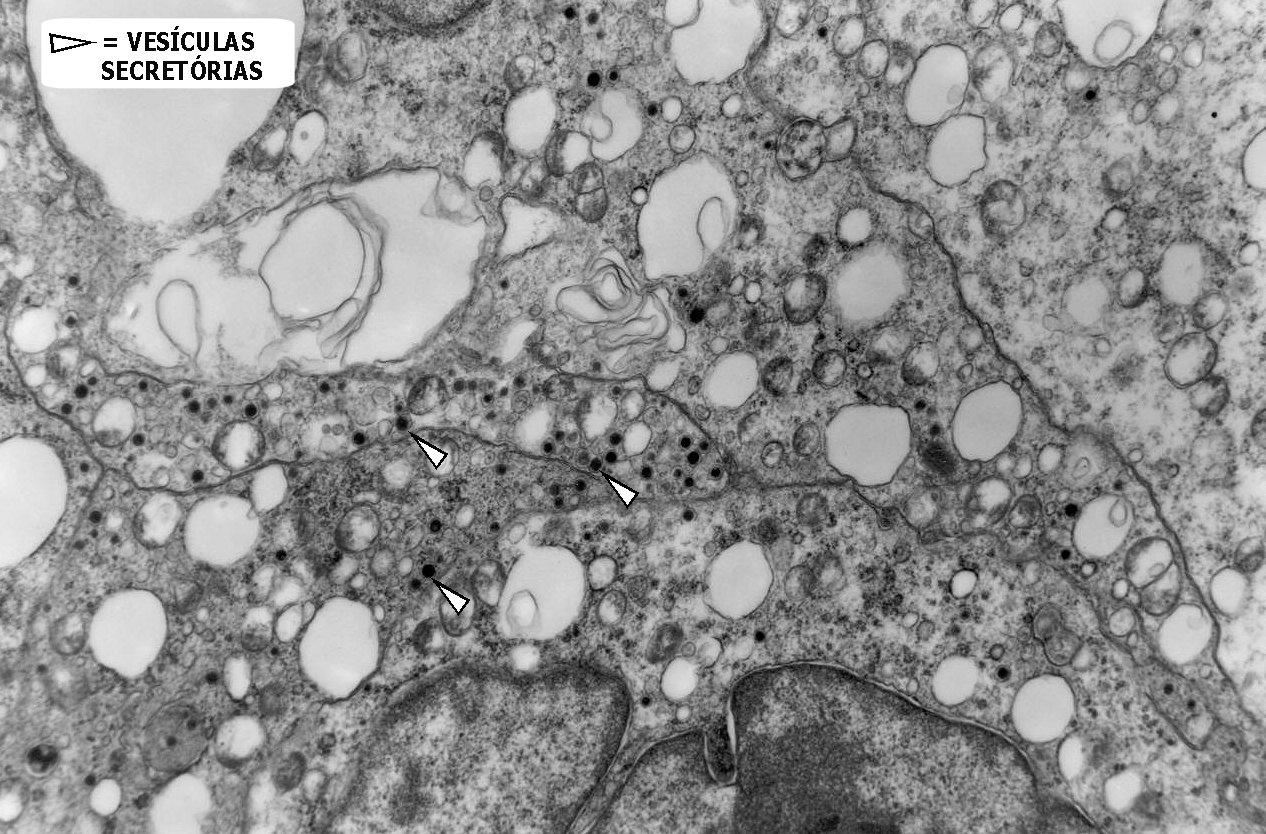
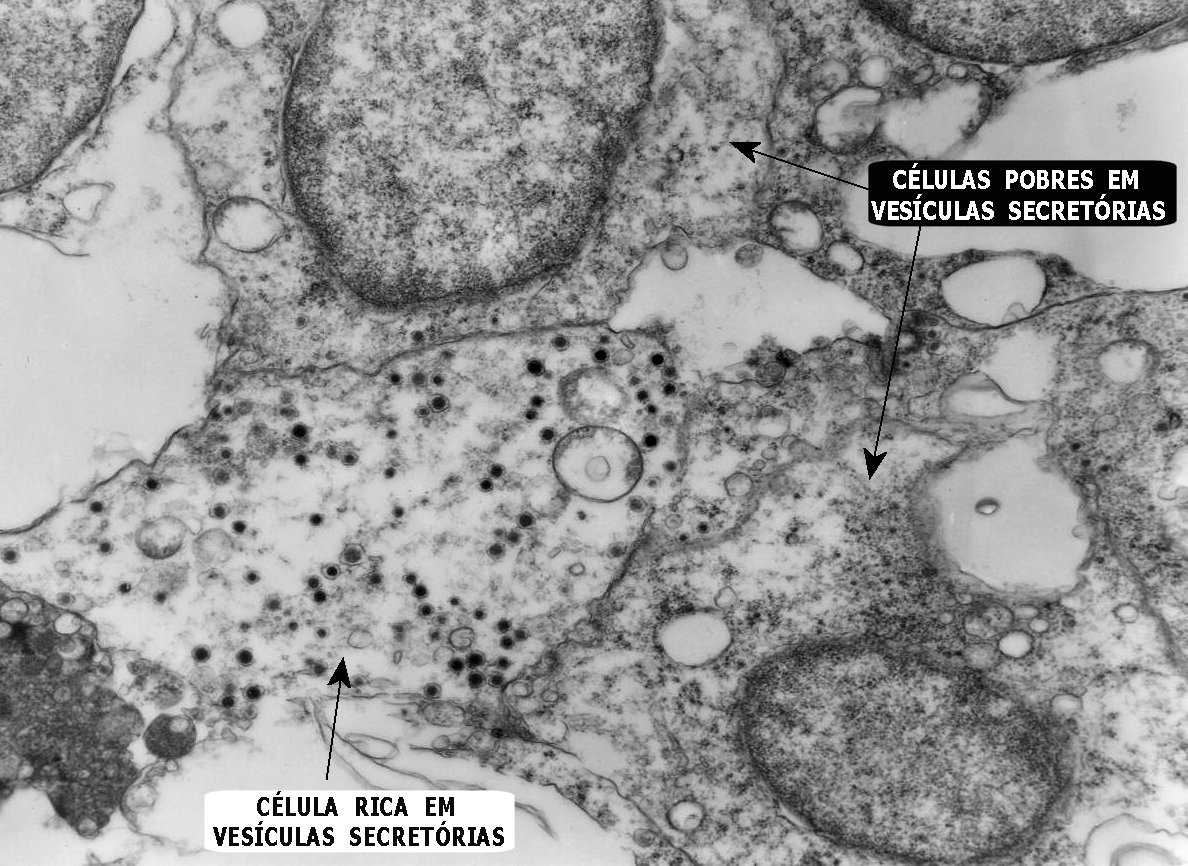
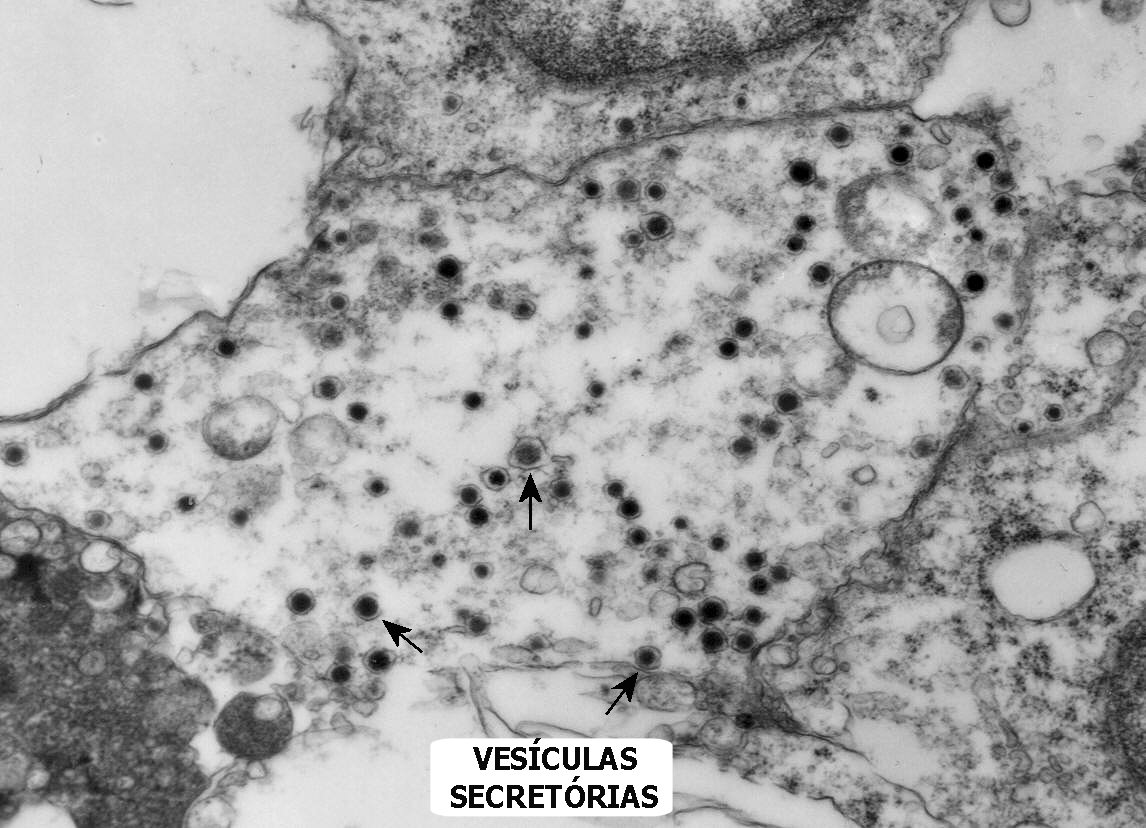
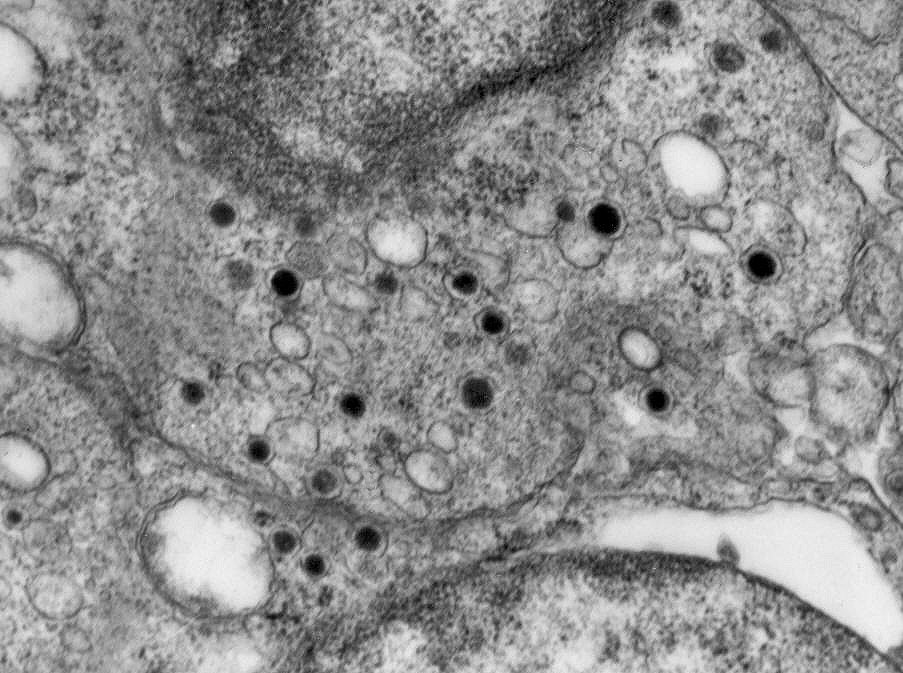
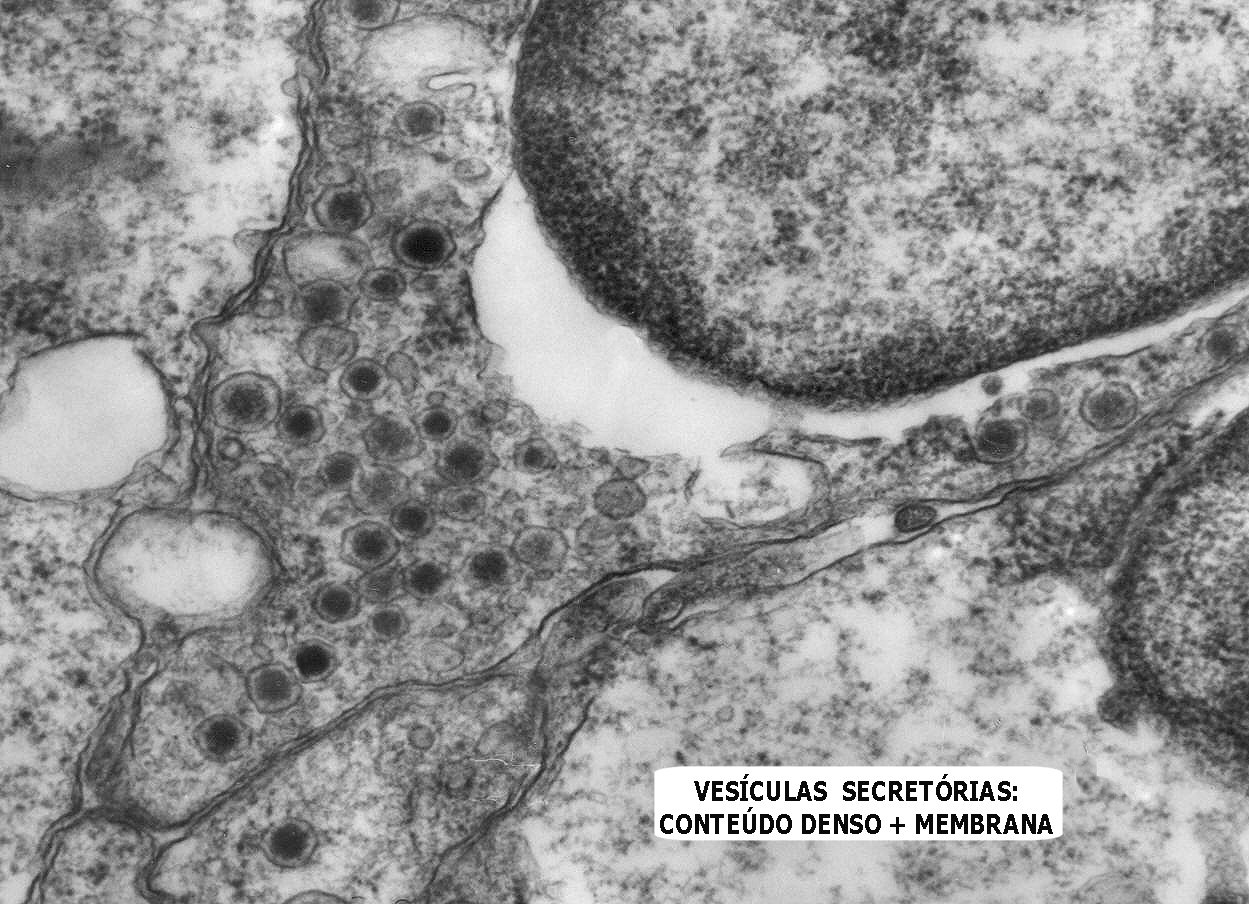
Do ponto
de vista ultraestrutural, a presença de vesículas secretórias
(ou grânulos de neurosecreção) em muitas células
confirma um tumor de linhagem neural, embora possam ocorrer tanto em PNETs
primários (como o neuroblastoma do SNC), como em carcinomas neuroendócrinos.
Referências.
-
Giangaspero
F, Bigner SH, Kleihues P, Pietsch T, Trojanowski JQ: Medulloblastoma. in
Kleihues P, Cavenee WK (eds): Tumours of the Nervous System. Pathology
and Genetics. IARC Press, Lyon, 2000. pp.129-37.
-
Gu M, Antonescu
CR, Guiter G, Huvos AG, Ladanyi M, Zakowski MF: Cytokeratin immunoreactivity
in Ewing's sarcoma: prevalence in 50 cases confirmed by molecular diagnostic
studies. Am J Surg Pathol 24:410-6, 2000.
-
Gyure KA, Prayson
RA, Estes ML. Extracerebellar primitive neuroectodermal tumors: a clinicopathologic
study with bcl-2 and CD99 immunohistochemistry. Ann Diagn Pathol.
3:276-80, 1999.
-
Rorke LB, Hart
MN, McLendon RE: Supratentorial primitive neuroectodermal tumour (PNET).
in
Kleihues P, Cavenee WK (eds): Tumours of the Nervous System. Pathology
and Genetics. IARC Press, Lyon, 2000. pp.141-4.
Agradecimentos
ao Dr. Leandro Luiz Lopes de Freitas e à Profa. Eliana Maria
Ingrid Amstalden por comentários e sugestões úteis
na condução deste caso.
|