| Hans-Joachim
Scherer (1906-1945), pioneiro na pesquisa dos gliomas.
Atualmente é raro
que um artigo seja citado 50 anos após sua publicação.
Uma exceção é o trabalho de Hans-Joachim
Scherer, que nos anos 1930/40,
publicou estudos pioneiros sobre a patologia do glioblastoma multiforme
que se revelaram muito adiantados em relação ao pensamento
biológico de seu tempo.
Scherer nasceu em 14 de
maio de 1906 em Bromberg, na então Prússia
Ocidental, atualmente Bydgoszcz, Polônia. Estudou medicina em Munique
e, em 1930, começou treinamento em Neuropatologia com Walter Spielmeyer
(um dos grandes pioneiros da especialidade), indo depois a Berlim.
Em agosto de 1933, pouco depois da ascensão de Hitler ao poder,
foi preso pela Gestapo. Libertado, fugiu para Antuérpia, na Bélgica,
onde passou a trabalhar no Instituto Bunge, com o Prof. Ludo van Bogaert.
Entre 1934 e 1941 publicou em revistas britânicas, francesas e americanas
de renome a maior parte de seus trabalhos sobre a biologia e patologia
dos gliomas, que o tornaram conhecido e citado até os dias de hoje.
Em 1941, estando a Bélgica sob ocupação nazista, foi
forçado a voltar à Alemanha, onde morreu em 16 de abril de
1945, em Landshut, Bavária, num ataque militar, apenas três
semanas antes do fim da guerra. Tinha então 39 anos.
Seus estudos
sobre gliomas começaram com uma publicação em 1933
sobre o significado do componente mesenquimal em tumores cerebrais.
Distinguiu na época :
a) o estroma
mesenquimal como parte inerente do tumor
b) proliferações
mesenquimais reativas a alterações regressivas no tumor (e.g.
necrose)
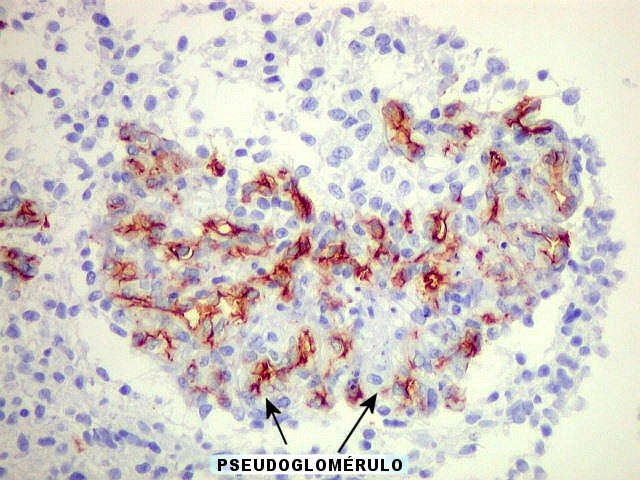
c) formação
de vasos glomerulóides em gliomas malignos.
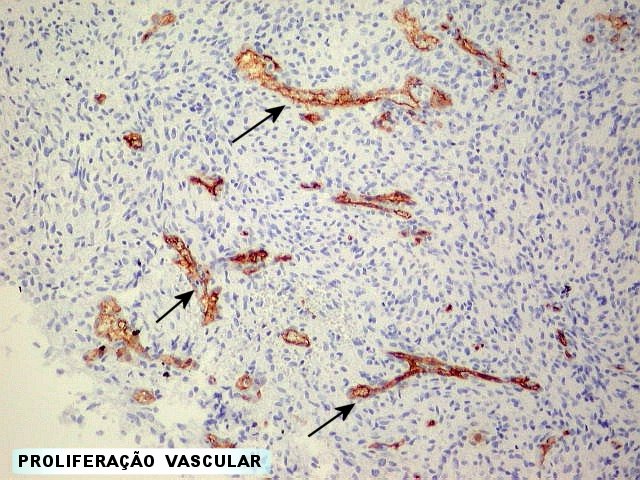
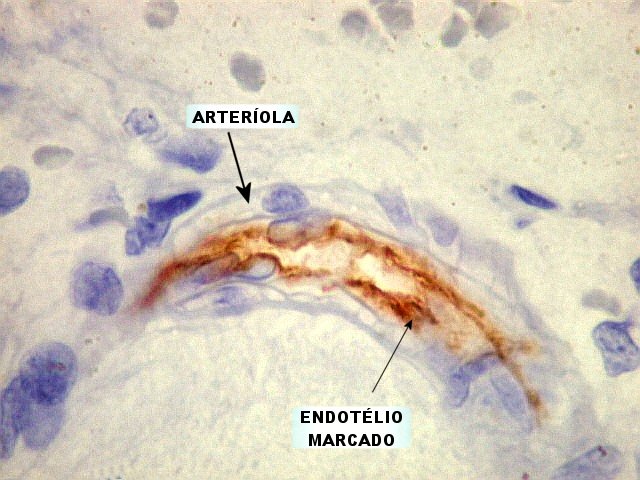
Estudos sobre angiogênese
em gliomas. Em estudos
subseqüentes (1935), Scherer concluiu que a proliferação
vascular era uma conseqüência do crescimento dos gliomas.
Assumiu que focos de necrose tinham papel de indução da proliferação
vascular. Muito adiante de seu tempo, postulou um fator de angiogênese
(que chamou angiotaxis), pois observou que proliferações
glomerulóides freqüentemente se desenvolviam na periferia de
uma zona de infiltração, onde não havia células
tumorais distinguíveis. Concluiu que, nas zonas necróticas,
o tecido tumoral liberava um estimulante com efeito angioplásico.
Essas observações
sobre a interrelação espacial entre crescimento tumoral,
necrose e proliferação vascular são totalmente apoiadas
pelas pesquisas atuais, inclusive o achado de que o gene que codifica o
VEGF (vascular endothelial growth factor) contém um
elemento que responde a isquemia.
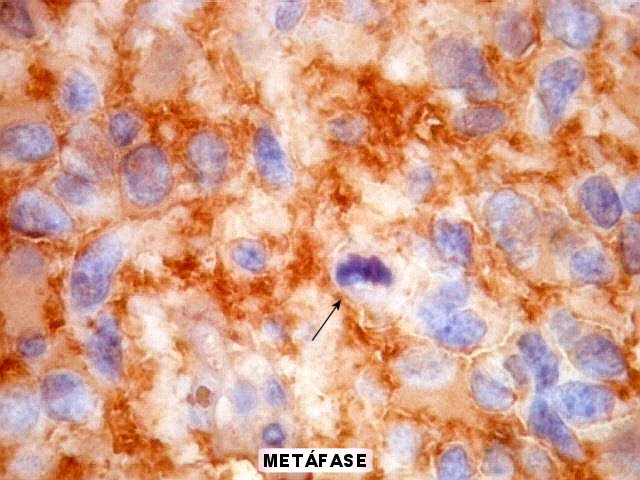
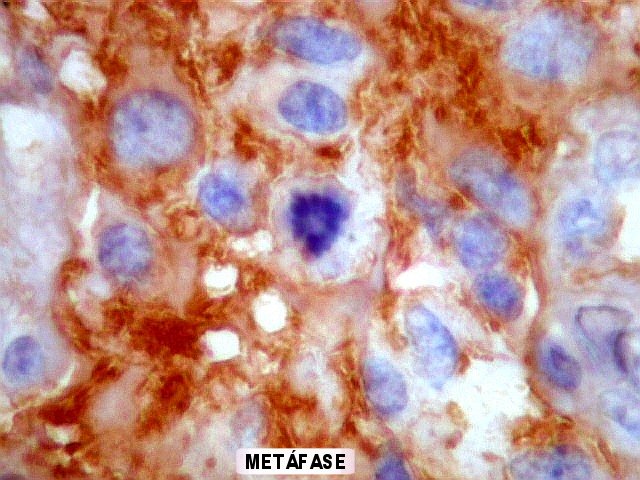
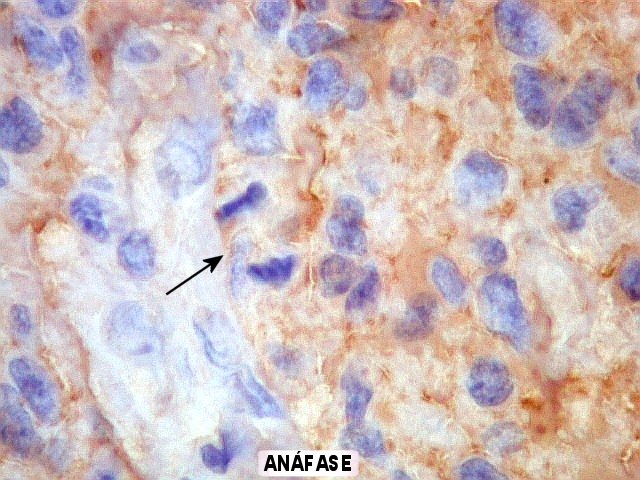
Estruturas primárias,
secundárias e terciárias dos gliomas malignos.
Estas são as observações pelas quais Scherer ficou
melhor conhecido.
As estruturas
primárias ou próprias
de um glioma foram definidas por ele como padrões morfológicos
devidos à biologia intrínseca dos tumores, e que se manifestam
independentemente de tecido pré-existente ou da infiltração
destes pela neoplasia. Exemplos destas estruturas primárias são
rosetas, pseudorosetas, redemoinhos, estruturas papilares, canaliculares
etc.
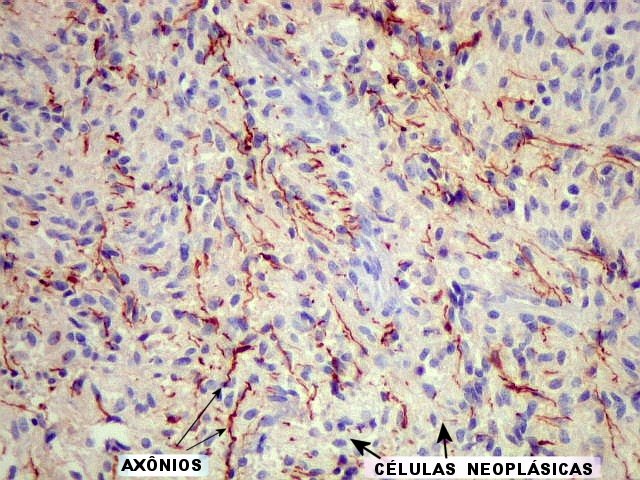
As estruturas
secundárias têm
origem na infiltração de tecido pré-existente
pelas células neoplásicas. Ele descreveu oito tipos de estruturas
secundárias, das quais as melhor conhecidas são os acúmulos
subpiais de células tumorais. Estes resultam da migração
do tumor pelo tecido, e da inabilidade das células de atravessar
a membrana limitante pial para ganhar acesso ao espaço subaracnóideo.
Outras estruturas secundárias semelhantes foram reconhecidas na
região subependimária, acúmulos de células
neoplásicas em torno de vasos (no espaço de Virchow-Robin),
em torno de neurônios (satelitose), e arranjo perifascicular
ou intrafascicular das células ao dissecar entre feixes de axônios.
Todos estes padrões são formados pelo tumor ao encontrar
estruturas ou fronteiras naturais do tecido pre-existente. Scherer
considerou a satelitose perineuronal como um sinal precoce de infiltração
neoplásica e notou que neurônios podem persistir por longos
períodos no interior de um glioma maligno, a morte celular só
ocorrendo tardiamente (neuronofagia tardia).
| As estruturas
terciárias (também
mencionadas no trabalho de 1938) são definidas como formações
morfológicas resultantes da interação do glioma
com células mesenquimais, por exemplo, a proliferação
mesenquimal que se segue à invasão do espaço subaracnóideo
pelo tumor. Esta proliferação secundária também
ocorre como resultado de extensa necrose num glioblastoma, criando uma
área dominada por elementos mesodérmicos, fibrosos e vasculares
(Rubinstein). A degeneração e necrose no tumor primeiro
atrai numerosas células macrofágicas ou microgliais. Com
o tempo há organização, que pode ser acompanhada por
intensa neovascularização, com abundantes capilares num padrão
telangiectásico. Finalmente, instala-se fibrose densa. |
Glioblastomas primários
e secundários.
Ainda outra observação pioneira de Scherer estabeleceu a
diferença entre os chamados glioblastomas primários e secundários.
Em sua publicação de 1940 sobre astrocitomas cerebrais, Scherer
distinguiu estes dois tipos com base em seu modo de evolução.
Os glioblastomas
secundários originam-se de um astrocitoma pré-existente
(de baixo grau), enquanto os glioblastomas primários (também
chamados de novo) já se originam como tal, ou seja,
como tumores de alta malignidade. Escreveu ele: “Do ponto de vista biológico
e clínico, os glioblastomas secundários que se desenvolvem
em um astrocitoma precisam ser distintos dos glioblastomas primários.
Os secundários são provavelmente responsáveis pela
maioria dos glioblastomas de longa evolução.”
Isto novamente
estava adiante do seu tempo. Acreditava-se na época que o glioblastoma
era uma neoplasia separada (não relacionada aos astrocitomas), o
que ainda se refletiu na classificação da OMS de 1979 quando
os glioblastomas não foram agrupados com os astrocitomas, mas sim
numa categoria a parte, de tumores embrionários e pouco diferenciados.
Scherer
foi o primeiro a apontar que os gliomas podem se desenvolver por duas vias
distintas, ou seja, de novo (sem uma lesão precursora
identificável), ou através de progressão a partir
de um astrocitoma de baixo grau ou anaplásico. Estudos moleculares
atuais mostram que estes dois subtipos desenvolvem-se através de
vias genéticas distintas. O glioblastoma primário tipicamente
contém amplificação do receptor para EGF (epidermal
growth factor), mutações no gene PTEN, amplificações
de MDN2 e deleções de P16. O glioblastoma secundário
geralmente se inicia por uma mutação pontual no gene supressor
tumoral p53. A duração total da doença é muito
maior no glioblastoma secundário. Até hoje não há
características morfológicas inequívocas que permitam
distinguir estes dois subtipos de glioblastoma.
O Prof.
Lucien J. Rubinstein (um belga de origem judia, refugiado em Londres, onde
iniciou sua carreira ao lado da Profa. Dorothy S. Russell, ambos autores
de um dos mais importantes livros sobre tumores do sistema nervoso) escreveu:
As contribuições de Scherer sobre os gliomas foram fundamentais
para compreender os processos de expansão e infiltração
destas neoplasias, e deram importantes informações sobre
as relações entre tumor e hospedeiro.
Extraído de
-
Peiffer J,
Kleihues P. Hans-Joachim Scherer (1906-1945), pioneer in glioma research.
Brain Pathology 9:241-5, 1999.;
com adições
de
-
Rubinstein
LJ. Tumors of the Central Nervous System. Atlas of Tumor Pathology,
2nd Series, Fascicle 6. Armed Forces Institute of Pathology, Washington
DC, 1972.
Principais
trabalhos de H-J Scherer sobre gliomas :
-
Scherer HJ
(1933) Die Bedeutung des Mesenchyms in Gliomen. Virchows Arch 291:321-40.
-
Scherer HJ
(1935) Gliomstudien III. Angioplastische Gliome. Virchows Arch 294:823-86.
-
Scherer HJ
(1938) Structural development in gliomas. Am J Cancer 34:333-51.
-
Scherer HJ
(1940) Cerebral astrocytomas and their derivatives. Am J Cancer 40: 159-98.
-
Scherer HJ
(1940) The forms of growth in gliomas and their practical significance.
Brain 63:1-35.
-
Scherer HJ
(1940) The pathology of cerebral gliomas. A critical review. J Neurol 3:147-77.
Sobre
a vida e obra do Prof. Rubinstein:
-
Mut M, Lopes
MBS, Shaffrey M (2005) Lucien J. Rubinstein: enduring contributions to
neurooncology. Neurosurg Focus 18 (4) E 8. (pode ser obtido
como PDF através de Google).
|